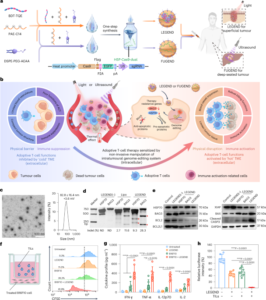
ללמוד עיצוב
מחקר זה אושר על ידי משרד האתיקה המחקרית של McGill (מועצה לביקורת מוסדית, A03-M24-21B). היא נועדה לפתח פלטפורמה אוניברסלית לזיהוי מולקולרי של זיהומים בדרכי הנשימה בנקודת הטיפול. השתמשנו בחלקיקים ויראליים מושבתי חום של H1N1, SARS-CoV-2 RNA ו-SARS-CoV-2 לאבחון מהיר המבוסס על מבחני RT-LAMP משופרים מבחינה פלסמונית. MERS-CoV RNA ו-HCoV-229E RNA שימשו כבקרות שליליות עבור מבחני RT-LAMP. יתר על כן, בדיקת RCA שימשה לזיהוי ספציפי של גרסאות SARS-CoV-2 מדאיגות. לבסוף, השתמשנו ב-33 דגימות אנושיות לא מזוהות SARS-CoV-2 (מאומת RT-PCR) שהתקבלו מ-PRESERVE Pandemic Response Biobank של University Health Network וב-15 דגימות SARS-CoV-2 שליליות (אומת qPCR) כבקרות במדגם החולה. לימוד. כהוכחה לעיקרון, פרופיל DNA של החיידק ו-MRSA בוצע באמצעות מבחני LAMP. aeruginosa Pseudomonas שימש כבקרה שלילית עבור מבחני LAMP. מחקר זה נערך במונטריאול, קנדה, מאפריל 2020 עד דצמבר 2022.
חומרים
החומרים הגיעו כדלקמן: ננו-חרוזי פוליסטירן (חלקיקי פוליסטירן (PS-R); חלקיקי מיקרו); SARS-CoV-2 RNA סינתטי (American Type Culture Collection (ATCC); Cedarlane); SARS-CoV-2 B.1.1.7 אלפא וריאנט RNA (ATCC VR-3326D; Cedarlane); MERS-CoV (ATCC VR-3248SD; Cedarlane); SARS-CoV-2 מושבת בחום (ATCC VR-1986HK; Cedarlane); שפעת H1N1 מושבתת בחום A, זן NY/01/09 (0810248CFHI; Cedarlane); ו החיידק (מס' 211540, מרלן סיינטיפיק). מיקס מאסטר קולורימטרי RT-LAMP ואנזים HiFi Taq DNA Ligase (New England Biolabs); PLPs, פריימרים RCA ומטרות cDNA סינתטיות SARS-CoV-2, MgCl2, KCl, nicotinamide adenine dinucleotide (NAD) ו-Triton X-100 (Sigma Aldrich); ו-LAMP primers ו-dithiothreitol (DTT) (Thermo Fisher Scientific) שימשו. רוק אנושי בריא מאוחד (IRHUSL50ML) ורוק אדם בריא תורם יחיד (IRHUSL5ML) נקנו מ-Innovative Research ואוחסנו עם ההגעה ב-80 °C. דגימות RNA של SARS-CoV-2 (Omicron, Delta, Eta ו-Gamma) התקבלו מהמעבדה המשותפת באוניברסיטת McGill (Vidal Lab). HCoV-229E RNA הושג מהמעבדה המשתפת במכון ליידי דייוויס למחקר רפואי בבית החולים הכללי היהודי (מעבדת סי ליאנג). MRSA DNA ו פ aeruginosa ה-DNA התקבל ממעבדת D. Nguyen במכון המחקר של מרכזי הבריאות של אוניברסיטת מקגיל (MUHC). כל המבחנים הוכנו באמצעות מים מזוקקים ללא UltraPure DNase/RNase (Thermo Fisher Scientific).
פריימרים ובדיקות
הפריימרים של SARS-CoV-2 RT-LAMP ששימשו במחקר זה תוכננו על ידי Yu et al.32 לכוון את RdRp גן ב-ORF1ab של הגנום (מומלץ על ידי ארגון הבריאות העולמי כגן מטרה לזיהוי SARS-CoV-2)31. סלקטיביות הפריימר אושרה באמצעות ניסוי אלקטרופורזה בג'ל (איור משלים. 16a). ההרכבים והריכוזים של הפריימרים זמינים בטבלה משלימה 6.
פריימרים H1N1 RT-LAMP תוכננו עם New England Biolabs LAMP Primer Design Tool המכוון לרצפים שמורים מאוד של הגן המגלוטינין (HA) של H1N1 IAV. החלק של זיהוי LAMP הוערך על ידי הכלי הבסיסי לחיפוש יישור מקומי50, ולא נראו שינויים ברצף ב-100 כניסות שסופקו על ידי אתר המרכז הלאומי למידע ביוטכנולוגיה. הפריימרים המועמדים של LAMP נבחרו על פי הפרמטרים האופטימליים המוצעים על ידי פרוטוקול Primer Explorer V5. סלקטיביות הפריימרים אושרה עוד יותר באמצעות ניסוי אלקטרופורזה בג'ל (איור משלים. 16b). ההרכבים והריכוזים של הפריימרים זמינים בטבלה משלימה 7.
אתרי המוטציה P681H ו-L452R נקבעו על פי הכלים CoV-GLUE-Viz ו-GISAID36,51, וחלקי זיהוי PLP תוכננו להיות ספציפיים למוטציות36. בנוסף, אתר היעד של PLP לזיהוי WT SARS-CoV-2 היה RdRp הגן, שהוא זהה לאתר המיקוד עבור פריימרים של SARS-CoV-2 LAMP. ה-PLPs מתוכננים באופן שבו ה-SNP נבדל על ידי ה-PLP במעלה הזרם, המספק את קבוצת ה-3'-hydroxyl בצומת הקשירה הבסיסית בזוג ליד קצה 5' הפוספוריל על גדיל מטרה. האמיתות של מחזור PLP לאחר זיהוי SNP נקבעה באמצעות מחשבון טמפרטורת תגובת ליגאז תרמי המסופק על ידי New England Biolabs. לאחר מכן, ה-PLPs הוערכו באמצעות שרת האינטרנט Mfold כדי למנוע מבנה משני לא רצוי, במיוחד באתר זיהוי PLP. פריימרים קדימה ואחורי RCA תוכננו להכלאה לחלק המרווח של PLPs שמחבר בין שתי זרועות ספציפיות של ה-PLP לחלוטין. סלקטיביות PLP אושרה באמצעות ניסוי אלקטרופורזה בג'ל (איור משלים. 21). קומפוזיציות וריכוזי PLP, כמו גם קומפוזיציות וריכוזי פריימר RCA והרכב cDNA, זמינים בטבלאות משלימות 8-10.
פריימרים החיידקיים LAMP המשמשים במחקר זה תוכננו על ידי Hill et al.52 עבור הכוונה ל E. coli malB gene ו Chen et al.53 למיקוד MRSA mecA גֵן. ההרכבים והריכוזים של פריימרים זמינים בטבלאות משלימות 11 ו 12.
הכנת בדיקה
עבור מבחני RT-LAMP, נעשה שימוש בנפח תגובה סטנדרטי של 20 µl. נפח זה כלל 2 µl ×10 תערובת פריימר, 10 µl ×2 תערובת אב, 7 µl מים ללא RNase ודגימת RNA של 1 µl. דגימות ויראליות שהושבתו בחום עברו תחילה ליזה תרמית ב-95 מעלות צלזיוס למשך 3 דקות ולאחר מכן ערבבו עם הבדיקה. לאחר מכן, דגירה ב-65 מעלות צלזיוס לתקופות שונות כדי לדמיין שינוי צבע לעומת זמן עבור דגימות שונות.
תגובת קשירת PLP בוצעה בנפח סופי של 10 μl כולל 1 μl cDNA סינתטי של גנום SARS-CoV-2 RNA, 1 μl של 1 μM PLP, 2 μl מים מזוקקים UltraPure ו-5 μl × 2 Hi-Firs ללא HC תמיסת קשירת Taq DNA Ligase (20 mM MgCl2, 20 mM KCl, 2 mM NAD, 0.1% Triton X-100, 20 mM DTT, pH 8.50) ו-1 μl HiFi Taq DNA Ligase. תערובת הקשירה הודגרה תחילה ב-95 מעלות צלזיוס למשך 5 דקות עבור דנטורציה של DNA ולאחר מכן מקוררה לטמפרטורות חישול PLP (שהן 60, 58 ו-55 מעלות צלזיוס עבור P681H, L452R ו-WT PLPs, בהתאמה) כדי לאפשר ל-PLPs ולהכליא עם cDNA לקשור באמצעות אנזים HiFi בתרמוסיקלר (Analytik Jena). לאחר מכן, תגובת הקשירה השתמשה ב-12 μl של WarmStart Colorimetric LAMP ×2 Master Mix ו-1.6 μM RCA לאחור וקדימה בנפח סופי של 24 μl. תגובת ההגברה של RCA בוצעה ב-65 מעלות צלזיוס לתקופות שונות כדי לדמיין את השינוי בצבע מול זמן עבור דגימות שונות.
עבור מיצוי DNA חיידקי, החיידק דגימות תורבו לילה בטמפרטורה של 37 מעלות צלזיוס במדיה של Luria Broth. ריכוז החיידקים נקבע באמצעות ספקטרופוטומטר Spectronic 21D. מנות בריכוזים שונים של 107 CFU ml-1, 105 CFU ml-1, 104 CFU ml-1, 103 CFU ml-1, 102 CFU ml-1 ו-10 CFU ml-1 הוכנו על ידי השעיה החיידק תרבויות בתקשורת מרק לוריא. החיידק ה-DNA הוצא על ידי הרתחת תרביות ב-95 מעלות צלזיוס למשך 10 דקות. MRSA DNA הושג ממרכז הבריאות של אוניברסיטת מקגיל בשיטת תמוגה כימית. כל ריכוזי דגימת ה-DNA נמדדו באמצעות ספקטרופוטומטר Nanodrop 2000 והושעו ב-Universal Buffer 48 (Bio Basic) כדי להשיג ריכוזים רצויים.
מבחן QolorEX עבור SARS-CoV-2 נבדק פתרונות ספיקים (מים ללא RNase ורוק בריא) של 8 × 105 עותקי RNA μl-1 ל-5 עותקי RNA μl-1 של SARS-CoV-2 RNA ו-90 חלקיקים ויראליים μl-1 עד 0.01 חלקיקים ויראליים μl-1 ל-SARS-CoV-2 מושבת בחום כדי להתאים לטווח רלוונטי מבחינה ביולוגית. באופן דומה, בוצע מחקר עבור Delta B.1.617.2, Omicron B.1.1.529, Omicron BA.4, Omicron BA.2.21, Omicron BA.5.2, Omicron BA.5.1.1, Eta B.1.525 ו-Gamma P .1 עם 8 × 105 עותקי RNA μl-1 כדי 104 עותקי RNA μl-1.
מבחן ה-QolorEX עבור H1N1 חקר פתרונות ספיקים (מים ללא RNase ורוק בריא) של 8 × 105 עותקי RNA μl-1 ל-5 עותקי RNA μl-1 של H1N1 שפעת A RNA. עבור מחקרי סלקטיביות, נעשה שימוש ב-RNA מנגיפים מרובים (SARS-CoV-2, MERS-CoV ו-HCoV-229E) ב-8 × 105 עותקי RNA μl-1.
מבחן QolorEX עבור החיידק חקר תמיסות ספיקים (מים ללא RNase) של 7.2 × 106 עותקי gDNA ml-1 ל-7.2 עותקי gDNA ml-1, שווה ערך ל-0.0343 ng μl-1 עד 3.43 × 10-8 ng μl-1 of החיידק DNA. למחקרי סלקטיביות, DNA ממספר חיידקים (החיידק, MRSA ו פ aeruginosa) נבדק בריכוז של 102 עותקי gDNA μl-1.
מבחן ה-QolorEX עבור MRSA חקר פתרונות ספיקים (מים ללא RNase) של 105 עותקי gDNA ml-1 ל-1 עותק gDNA ml-1, שווה ערך ל-3.05 × 10-4 ng μl-1 עד 3.05 × 10-9 ng μl-1 של MRSA DNA. למחקרי סלקטיביות, DNA ממספר חיידקים (MRSA, החיידק ו פ aeruginosa) נבדק בריכוז של 102 עותקי gDNA μl-1.
בדיקת QolorEX RCA בוצעה בתמיסות ספיקים (מים ללא RNase ורוק בריא) של 8 × 105 עותקי cDNA µl-1 ל-5 עותקי cDNA µl-1 של cDNA סינתטי של רצפי P681H, L452R ו-WT SARS-CoV-2. עבור סלקטיביות, P681H PLP הוערך בנוכחות P681H, WT-P681H ו-L452R cDNA. אותה אסטרטגיה הופעלה לבדיקת סלקטיביות של L452R PLP באמצעות יעדי cDNA L452R, WT-L452R ו-P681H וכן WT PLP בנוכחות רצפי cDNA WT, P681H ו-L452R. כל יעדי ה-cDNA הוערכו בריכוזים של 105 עותקי cDNA µl-1.
תיבת טיפול והדמיה אוטומטית של QolorEX
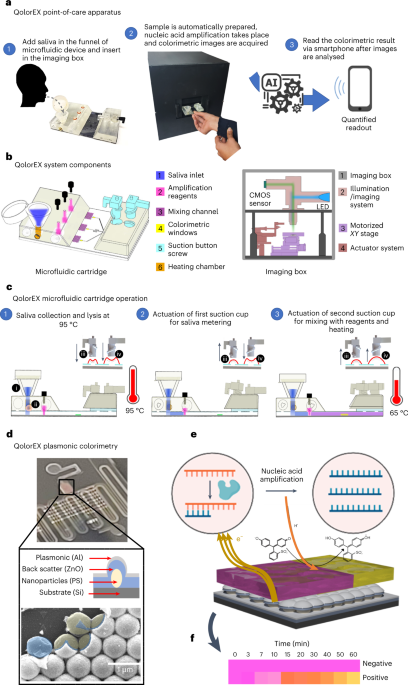
מערך ההדמיה הנייד כולל שלושה מרכיבים עיקריים: מערך הדמיית אפי-תאורה, מודול טיפול בנוזלים ורכיבי אוטומציה (איור משלים. 1). המתחם החיצוני של המערך מיוצר לחלוטין על ידי הדפסה תלת-ממדית (Prusa I3 Mk3, Prusa) ברזולוציית שכבה של 3 מ"מ.
מערך הדמיית אפי תאורה תוכנן ללכוד את השינוי הקולורימטרי של תמיסת הבדיקה. מערך ההדמיה כולל מודול תאורה ומודול לכידה ועיבוד תמונה. אובייקטיבי ×20 (TU Plan Fluor EPI ×20, Nikon) שימשה כעדשת הקבל ללכידת תמונה. כל הרכיבים האופטיים שהופעלו נרכשו מ- Thorlabs. התמונה הסופית מוקרנת על חיישן CMOS (Sony IMX477R, 12.3MP, Raspberry Pi.) ומעובדת עוד יותר על ידי Raspberry Pi 4 (Raspberry Pi).
עבור אוטומציה של תהליכים, השתמשנו בחמישה מפעילים ליניאריים (Actuonix) המבצעים מספר שלבים בטיפול בנוזלים (איורים משלימים. 1-3). ההתקנה משתמשת במודול מחמם, שהוא ברזל הלחמה נייד (TS-100), לתמוגגת דגימות. א XY שלב התרגום הופעל כדי לסרוק אזורים פנים ובין אזורים שונים של תאי הגילוי. השתמשנו בשלב בקרה מספרית ממוחשבת מונחית ליניארית המונעת על ידי מנוע צעד (FUYU). גם מערכת ההפעלה וגם הבמה נשלטים באמצעות מיקרו-בקר Arduino UNO (Arduino). שני גופי החימום נשלטים באמצעות מודול ממסר דו-ערוצי (Yizhet). העברה וניתוח אוטומטיים של נתונים במערכת שלנו נשלטים על ידי מיקרו-בקר Raspberry Pi 4 (Raspberry Pi). התוצאות מוצגות באפליקציה שתוכננה על ידי MIT App Inventor (איור משלים. 2).
ייצור מחסנית מיקרופלואידית ופלטפורמה פלסמונית
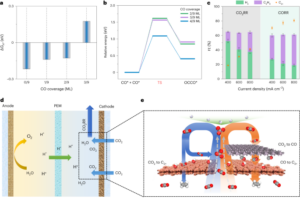
תהליך הייצור פעל לפי פרוטוקול שנקבע27,54,55 והוא מפורט ב מידע משלים (איור משלים. 5). בקצרה, המחסנית המיקרופלואידית מבוססת על פרוסת סיליקון בגודל שישה אינץ'. תהליך ליטוגרפיה בן שלושה שלבים משמש לדוגמא של אלמנט המחמם המעורער והתכונות המיקרו-נוזליות. ראשית, מבוצע שלב ליטוגרפיה להעברת תכונות התנור (רוחב, 400 µm) והרפידה (אורך, 5 מ"מ; רוחב, 2 מ"מ) לשכבת פוטו-רזיסט דרך פוטומסכת עם הדוגמאות הרצויות. לאחר מכן, תחריט תחמוצת מבוקרת להסרת התחמוצת המקומית וחריטת אשלגן הידרוקסיד עבור תחריט סיליקון של 200 ננומטר. לאחר מכן, מתבצע תהליך הרמה להצבה סלקטיבית של גופי החימום בחריצים החרוטים. זה מתחיל בשלב ליתוגרפיה שני ואחריו שקיעת קרן אלקטרונים של 240 ננומטר Al באמצעות Temescal BJD 1800. בהתאם לכך, ההרמה הושלמה על ידי טבילה במסיר מתאים. לאחר מכן, שלב הליטוגרפיה האחרון מתבצע כדי לעצב את תכונות ההתקן הנוזליות כולל יציאות כניסה/יציאה (קוֹטֶר 2 מ"מ), תא תמוגה (אורך, 1.74 מ"מ; רוחב, 1.5 מ"מ; עומק, 50 μm), תעלות ערבוב (רוחב, 200 μm; גובה, 50 μm) וחלון פלסמוני (אורך, 1.94 מ"מ; גובה, 1.5 µm) לתוך שכבת SU-50 (SU-8 8). לאחר מכן, רקיקת שישה אינץ' נחתכת לקוביות לשבבים בודדים (אורך, 2050 מ"מ; רוחב, 26.5 מ"מ) באמצעות מסור חיתוך Disco DAD 35.
לאחר מכן, השילוב של הפלטפורמות הרגישות לצבע במחסנית המיקרופלואידית באמצעות טכניקת ננו-דפוס חסרת אגדות. גישה גנרית משמשת לפיתוח מונו-שכבה להרכבה עצמית קולואידית של ננו-חלקיקים בממשק מים-אוויר56. לאחר מכן, מבני חלת הדבש המתקבלים מועברים לתא זיהוי הצבע במחסנית המיקרופלואידית. לאחר מכן, סרט דק ZnO (120 ננומטר) מופקד, ואחריו שכבת Al דקה (10 ננומטר) כדי לספק תהודה פלסמונית מקומית של פני השטח עם רקע לבן.
Polydimethylsiloxane (PDMS) מוכן באמצעות יחס של 10:1 של אלסטומר לצולב, מנוזל גז במייבש ומודגרה ב-65 מעלות צלזיוס למשך הלילה. PDMS שנרפא נחתך בגודל המחסנית המיקרופלואידית, ויציאות כניסה/יציאה מנוקבות באמצעות אגרוף PDMS (Thermo Fisher Scientific) ומשמשות לאטום ההתקנים. תהליך האיטום כולל טיפול פלזמה של 50 שניות ואחריו דגירה של לילה ב-105 מעלות צלזיוס. לאחר מכן, יוצרה שכבת כוס יניקה מבוססת PDMS באמצעות תבניות מודפסות תלת-ממדיות בסטריאוליטוגרפיה (SLA) (טופס 3, Formlabs). כוסות היניקה הוצמדו לאחר מכן לשכבת ה-PDMS הנוזלית על ידי הדבקה המופעלת בפלזמה.
מחסניות לעיבוד דוגמאות (מיוצרות באמצעות מדפסת SLA 3D ברזולוציה של 50 µm על z ציר) מחוברים לשבב המיקרו-נוזל המכוסה PDMS באמצעות סרט דו צדדי המסייע לחיבור המופעל בפלזמה ומכניסים לתנור ב-95 מעלות צלזיוס למשך 90 דקות. במחסנית המודפסת בתלת-ממד, יש שני תוספות מתכת פליז (McMaster Carr) לתמוגגת דגימות.
עיבוד תמונה
עיבוד תמונה מתחיל עם מערך נתונים המורכב מתמונות משולשות מכל מצב שנחקר, אשר יחולקו למיני-תמונות כדי ליצור סך של 40 ו-60 נקודות נתונים לכל תנאי עבור רגישות וסלקטיביות, בהתאמה. במיוחד עבור הדגימות הקליניות, כל אחת מהן נחקרה בשלושה תאי איסוף מקבילים של השבב המיקרופלואידי; מכיוון שכל התמונות צולמו בשלושה עותקים ולאחר מכן מחולקות, נבדקו סך של 90 נקודות נתונים עבור כל מדגם של מטופל. כל עיבוד התמונה מורכב מחיתוך 20% החיצוניים של תמונת ה-RGB המקורית כדי להסיר את אפקט טבעת הקפה57, ואחריו יישום סינון כחול, שבו פיקסלים בעלי ערך גוון בין 85 ל-140 (טווח כחול) מוסרים ומוחלפים בערך הממוצע של שאר התמונה57. לאחר מכן, התמונה המסוננת בכחול עוברת סף על ידי החלפת הפיקסלים הרוויים ב-25% פחות בערך הממוצע של שאר התמונה המסוננת. לבסוף, התמונה המעובדת נחתכת לתמונות משנה מהן נשלפות מספר תכונות, כתוצאה מיישום הנוסחאות המפורטות ב-Sergyan58. השינוי שנעשה בנוסחאות מורכב מהחלפת עוצמת גווני האפור עם העוצמה של כל ערוץ RGB58. סה"כ נשלפים מכל תת-תמונה 18 ערכים התואמים לערך הצבע הממוצע, סטיית התקן, מצב, הטיה, אנרגיה ואנטרופיה עבור כל אחד מערוצי ה-RGB.
לאוטומציה של הדגימות האנושיות האמיתיות, יישמנו אלגוריתם למידת מכונה מפוקחת כדי לסווג את התמונות לשתי מחלקות, לא נגועות ונגועות (איור משלים. 14). נוצר SVM עם ליבת בסיס רדיאלי (RBF) עם הפרמטרים ההיפר-פרמטרים שלו C וגמא שהוערך על ידי חיפוש בייסיאני59 והיעדר התאמה יתר מאומתת באמצעות אימות צולב פי חמישה. מסד הנתונים של מחקר זה משולב על ידי 33 בקרות נגועים ו-15 לא נגועים; עבור כל דגימה, מחקרים נערכו בשלושה עותקים, תוך השגת סך של תשע תמונות בכל נקודת זמן. מערכי הנתונים מחולקים לשתי מחלקות: לא נגועים (שלילי) ונגועים (חיוביים). לאחר מכן הם מחולקים לקבוצות אימונים ובדיקות נפרדות. מערך האימונים מורכב משני שליש מהווקטורים ממטופלים 1, 7, 9, 11, 15, 19, 21, 23, 25, 29 ו-31 ושליליים 2, 3, 4, 5, 6, 7, 8, 9, 11, 13 ו-15; ערכת הבדיקה משולבת על ידי הוקטורים הנותרים. ה-SVM מייצר חיזוי עבור כל וקטור של ערכת הבדיקה להיות לא נגוע או נגוע.
דגימות קליניות והצהרת אתיקה
השגנו דגימות רוק דרך ה-PRESERVE Pandemic Response Biobank של University Health Network (UHN REB 20-5364 ו-McGill IRB מס' A03-M24-21B). 33 הדגימות הקליניות של SARS-CoV-2 נאספו מחולים מבוגרים עם תסמיני COVID-19 כמו חום, עייפות ושיעול יבש. כל הדגימות זוהו ונבדקו חיוביות ל-SARS-CoV-2 באמצעות RT-PCR. יתרה מכך, העומס הנגיפי הוערך על ידי qPCR (QuantStudio 12K Flex, Thermo Fisher Scientific). רצפי פריימר qPCR מסופקים בטבלה משלימה 13. הדגימות הוערכו במתקן ברמה 2+ שנמצאת במכון ליידי דייויס בבית החולים היהודי הכללי.
מדידות אלקטרוכימיות
מדידות אלקטרוכימיות בוצעו בתא קונבנציונלי בן שלוש אלקטרודות באמצעות פוטנטיוסטט/גלבנוסטאט Autolab PGSTAT204. הפלטפורמות הפלסמוניות שימשו כאלקטרודת העבודה, בעוד Ag/AgCl וחוט פלטינה שימשו כאלקטרודות הייחוס והנגד, בהתאמה. הפוטנציאל של בדיקות וולטמטריה מחזוריות נע בין -1 ל-1 V בהשוואה לאלקטרודת הייחוס עם קצב סריקה של 50 mV s-1. מדידת תגובת הפוטו נעשתה על ידי שימוש בטכניקת הכרונואמפרומטריה תחת אור גלוי סביבה קצוץ (מחזורי הדלקה-כיבוי של אור, 5 שניות) בפוטנציאל הטיה של 1 V לעומת Ag/AgCl בתמיסת בדיקת הגברה מימית של חומצת גרעין (10 חלקים LAMP Master מערבבים, 2 חלקים × 10 מניות פריימר, 7 חלקים מים ללא RNase ו-1 חלק מדגימת RNA מטרה).
אִפיוּן
למחקרי אופטימיזציה על הפלטפורמות הפלסמוניות, הופעלו טכניקות אפיון פיזיקליות כולל מיקרוסקופיה של כוח אטומי (AFM) ו-SEM. AFM בוצע עם ציוד Bruker MultiMode8 בעוד SEM בוצע באמצעות מיקרוסקופ אלקטרוני סורק סביבתי FEI Quanta 450.
האיפיונים האופטיים בוצעו באמצעות ציוד של Lambda750 קרוב לאינפרא אדום-UV גלוי, שבו נאספו מדידות של ספיגת האור הלבן במהלך 60 דקות של הגברה מ-200 ננומטר עד 850 ננומטר. מסגרת המחקר כללה הצטברות של פתרונות נקודת הזמן על הרציף, כאשר קרני האור הנאספים היו תקריות תקינות לרציף. התפלגות השדה החשמלית הבסיסית של הפלטפורמה נחקרה באמצעות מודול תחום זמן סופי עם הבדל (v.8.21.1781, Lumerical Solutions). המאפיינים הבסיסיים של זרימת הנוזל והעברת החום של המחסנית המיקרופלואידית נחקרו באמצעות COMSOL Multiphysics (v.5.6).
ניתוח סטטיסטי
התוצאות ניתנות כערך הממוצע ± שגיאת תקן של הממוצע למדידות משולשות כפי שהוסבר בסעיף עיבוד התמונה. חבילת התוכנה OriginPro (OriginLab, 2021) שימשה לניתוח סטטיסטי. גבולות הזיהוי והטווחים ליניאריים חושבו באמצעות שיטות רגרסיה ליניאריות, כולל שיפוע הקו ושגיאת התקן של היירוט. מובהקות סטטיסטית הוערכה באמצעות ניתוח חד כיווני של שונות (ANOVA) עם מבחן פוסט-הוק של Tukey להשוואה ממוצעת. הבדל במערך הנתונים נחשב מובהק סטטיסטית עבור P < 0.001. אפליקציית הגרפים של Paired Comparison Plot (v.3.60, OriginLab) שימשה ליצירת הדמויות באמצעות שמרניות P ערכים.
סיכום הדיווח
מידע נוסף על עיצוב המחקר זמין ב סיכום דיווח תיקי טבע מקושר למאמר זה.
- הפצת תוכן ויחסי ציבור מופעל על ידי SEO. קבל הגברה היום.
- PlatoAiStream. Web3 Data Intelligence. הידע מוגבר. גישה כאן.
- הטבעת העתיד עם אדריאן אשלי. גישה כאן.
- קנה ומכירה של מניות בחברות PRE-IPO עם PREIPO®. גישה כאן.
- מקור: https://www.nature.com/articles/s41565-023-01384-5
- :יש ל
- :הוא
- :איפה
- ][עמ'
- 1
- 10
- 100
- 11
- 12
- 13
- 14
- 15%
- 20
- 200
- 2008
- 2011
- 2016
- 2018
- 2019
- 2020
- 2021
- 2022
- 2023
- 2050
- 23
- 24
- 26
- 27
- 31
- 3d
- הדפסת 3D
- 40
- 50
- 60
- 66
- 7
- 8
- 9
- a
- AC
- מוּאָץ
- פי
- לפיכך
- הצטברות
- להשיג
- רכישה
- תוספת
- מְבוּגָר
- AL
- אַלגוֹרִיתְם
- תעשיות
- אלפא
- בסך הכל
- אמביינט
- אֲמֶרִיקָאִי
- הגברה
- an
- אנליזה
- עוגן
- ו
- האפליקציה
- בקשה
- יישומית
- גישה
- מאושר
- אַפּרִיל
- Arduino
- ARE
- נשק
- הגעה
- מאמר
- AS
- מוֹעֳרָך
- At
- אוטומטי
- אוטומציה
- זמין
- לְהִמָנַע
- צִיר
- רקע
- בַּקטֶרִיָה
- מבוסס
- בסיסי
- בסיס
- בייסיאנית
- BE
- היה
- בֵּין
- הטיה
- ביוטכנולוגיה
- דם
- כָּחוֹל
- לוּחַ
- שניהם
- קנה
- פליז
- בקצרה
- חיץ
- by
- מחושב
- קנדה
- מחלת הסרטן
- תאים סרטניים
- ללכוד
- אשר
- נשא
- לשאת
- תאים
- מרכז
- מרכזים
- מֶרְכָּז
- CGI
- תָא
- שינוי
- ערוצים
- מאפיינים
- כימי
- חן
- שבב
- שבבי
- כיתות
- לסווג
- קליק
- קליני
- קָפֶה
- אוסף
- Common
- לעומת
- השוואה
- השלמת
- לחלוטין
- רכיבים
- מורכב
- מורכב
- ריכוז
- דְאָגָה
- מצב
- מנוהל
- העניק
- מְאוּשָׁר
- מתחבר
- תוצאתית
- שמרני
- נחשב
- מורכב
- לִשְׁלוֹט
- נשלט
- בקרות
- מקובל
- עותקים
- נגיף הקורונה
- תוֹאֵם
- דלפק
- תקופת הקורונה
- תַרְבּוּת
- כוס
- חותך
- מחזורי
- אַבָּא
- נתונים
- נקודות מידע
- מסד נתונים
- מערכי נתונים
- דייויס
- דֵצֶמבֶּר
- דלתא
- שהופקדו
- עומק
- עיצוב
- מעוצב
- רצוי
- מְפוֹרָט
- איתור
- נחוש
- לפתח
- סטייה
- מכשיר
- התקנים
- הבדל
- אחר
- מובהק
- נִכבָּד
- הפצה
- מחולק
- ה-DNA
- עשה
- מונע
- לייבש
- בְּמַהֲלָך
- E&T
- כל אחד
- או
- אלמנט
- אלמנטים
- מוּעֳסָק
- מעסיקה
- מאפשר
- סוף
- אנרגיה
- אַנְגלִיָה
- משופר
- סביבתי
- EPI
- ציוד
- שווה
- שגיאה
- במיוחד
- נוסד
- Ether (ETH)
- אתיקה
- העריך
- כל
- לְנַסוֹת
- מוסבר
- חוקר
- הוֹצָאָה
- מתקן
- עייפות
- תכונות
- פיי
- קַדַחַת
- תאנה
- דמויות
- סרט צילום
- סרטים
- לסנן
- סופי
- בסופו של דבר
- ראשון
- מתאים
- תזרים
- נוזל
- בעקבות
- כדלקמן
- בעד
- להכריח
- טופס
- קדימה
- החל מ-
- פונקציה
- יסודי
- נוסף
- כללי
- ליצור
- הגנום
- קְבוּצָה
- היה
- טיפול
- בְּרִיאוּת
- בריא
- גובה
- מאוד
- להיטים
- בית חולים
- HTTPS
- בן אנוש
- הידרוגנציה
- i
- i3
- IEEE
- תמונה
- תמונות
- הדמיה
- הפעלה
- יושם
- in
- תקרית
- כולל
- כולל
- דגירה
- דגירה
- בנפרד
- זיהומים
- שפעת
- מידע
- חדשני
- מוסיף
- מכון
- מוסדי
- משולב
- השתלבות
- מוֹדִיעִין
- התכוון
- ברמה בינלאומית
- אל תוך
- IT
- שֶׁלָה
- מעבדה
- מעבדה
- גברת
- אחרון
- שכבה
- למידה
- אורך
- Lens
- פחות
- רמה
- אוֹר
- גבולות
- קו
- קשר
- צמוד
- לִטעוֹן
- מקומי
- מכונה
- למידת מכונה
- עשוי
- גדול
- מְיוּצָר
- אב
- מאטה
- חוֹמֶר
- אומר
- מדידה
- מידות
- מדיה
- רפואי
- מחקר רפואי
- מתכת
- שיטה
- שיטות
- מיקרוסקופ
- מיקרוסקופיה
- דקות
- MIT
- מעורב
- ערבוב
- תַעֲרוֹבֶת
- מצב
- דוּגמָנוּת
- מודול
- מולקולרי
- ניטור
- מונטריאול
- יתר על כן
- מָנוֹעַ
- MRSA
- מספר
- מוטציה
- ננוטכנולוגיה
- לאומי
- יליד
- טבע
- שלילי
- חדש
- הבא
- נגויין
- NIH
- לא
- נוֹרמָלִי
- מטרה
- מושג
- of
- מוצע
- Office
- on
- רכיבים אופטיים
- אופטימיזציה
- אופטימיזציה
- or
- ארגון
- מְקוֹרִי
- שלנו
- הַחוּצָה
- בין לילה
- חבילה
- נתיב
- מְזוּוָג
- מגיפה
- מקביל
- פרמטרים
- חלק
- חלקיק
- חלקים
- חולה
- חולים
- תבנית
- דפוסי
- ביצעתי
- תקופות
- גופני
- תכנית
- פלזמה
- פלטפורמה
- פלטפורמות
- פלטינה
- אפלטון
- מודיעין אפלטון
- אפלטון נתונים
- נקודה
- נקודות
- תיק עבודות
- יציאות
- חיובי
- הודעה
- פוטנציאל
- נבואה
- מוּכָן
- נוכחות
- תחל
- עקרון
- הדפסה
- PROC
- תהליך
- אוטומציה של תהליכים
- מעובד
- תהליך
- פרופיל
- מוקרן
- הוכחה
- פרוטוקול
- לספק
- ובלבד
- מספק
- כמותי
- רכס
- מהיר
- פטל
- פטל Pi
- ציון
- יחס
- Rbf
- תגובה
- ממשי
- זמן אמת
- הכרה
- מוּמלָץ
- נסיגה
- ממסר
- שוחרר
- רלוונטי
- נותר
- להסיר
- הוסר
- החליף
- דווח
- מחקר
- החלטה
- תהודה
- בהתאמה
- תגובה
- תגובות
- REST
- וכתוצאה מכך
- תוצאות
- להפוך
- סקירה
- RGB
- טַבַּעַת
- רנ"א
- s
- רוֹק
- אותו
- סארס-CoV-2
- מאזניים
- סריקה
- סריקה
- SCI
- חיפוש
- שְׁנִיָה
- משני
- סעיף
- לראות
- נבחר
- סֶלֶקטִיבִי
- SEM
- רגיש
- רְגִישׁוּת
- רצף
- סט
- סטים
- הצבה
- כמה
- משותף
- סיגמא
- משמעות
- משמעותי
- סיליקון
- באופן דומה
- since
- אתר
- אתרים
- מידה
- מוטה
- מדרון
- קטן
- תוכנה
- פִּתָרוֹן
- פתרונות
- סוני
- מקור
- ספציפי
- במיוחד
- התמחות
- תֶקֶן
- התחלות
- סטטיסטי
- שלב
- צעדים
- מניות
- מאוחסן
- זנים
- אִסטרָטֶגִיָה
- מִבְנֶה
- מְחוֹשָׁב
- מחקרים
- לימוד
- כתוצאה מכך
- כזה
- מַתְאִים
- משטח
- תלוי
- סִימפּוֹזִיוֹן
- תסמינים
- סינטטי
- מערכת
- שולחן
- משימות
- נטילת
- יעד
- מיקוד
- מטרות
- טכניקות
- מבחן
- בדיקות
- בדיקות
- זֶה
- השמיים
- אז
- שם.
- הֵם
- זֶה
- שְׁלוֹשָׁה
- שלושה שלבים
- דרך
- זמן
- ל
- כלי
- סה"כ
- הדרכה
- להעביר
- הועבר
- תרגום
- טיפול
- טריטון
- שתיים
- שני שליש
- סוג
- תחת
- אוניברסלי
- אוניברסיטה
- אחד
- על
- מְשׁוּמָשׁ
- באמצעות
- תוקף
- ערך
- ערכים
- גִרְסָה אַחֶרֶת
- מְאוּמָת
- רב צדדי
- נגד
- באמצעות
- נגיפי
- וירוסים
- נראה
- כֶּרֶך
- היה
- מים
- דֶרֶך..
- we
- אינטרנט
- שרת אינטרנט
- אתר
- טוֹב
- היו
- אשר
- בזמן
- לבן
- מי
- יצטרך
- חוט
- עם
- עובד
- עוֹלָם
- ארגון הבריאות העולמי
- X
- זפירנט