אולטרסאונד ממוקד לא פולשני בתדר נמוך (FUS), הניתן בשילוב עם מיקרו-בועות הניתנות תוך ורידי, יכול לפתוח זמנית את מחסום הדם-מוח (BBB) ולאפשר לתרופות הנלחמות במחלת האלצהיימר להיכנס למוח ולהגיע ליעדים הטיפוליים שלהן. השילוב של תרופה להפחתת רובד עמילואיד בטא ואחריה FUS מוכיח את עצמו כבטוח ויעיל יותר בהפחתת משקעי הפלאק במוח מאשר טיפול תרופתי בלבד. למרות שאינה מרפאה את מחלת האלצהיימר, הפחתת הפלאק יכולה להפחית את ההשפעה הקוגניטיבית של המחלה ולהאט את התקדמותה.
ממצאים ראשוניים מניסוי קליני קטן ראשון באדם, שבוצע ב- WVU Rockefeller Neuroscience Institute ודווח ב- ניו אינגלנד ז'ורנל אוף מדיסין (NEJM), לעורר תקווה שטיפול משולב זה עשוי יום אחד להפוך לטיפול סטנדרטי. למעשה, 60 דקות, מגזין חדשות פופולרי לטלוויזיה של CBS, שודר תוכנית ארוכה פרופיל המחקר החלוצי של נוירוכירורג עלי רזאי בתחילת החודש, שכלל ראיון עם אחד משלושת המשתתפים בניסוי הקליני של אלצהיימר.
רזאי ועמיתיו משתמשים במכשיר אולטרסאונד ממוקד (ה להתלהב דגם 4000 סוג 2) כדי לשבש את BBB בחולים, החל תוך שעתיים לאחר עירוי תוך ורידי של aducanumab. Aducanumab ו-lecanemab (שאף הם ייבחנו בניסוי) הם טיפולי נוגדנים חד שבטיים שאושרו על ידי מינהל המזון והתרופות האמריקאי (FDA) שיכולים להפחית פלאק עמילואיד בטא. עם זאת, BBB מונע מרוב הנוגדנים הללו להיכנס למוח.
הניסוי הקליני של הוכחת מושג כלל שלושה משתתפים עם מחלת אלצהיימר קלה. המטרה הייתה להעריך את הבטיחות וההיתכנות של שילוב של aducanumab עם FUS כדי לפתוח את BBB ולשפר את מתן התרופה והסרת עמילואיד.
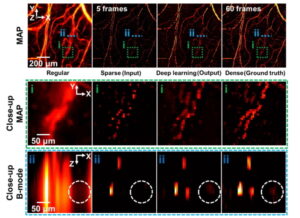
עבור הליך FUS, למטופלים הותקנו קסדה חצי כדורית המכילה 1024 מקורות אולטרסאונד הניתנים לשליטה עצמאית. מקורות אלו פולטים גלי אולטרסאונד המופנים אל מטרות תחת הנחיית MRI בזמן אמת. במהלך הצלילים, השעיה של בועות פרפלואורו-פרופן המוקפות בפוספוליפיד מוזרקת לווריד. הצוות השתמש באותות מפוזרים מהמיקרו-בועות הללו כדי לקבוע את רמות ההספק האקוסטי המתאימות שיפתחו בבטחה את BBB.
עם השלמת הליך ה-FUS, החוקרים השתמשו ב-MRI במשקל T1 עם שיפור ניגודיות גדוליניום כדי לקבוע את פתיחת ה-BBב במיקומים הממוקדים, חזרו על עצמם 24 ו-48 שעות מאוחר יותר כדי לאשר שה-BBB נסגר. הם גם ביצעו מעקב MRI 30 יום ושנה לאחר סיום הטיפול המשולב.

המשתתפים קיבלו שישה טיפולים חודשיים של Aducanumab תוך ורידי עם העלאת מינון (מ-1 מ"ג/ק"ג ממשקל גוף עד 6 מ"ג/ק"ג), ואחריו FUS. החוקרים מסבירים שבשלב זה של הניסוי הקליני, הם הגבילו את יישום ה-FUS לחצי כדור מוחי אחד, באזורים של האונה הקדמית, האונה הטמפורלית או ההיפוקמפוס עם רמות גבוהות של רובד עמילואיד-בטא. אזורי מוח מקבילים בהמיספרה הנגדית שלא נחשפו ל-FUS שימשו כבקרות. במהלך שלב המעקב, המטופלים קיבלו עירוי חודשי של 10 מ"ג/ק"ג של Aducanumab ללא FUS.
כדי לכמת רמות עמילואיד בטא, הצוות ביצע 18סריקות F-florbetaben PET בתחילת הטיפול, בשלושה, 11 ו-19 שבועות במהלך הטיפול, ובשבועות 26 ושנה בשלב המעקב. רזאי מדווח כי עבור כל שלושת החולים, 18סריקות F-florbetabin PET הראו כי לאחר 26 שבועות, פלאק עמילואיד-בטא הופחת בממוצע של 32% (נמדד באמצעות יחס ערך ספיגה מתוקנן) באזורי המוח שבהם ה-BBB נפתח, בהשוואה לאזורים מקבילים בחצי הכדור הלא מטופל. .
הירידה בערך הסנטילואיד, סולם המשמש לסטנדרטיזציה של מדידות עומס עמילואיד מבוססות PET, הייתה 48%, 49% ו-63% עבור שלושת המשתתפים, בהתאמה. רזאי מציין כי הניסוי הקליני לא כימת את חדירת הנוגדנים החד שבטיים מכיוון שהוא לא תוכנן למטרה זו.
מטופלים מגויסים כעת לשלב השני של הניסוי הקליני, שישתמש ב-lecanemab כטיפול נוגדנים חד שבטיים. "אנחנו מוגבלים על ידי ה-FDA לטפל בעד 40 סמ"ק של המוח", מסביר רזאי. "FUS יינתן רק פעם בחודש למשך שישה חודשים, בהשוואה לשיטות לאדוקנומאב, עם פתיחת BBB של חולה 1 של עד 10 סמ"ק; אז לחולים הבאים יהיה BBB נפתח עד 20 ו-40 סמ"ק בהתאמה."

אולטרסאונד ממוקד בהנחיית MR מספק טיפול נוגדנים ישירות למוח
ב 60 דקות בראיון, המטופל בן ה-61 דן מילר, שאשתו הבחינה לראשונה בשינויים התנהגותיים ארבע שנים קודם לכן, אמר כי הצפייה בתמונות ה-MR הסופיות של מוחו המראות הפחתת פלאק "היתה סוריאליסטית". הוא עדיין מפגין מדי פעם התנהגות חריגה, אבל לא הייתה התקדמות גלויה נוספת. מילר ואשתו מלאי תקווה לעתיד.
ב מתלווה NEJM דבר עורך, חלוץ נוסף בשימוש הקליני של FUS, Kullervo Hyynen ממכון המחקר Sunnybrook בטורונטו, מציין כי "הרחבת הטיפול לנפחים משמעותיים מבחינה קלינית משני צידי המוח היא חיונית להערכת יעילותו בהאטת התקדמות המחלה. דרושים מחקרים נוספים כדי לבסס בטיחות ויעילות לטווח ארוך, ויש לפתח מכשירי טיפול חסכוניים שאינם תלויים בהנחיית MRI מקוונת לצורך נגישות רחבה יותר".
אבל, כמו מילר, הינן אופטימי.
- הפצת תוכן ויחסי ציבור מופעל על ידי SEO. קבל הגברה היום.
- PlatoData.Network Vertical Generative Ai. העצים את עצמך. גישה כאן.
- PlatoAiStream. Web3 Intelligence. הידע מוגבר. גישה כאן.
- PlatoESG. פחמן, קלינטק, אנרגיה, סביבה, שמש, ניהול פסולת. גישה כאן.
- PlatoHealth. מודיעין ביוטכנולוגיה וניסויים קליניים. גישה כאן.
- מקור: https://physicsworld.com/a/focused-ultrasound-plus-plaque-reducing-drugs-could-slow-alzheimers-progression/
- :יש ל
- :הוא
- :לֹא
- :איפה
- $ למעלה
- 1
- 10
- 11
- 19
- 20
- 24
- 26
- 30
- 90
- a
- נגישות
- אקוסטי
- נוסף
- מנוהל
- מנהל
- לאחר
- תעשיות
- לבד
- גם
- אלצהיימר
- אלצהיימר
- עמילואיד
- an
- ו
- אחר
- נוגדנים
- נוגדן
- בקשה
- מתאים
- ARE
- AREA
- AS
- הערכה
- At
- מְמוּצָע
- מחסום
- Baseline
- BE
- כי
- להיות
- היה
- התנהגות
- להיות
- גוּף
- שניהם
- שני הצדדים
- מוֹחַ
- רחב
- ניטל
- אבל
- by
- CAN
- אשר
- מֶרְכָּז
- שינויים
- קליק
- קליני
- קלינית
- סגור
- קוגניטיבית
- עמיתים
- להילחם
- שילוב
- משולב
- שילוב
- השוואה
- לעומת
- השלמה
- לאשר
- לעומת זאת
- לִשְׁלוֹט
- בקרות
- תוֹאֵם
- עלות תועלת
- יכול
- מכריע
- הִתרַפְּאוּת
- ימים
- נתן
- מספק
- מסירה
- פיקדונות
- מעוצב
- לקבוע
- מפותח
- מכשיר
- התקנים
- DID
- מְכוּוָן
- ישירות
- מַחֲלָה
- לשבש
- מנה
- תרופה
- משלוח סמים
- סמים
- בְּמַהֲלָך
- מוקדם יותר
- אפקטיבי
- יעילות
- לאפשר
- אַנְגלִיָה
- להגביר את
- הגברה
- זן
- הזנת
- הסלמה
- להקים
- להעריך
- מוצגים
- להסביר
- מסביר
- חשוף
- עובדה
- ה-FDA
- כדאיות
- סופי
- ממצאים
- ראשון
- מרוכז
- בעקבות
- הבא
- מזון
- מינהל המזון והתרופות האמריקאי
- בעד
- ארבע
- החל מ-
- נוסף
- עתיד
- הדרכה
- היה
- יש
- he
- בְּרִיאוּת
- גָבוֹהַ
- שֶׁלוֹ
- לקוות
- תקווה
- שעות
- אולם
- HTTPS
- תמונה
- תמונות
- פְּגִיעָה
- in
- כלול
- באופן עצמאי
- מידע
- חדור
- אִינפוּזִיָה
- מכון
- ראיון אישי
- אל תוך
- תוך ורידי
- תוך ורידי
- סוגיה
- IT
- שֶׁלָה
- כתב עת
- jpg
- מאוחר יותר
- רמות
- כמו
- מוגבל
- מקומות
- לטווח ארוך
- מגזין
- max-width
- מאי..
- נמדד
- מידות
- שיטות
- עדין
- טוחן
- מודל
- חוֹדֶשׁ
- אחת לחודש
- חודשים
- יותר
- רוב
- mr
- MRI
- צריך
- נחוץ
- Neuroscience
- חדשות
- לא
- הערות
- עַכשָׁיו
- מטרה
- מִקרִי
- of
- on
- פעם
- ONE
- באינטרנט
- רק
- לפתוח
- נפתח
- פתיחה
- אופטימי
- or
- המשתתפים
- חולה
- חולים
- חֲדִירָה
- ביצעתי
- חיית מחמד
- שלב
- פיסיקה
- עולם הפיזיקה
- חלוץ
- חלוצי
- תכנית
- תכנון
- אפלטון
- מודיעין אפלטון
- אפלטון נתונים
- ועוד
- פופולרי
- כּוֹחַ
- קוֹדֶם
- הליך
- התקדמות
- להוכיח
- מטרה
- יחס
- לְהַגִיעַ
- זמן אמת
- קיבלו
- להפחית
- מופחת
- הפחתה
- הפחתה
- אזורים
- הסרה
- חזר
- דווח
- דוחות לדוגמא
- מחקר
- חוקרים
- בהתאמה
- מוגבל
- s
- בטוח
- בבטחה
- בְּטִיחוּת
- אמר
- סולם
- סריקות
- פזור
- מדעים
- שְׁנִיָה
- שירת
- הראה
- הצגה
- הראה
- צדדים
- אותות
- משמעותי
- שישה
- שישה חודשים
- להאט
- מאט
- קטן
- ביום מן הימים
- מקורות
- תֶקֶן
- מְתוּקנָן
- החל
- עוד
- לעורר
- מחקרים
- הַשׁעָיָה
- ממוקד
- מטרות
- נבחרת
- טלוויזיה
- נבדק
- מֵאֲשֶׁר
- זֶה
- השמיים
- העתיד
- המערב
- שֶׁלָהֶם
- אז
- רפואי
- טיפולים
- תרפיה
- שם.
- אלה
- הֵם
- זֶה
- שְׁלוֹשָׁה
- תמונה ממוזערת
- ל
- טורונטו
- טיפול
- טיפול
- טיפולים
- מִשׁפָּט
- נָכוֹן
- שתיים
- סוג
- אולטרסאונד
- תחת
- עוברת
- אוניברסיטה
- בלתי שגרתי
- ספיגה
- us
- אוכל אמריקאי
- להשתמש
- מְשׁוּמָשׁ
- באמצעות
- ערך
- באמצעות
- צפייה
- וירג'יניה
- נראה
- כרכים
- היה
- גלים
- שבועות
- מִשׁקָל
- היו
- מערב
- במערב וירג'יניה
- אשר
- בזמן
- של מי
- רעיה
- יצטרך
- עם
- בתוך
- לְלֹא
- עוֹלָם
- שנה
- שנים
- זפירנט