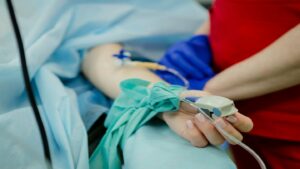
Immunoterapia MoonLake (MoonLake) ha stretto una collaborazione con SHL Medical sviluppare congiuntamente un autoiniettore per la fornitura clinica e commerciale del suo sonelokimab nanobody.
La partnership sfrutterà la tecnologia della piattaforma modulare Molly di SHL Medical per sviluppare l'autoiniettore.
Secondo i termini dell’accordo di collaborazione, SHL Medical fornirà la propria esperienza nello sviluppo, assemblaggio e produzione di dispositivi per supportare il progetto del dispositivo farmaceutico.
Un totale di 17 prodotti combinati che utilizzano la comprovata tecnologia degli autoiniettori Molly sono stati approvati in almeno 69 paesi.
La tecnologia facilita il trattamento domiciliare dei pazienti in varie aree terapeutiche che richiedono farmaci iniettabili.
Sonelokimab è un nanocorpo umanizzato sperimentale da 40 kDa in grado di neutralizzare in modo efficiente sia IL-17F che IL-17A per il trattamento delle malattie infiammatorie.
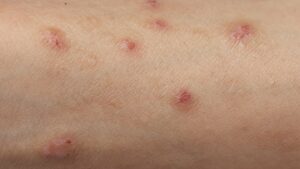
È attualmente in fase di sviluppo clinico per una serie di indicazioni, tra cui il trattamento dell’infiammazione in pazienti affetti da idrosadenite suppurativa, una condizione cronica della pelle gravemente debilitante che porta alla distruzione irreversibile dei tessuti.
L’azienda ha inoltre presentato dati clinici al convegno annuale dell’American Academy of Dermatology a sostegno dell’ipotesi.
Sonelokimab ha dimensioni più piccole rispetto agli anticorpi tradizionali e al dominio legante l'albumina, il che può consentire una maggiore efficacia.
Ulrich Faessler, CEO di SHL Medical, ha dichiarato: “Lavorare con MoonLake mentre sonelokimab è in fase di sviluppo ci consente di attuare strategie che completano al meglio le esigenze cliniche e commerciali di MoonLake.
“Siamo entusiasti della collaborazione e non vediamo l’ora di portare potenzialmente l’innovativa tecnologia dei nanobody per indicazioni infiammatorie dermatologiche e reumatiche ai pazienti di tutto il mondo”.
MoonLake ha già completato la valutazione di Sonelokimab nello studio di Fase 2b (NCT03384745).
Nello studio randomizzato, controllato con placebo, che ha coinvolto 313 pazienti affetti da psoriasi a placche da moderata a grave, il farmaco ha dimostrato una risposta di rimozione della pelle rapida e duratura.
L'azienda prevede di rivelare i risultati di punta dello studio MIRA di fase 2 su sonelokimab in soggetti affetti da idrosadenite suppurativa da moderata a grave entro la fine di giugno di quest'anno.
Oliver Daltrop, direttore tecnico di MoonLake Immunotherapeutics, ha dichiarato: “Mentre pianifichiamo attivamente un programma di Fase 3 e la disponibilità commerciale, l’esperienza di SHL migliorerà notevolmente la nostra capacità di introdurre sonelokimab in un formato autoiniettore che potrebbe fornire un vantaggio ai pazienti se approvato”.
<!-- Spazio pubblicitario GPT 3 per l'unità pubblicitaria "Verdict/Verdict_In_Article" ### Dimensioni: [[670,220]] -- !-- Fine spazio pubblicitario 3 -->- Distribuzione di contenuti basati su SEO e PR. Ricevi amplificazione oggi.
- PlatoAiStream. Intelligenza dei dati Web3. Conoscenza amplificata. Accedi qui.
- Coniare il futuro con Adryenn Ashley. Accedi qui.
- Fonte: https://www.medicaldevice-network.com/news/moonlake-shl-medical-autoinjector-sonelokimab/
- :ha
- :È
- a
- capacità
- Chi siamo
- Academy
- attivamente
- Ad
- Accordo
- consente
- già
- anche
- americano
- an
- ed
- annuale
- Anticorpi
- approvato
- SONO
- aree
- montaggio
- valutazione
- At
- precedente
- stato
- beneficio
- MIGLIORE
- entrambi
- Portare
- by
- Materiale
- trasportare
- ceo
- capo
- Info su
- collaborazione
- combinazione
- azienda
- rispetto
- Complemento
- Completato
- condizione
- potuto
- paesi
- credito
- Attualmente
- dati
- dimostrato
- sviluppare
- Mercato
- dispositivo
- Malattia
- dominio
- droga
- farmaci
- in modo efficiente
- enable
- fine
- accrescere
- eccitato
- aspetta
- competenza
- facilita
- Nel
- formato
- formato
- Avanti
- da
- molto
- Avere
- Casa
- HTTPS
- if
- in
- Compreso
- indicazioni
- individui
- infiammazione
- creativi e originali
- introdurre
- SUO
- jpg
- giugno
- KDA
- Leads
- meno
- Leva
- Guarda
- Maggio..
- medicale
- incontro
- componibile
- Scopri di più
- esigenze
- numero
- of
- Responsabile
- nostro
- su
- partner
- Partnership
- pazienti
- fase
- piano
- piattaforma
- Platone
- Platone Data Intelligence
- PlatoneDati
- potenzialmente
- presentata
- PRNewswire
- Produzione
- Prodotti
- programma
- progetto
- comprovata
- fornire
- veloce
- prontezza
- richiedere
- risposta
- Risultati
- rivelare
- Suddetto
- gravemente
- Condividi
- Taglia
- Pelle
- inferiore
- strategie
- sofferenza
- fornire
- supporto
- Consulenza
- Tecnologia
- condizioni
- che
- I
- Terapeutico
- questo
- quest'anno
- a
- Totale
- tradizionale
- trattare
- trattamento
- prova
- unità
- us
- utilizzando
- vario
- we
- quale
- while
- volere
- con
- In tutto il mondo
- anno
- zefiro