L'NMPA ha pubblicato il documento definitivo "Linee guida sulla progettazione e l'analisi statistica dei dispositivi medici nel mondo reale" il 15 gennaio 2024. La bozza della versione è stata rilasciata il 28 settembre 2023.
Significato della linea guida
Le linee guida faciliteranno i produttori esteri a esplorare ulteriormente il programma pilota Hainan Real-world Data.
La zona pilota di Hainan Boao consente l'utilizzo in Cina di dispositivi medici, IVD e farmaci non approvati all'estero con stato di urgenza clinica. Durante la commercializzazione e la vendita dei propri prodotti, i produttori possono raccogliere RWD tramite RWS ad Hainan come prova clinica locale in Cina a supporto dell'approvazione nazionale della registrazione NMPA. Il programma speciale potrebbe limitare l’accesso al mercato cinese a 4 mesi.
Il governo di Hainan ha rilasciato il “Regolamento sulla somministrazione di farmaci e dispositivi medici importati per uso urgente nella zona pilota di turismo medico internazionale di Boao Lecheng del porto di libero scambio di Hainan" il 28 marzo 2023. Il documento afferma che NON richiede prove di tipo locale o oneri di prova significativi come l'approvazione nazionale.
Punti salienti della linea guida
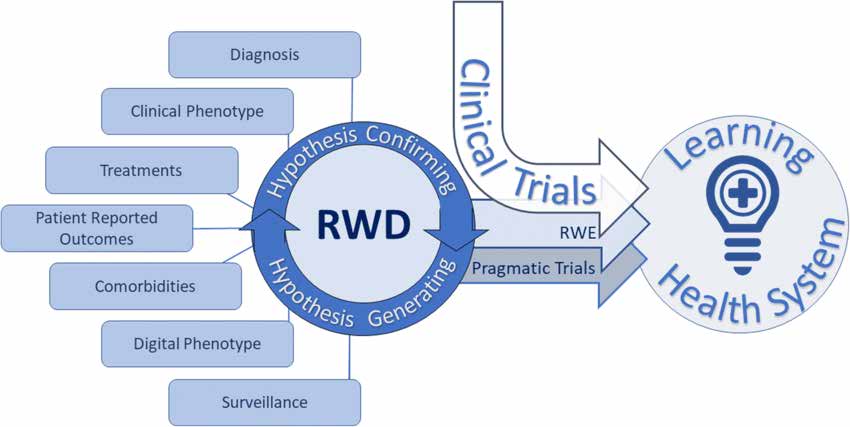
Il documento sulla progettazione dello studio e sull'analisi statistica descrive diversi tipi di ricerca nel mondo reale come segue:
Gli studi pragmatici randomizzati e controllati (pRCT) sono progettati per valutare i risultati del trattamento in contesti sanitari reali. Impiegano gruppi di randomizzazione e controllo per valutare l'efficacia dell'intervento. I pRCT forniscono prove reali di alta qualità e sono adatti a diverse popolazioni di pazienti e scenari clinici.
La ricerca osservativa sul mondo reale comprende vari disegni di studio:
- Disegni di studi descrittivi descrivere le caratteristiche del paziente o le condizioni di salute senza dedurne la causalità.
- Disegni di coorte monitorare i risultati in diversi gruppi di pazienti in base all'uso del dispositivo, con opzioni prospettiche e retrospettive.
- Case-Control e disegni derivati confrontare i pazienti con e senza l'uso del dispositivo e includere studi caso-controllo nidificati e studi caso-coorte.
- Dati del mondo reale come controlli esterni comportano l’utilizzo di dati del mondo reale come gruppo di controllo, sebbene manchino linee guida dettagliate.
Il documento delinea considerazioni per la progettazione di protocolli di ricerca nel mondo reale:
- Background e obiettivi: definire il contesto della ricerca, gli obiettivi e le questioni relative alla sicurezza e all'efficacia sulla base dei dati esistenti.
- Valutazione di fattibilità: Valutare la fattibilità di condurre ricerche nel mondo reale, considerando la disponibilità, la qualità e le variabili di confusione dei dati.
- Selezionare il progetto di ricerca appropriato: scegliere la progettazione in base agli obiettivi, siano essi sperimentali o osservativi.
- Diagramma di flusso dello studio: creare un diagramma di flusso che dettaglia il processo dello studio, inclusa la selezione dei pazienti, gli interventi e gli esami.
- Definire la popolazione dello studio: Definire chiaramente i criteri di inclusione ed esclusione per la popolazione in studio.
- Esposizione del dispositivo: Valutare il modo in cui i pazienti sono esposti al dispositivo, considerando potenziali bias.
- Gruppo di controllo: Determinare gruppi di controllo idonei per studi osservazionali per bilanciare le variabili confondenti.
- Misure di uscita: Definire le misure dei risultati, compreso il loro scopo, definizione e metodi di misurazione.
- Raccolta Dati: sviluppare moduli e dizionari per la raccolta dei dati, specificando le fonti dei dati, la qualità delle informazioni e i metodi di collegamento.
- Aggiustamento per la variabile confondentes: identificare le variabili confondenti e includerle/escluderle con motivazioni.
- Tempo di follow-up: Definire il follow-up del paziente o i tempi di osservazione per rispondere adeguatamente alle domande della ricerca.
- Dimensione del campione e calcolo della potenza: Calcola la dimensione del campione e la potenza statistica, considerando vari fattori.
Sottolinea inoltre l'importanza del controllo qualità:
- Qualità dei dati: valutare la qualità dei dati in termini di rappresentatività, completezza, accuratezza e altro ancora.
- Rischio di pregiudizio: Descrivere le misure per controllare i rischi di bias nelle varie fasi, tra cui selezione, informazione e bias confondenti.
- Valutazione del bias: Riconoscere diversi tipi di bias e valutarne la direzione e l’entità.
- Revisione etica: Garantire che le revisioni etiche e il consenso informato siano conformi alle normative.
Confronto di due versioni
Rispetto alla bozza, il documento finale menziona la “Determinazione delle variabili confondenti che necessitano di modifiche” nella sezione Analisi statistica.
Nei progetti di ricerca del mondo reale non randomizzati, l’identificazione delle variabili di confondimento è cruciale per controllare i bias. Per identificarli vengono utilizzati tre criteri: una variabile ha una relazione causale con l'esito, è associata alla variabile di raggruppamento (esposizione) e non è una variabile intermedia nel percorso causale. Un approccio raccomandato prevede un processo razionale di selezione delle variabili basato sulla conoscenza professionale e sull'esperienza clinica, con la collaborazione di esperti clinici e statistici. Per le variabili incerte, viene suggerita un'analisi di sensibilità, fornendo ragioni e supportando i dati per l'inclusione/esclusione. Si consiglia un approccio conservativo alla selezione delle variabili, evitando variabili non correlate e considerando questioni come la multicollinearità e gli effetti di interazione, visualizzati attraverso i grafici aciclici diretti (DAG).
Per una copia in inglese delle linee guida, inviare un'e-mail info@ChinaMedDvice.com. Addebitiamo costi nominali per la traduzione.
Guarda il ultime notizie sul programma Hainan Real World Data.
Guarda il linea guida di comunicazione collaborare con le autorità di regolamentazione.
Guarda la webinar registrato sulle politiche di Hainan.
- Distribuzione di contenuti basati su SEO e PR. Ricevi amplificazione oggi.
- PlatoData.Network Generativo verticale Ai. Potenzia te stesso. Accedi qui.
- PlatoAiStream. Intelligenza Web3. Conoscenza amplificata. Accedi qui.
- PlatoneESG. Carbonio, Tecnologia pulita, Energia, Ambiente, Solare, Gestione dei rifiuti. Accedi qui.
- Platone Salute. Intelligence sulle biotecnologie e sulle sperimentazioni cliniche. Accedi qui.
- Fonte: https://chinameddevice.com/real-world-study-nmpa/
- :ha
- :È
- :non
- 15%
- 2023
- 2024
- 28
- a
- accesso
- precisione
- aciclico
- adeguatamente
- amministrazione
- consigliato
- consente
- anche
- an
- .
- ed
- rispondere
- approccio
- opportuno
- approvazione
- SONO
- AS
- valutare
- associato
- At
- Autorità
- disponibilità
- evitando
- sfondo
- Equilibrio
- basato
- BE
- pregiudizio
- pregiudizi
- onere
- calcolare
- Materiale
- caratteristiche
- carica
- Cina
- Scegli
- chiaramente
- Info su
- collaborazione
- raccogliere
- collezione
- COM
- ottemperare
- condizioni
- conduzione
- consenso
- prudente
- Considerazioni
- considerando
- di controllo
- controllata
- controllo
- controlli
- creare
- criteri
- cruciale
- dati
- qualità dei dati
- definire
- definizione
- derivato
- descrivere
- descrive
- Design
- progettato
- progettazione
- disegni
- dettagliati
- Detailing
- Determinare
- sviluppare
- dispositivo
- dispositivi
- diverso
- indirizzato
- direzione
- paesaggio differenziato
- documento
- effettua
- bozza
- farmaci
- efficacia
- effetti
- sottolinea
- Inglese
- garantire
- etico
- valutare
- prova
- esistente
- esperienza
- sperimentale
- esperti
- esplora
- esposto
- Esposizione
- esterno
- facilitare
- Fattori
- fattibilità
- Costi
- finale
- finalizzato
- i seguenti
- Nel
- forme
- Gratis
- ulteriormente
- Enti Pubblici
- grafici
- Gruppo
- Gruppo
- linee guida
- Salute e benessere
- assistenza sanitaria
- alta qualità
- Come
- HTTPS
- identificare
- identificazione
- importanza
- in
- includere
- inclusi
- Compreso
- inclusione
- informazioni
- informati
- interazione
- Intermedio
- Internazionale
- intervento
- interventi
- comporta
- sicurezza
- IT
- Gennaio
- jpg
- conoscenze
- carente
- leader
- piace
- locale
- Produttori
- Marzo
- Rappresentanza
- analisi
- medicale
- dispositivo medico
- dispositivi medici
- menziona
- metodi
- forza
- mese
- Scopri di più
- il
- Bisogno
- Obiettivi d'Esame
- osservazione
- osservazionale
- of
- on
- Opzioni
- or
- nostro
- Risultato
- risultati
- lineamenti
- oltremare
- sentiero
- paziente
- pazienti
- pilota
- Platone
- Platone Data Intelligence
- PlatoneDati
- per favore
- Termini e Condizioni
- popolazione
- popolazioni
- potenziale
- energia
- processi
- Prodotti
- professionale
- Programma
- prova
- potenziale
- protocolli
- fornire
- fornitura
- pubblicato
- scopo
- qualità
- Domande
- Randomizzato
- Razionale
- di rose
- mondo reale
- motivi
- raccomandato
- Iscrizione
- normativa
- normativo
- rapporto
- rilasciato
- richiedere
- riparazioni
- Recensioni
- rischi
- Sicurezza
- dice
- Scenari
- Sezione
- prodotti
- Vendita
- Sensibilità
- Settembre
- impostazioni
- significativa
- Taglia
- fonti
- la nostra speciale
- tappe
- statistiche
- Stato dei servizi
- studi
- Studio
- adatto
- supporto
- Supporto
- condizioni
- Testing
- che
- Il
- loro
- Li
- di
- anche se?
- tre
- Attraverso
- volte
- a
- Turismo
- pista
- commercio
- Traduzione
- trattamento
- studi clinici
- seconda
- Digitare
- Tipi di
- Incerto
- urgenza
- urgente
- uso
- utilizzato
- utilizzando
- variabile
- vario
- versione
- Prima
- we
- se
- while
- volere
- con
- senza
- lavoro
- mondo
- zefiro