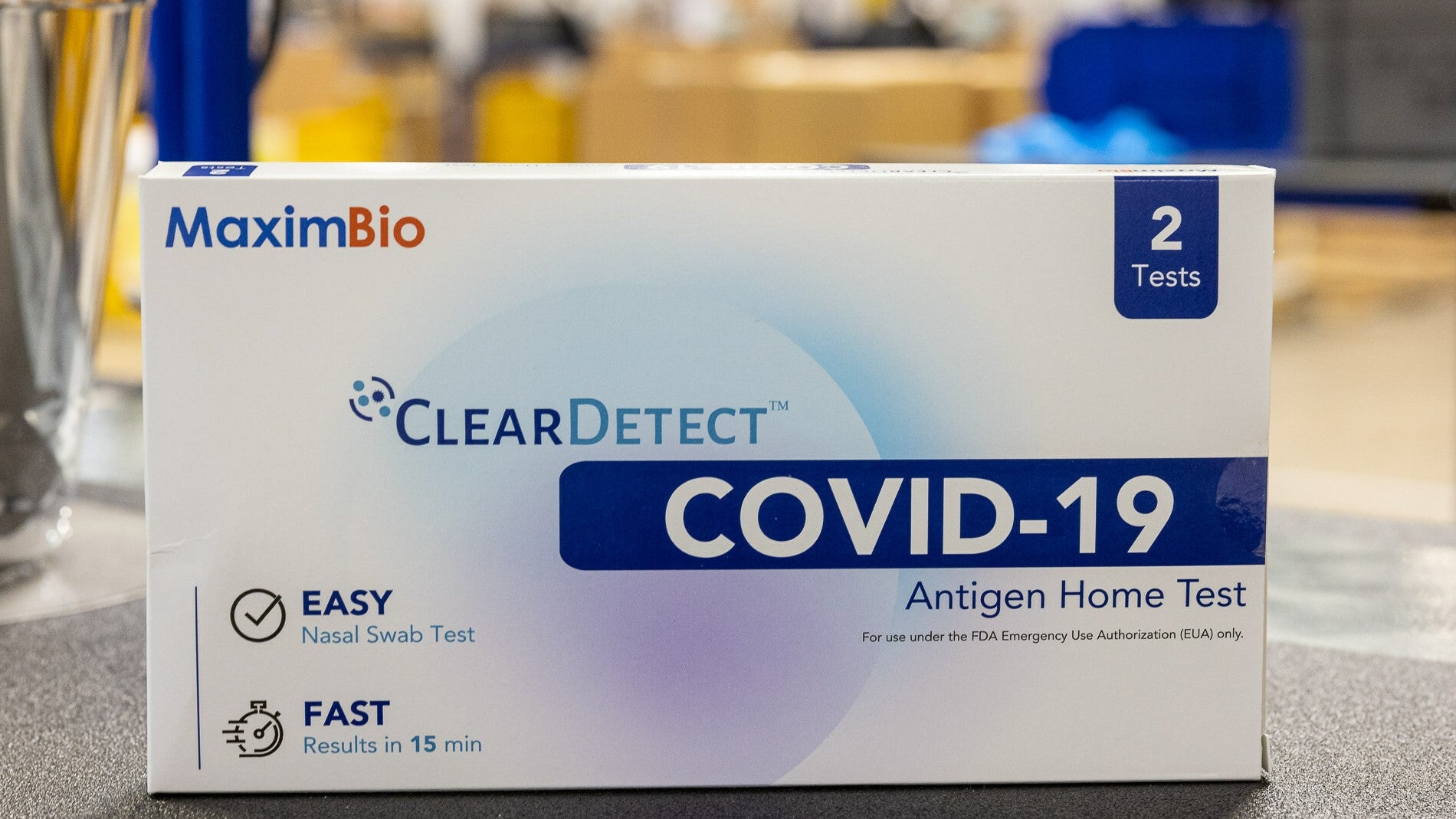
Il Dipartimento della Salute e dei Servizi Umani (HHS) degli Stati Uniti ha assegnato 49.5 milioni di dollari a MaximBio, con sede nel Maryland, per rafforzare le sue capacità di produzione di test diagnostici.
Il finanziamento è stato assegnato attraverso l’Amministrazione statunitense per la preparazione e la risposta strategica (ASPR) e fa parte di un’iniziativa più ampia dell’amministrazione Biden-Harris.
L’iniziativa Biden-Harris prevedeva l’erogazione di una sovvenzione di 600 milioni di dollari a 12 produttori di test Covid-19 con sede negli Stati Uniti. Inoltre, l'HHS ha riaperto COVIDTests.gov per fornire gratuitamente i test Covid-19 alle famiglie negli Stati Uniti.
Il test domiciliare dell’antigene ClearDetect Covid-19 di MaximBio lo era sviluppato utilizzando sovvenzioni dal Dipartimento della Difesa degli Stati Uniti (DoD) e dal National Institutes of Health (NIH) attraverso l’iniziativa Rapid Acceleration of Diagnostics (RADx). Il test rileva gli antigeni specifici del Covid-19 nel tampone nasale.
Test ClearDetect di MaximBio è stato autorizzato per l'uso diagnostico in vitro dall'autorizzazione all'uso di emergenza della Food and Drug Administration (FDA) statunitense nel 2022. Nel settembre 2023, MaximBio ha aggiornato i test ClearDetect per aumentare la data di scadenza della durata di conservazione del test a 24 mesi, se conservato a 4° C-30°C.
C'è stato un rinnovato interesse per il Covid-19 diagnostica e trattamento alla luce delle nuove sottovarianti di Omicron. Si prevede che il mercato della diagnostica in vitro Covid-19 varrà circa 3 miliardi di dollari nel 2030, secondo Il modello di mercato di GlobalData.
Accedi ai profili aziendali più completi
sul mercato, alimentato da GlobalData. Risparmia ore di ricerca. Ottieni un vantaggio competitivo.

Profilo aziendale – gratuito
campione
L'e-mail di download arriverà a breve
Siamo fiduciosi riguardo al
unico
qualità dei nostri profili aziendali. Tuttavia, vogliamo che tu ottenga il massimo
benefico
decisione per la tua attività, quindi offriamo un campione gratuito che puoi scaricare
inviando il modulo sottostante
A cura di GlobalData
Nel novembre 2023, ACON Laboratories con sede negli Stati Uniti ha ricevuto l'autorizzazione alla commercializzazione 510 (k). dalla FDA per il suo test domiciliare per l'antigene Covid-19 Flowflex. Il test antigenico rapido da banco è in grado di rilevare la nuova variante Covid-19.
Lo scorso giugno, Cue Salute ricevuto anche autorizzazione de novo da parte della FDA per il test domiciliare Covid-19, il test molecolare Cue Covid-19. Il test di amplificazione dell’acido nucleico molecolare è in grado di rilevare il virus SARS-CoV-2 e può essere utilizzato sia in ambito point-of-care che a domicilio.
Tra gli altri destinatari della sovvenzione da 600 milioni di dollari dell’HHS statunitense figura l’iHealth Lab con sede in California, che ha ricevuto 167 milioni di dollari per il suo test rapido dell’antigene iHealth Covid-19. Access Bio, con sede nel New Jersey, e CorDx, con sede in California, hanno ricevuto rispettivamente 88.7 milioni di dollari e 86.4 milioni di dollari per i loro test immunologici a flusso laterale, CorDx Covid-19 Ag test e Test domiciliare dell'antigene CareStart Covid-19.
- Distribuzione di contenuti basati su SEO e PR. Ricevi amplificazione oggi.
- PlatoData.Network Generativo verticale Ai. Potenzia te stesso. Accedi qui.
- PlatoAiStream. Intelligenza Web3. Conoscenza amplificata. Accedi qui.
- PlatoneESG. Carbonio, Tecnologia pulita, Energia, Ambiente, Solare, Gestione dei rifiuti. Accedi qui.
- Platone Salute. Intelligence sulle biotecnologie e sulle sperimentazioni cliniche. Accedi qui.
- Fonte: https://www.medicaldevice-network.com/news/maximbio-wins-49-5m-us-health-award-to-manufacture-covid-19-tests/
- :ha
- :È
- $ SU
- 11
- 12
- 2022
- 2023
- 2030
- 24
- 7
- 8
- 9
- a
- WRI
- accelerazione
- accesso
- operanti in
- amministrazione
- AG
- anche
- Amplificazione
- an
- ed
- circa
- SONO
- articolo
- AS
- At
- autorizzazione
- premio
- assegnato
- bandiera
- BE
- stato
- sotto
- benefico
- entrambi
- più ampia
- affari
- by
- Materiale
- funzionalità
- azienda
- competitivo
- globale
- fiducioso
- COVID-19
- credito
- alle lezioni
- Le notizie del GIORNO
- Data
- decisione
- Difesa
- consegnare
- Shirts Department
- Dipartimento della Difesa
- individuare
- diagnostica
- diagnostica
- DoD
- scaricare
- droga
- bordo
- emergenza
- fine
- scadenza
- fda
- flusso
- cibo
- Nel
- modulo
- fortificare
- Gratis
- da
- finanziamento
- Guadagno
- GlobalData
- concedere
- Salute e benessere
- Casa
- ORE
- famiglie
- Tuttavia
- HTTPS
- umano
- ICON
- Immagine
- in
- incluso
- Aumento
- industria
- approfondimenti di settore
- iniziativa
- intuizioni
- interesse
- SUO
- jpg
- giugno
- laboratorio
- laboratori
- principale
- leggera
- make
- Produttori
- consigliato per la
- Rappresentanza
- Marketing
- molecolare
- mese
- maggior parte
- nasale
- il
- National Institutes of Health
- New
- notizie
- Newsletter
- NIH
- Novembre
- Nuovo
- of
- offrire
- on
- nostro
- Azienda
- sul bancone
- parte
- per
- Platone
- Platone Data Intelligence
- PlatoneDati
- alimentato
- Profilo
- Profili
- qualità
- veloce
- ricevuto
- destinatari
- riparazioni
- rispettivamente
- risposta
- SARS-CoV-2
- Risparmi
- Settembre
- Servizi
- impostazioni
- So
- inizia a
- memorizzati
- Strategico
- SVG
- test
- test
- che
- Il
- loro
- questo
- Attraverso
- a
- trattamento
- unico
- aggiornato
- us
- Dipartimento della Difesa degli Stati Uniti
- Cibo USA
- uso
- utilizzato
- utilizzando
- Variante
- virus
- volere
- Prima
- we
- quando
- quale
- volere
- vittorie
- con
- valore
- Tu
- Trasferimento da aeroporto a Sharm
- zefiro