Azienda di diagnostica molecolare Co-diagnostica (Co-Dx) ha richiesto l'autorizzazione all'uso di emergenza (EUA) presso la Food and Drug Administration (FDA) statunitense per il suo test Co-Dx PCR Covid-19 con lo strumento Co-Dx PCR Pro.
La proposta di Co-Dx per la revisione da parte della FDA include lo strumento PCR Pro, il test di rilevamento del Covid-19 e un'applicazione mobile, tutti realizzati su misura per l'uso al punto di cura e a domicilio.
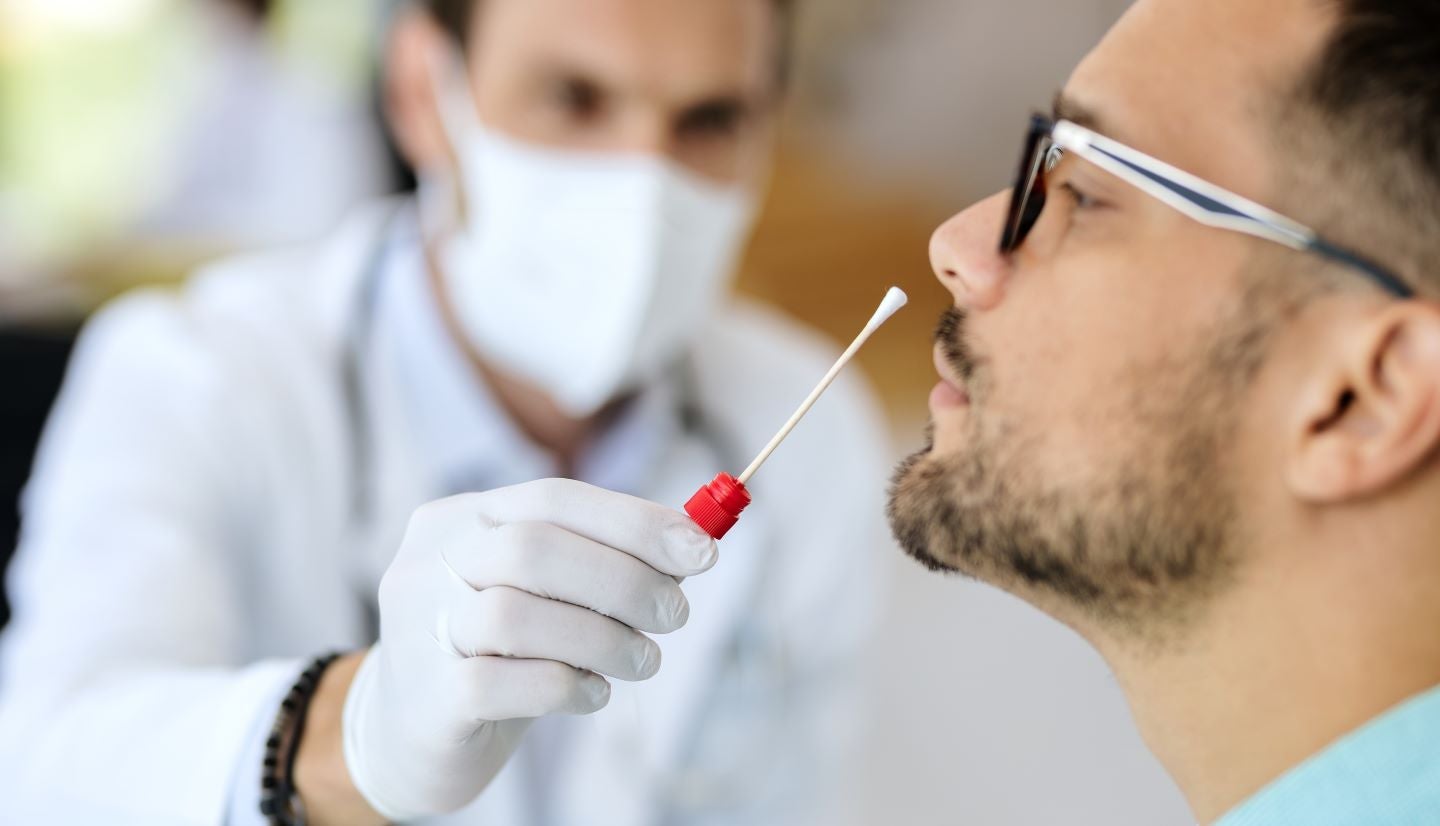
Il kit di test funziona sulla tecnologia dei co-primer della reazione a catena della polimerasi (PCR) in tempo reale e ha dimostrato la capacità di rilevare Covid-19 da campioni di tampone nasale anteriore nelle valutazioni cliniche.
Inoltre, ha dimostrato di fornire risultati sullo smartphone o sul dispositivo mobile dell'utente in quasi 30 minuti.
Il portafoglio di test futuri dell'azienda attualmente in sviluppo per la nuova piattaforma comprende la tubercolosi (TBC), il papillomavirus umano (HPV) e un pannello respiratorio multiplex in grado di rilevare l'influenza A/B, Covid-19 e il virus respiratorio sinciziale (RSV) da un unico campione.
Questi tre test hanno ricevuto sovvenzioni da varie organizzazioni di finanziamento negli ultimi sei mesi di quest'anno.
Accedi ai profili aziendali più completi
sul mercato, alimentato da GlobalData. Risparmia ore di ricerca. Ottieni un vantaggio competitivo.

Profilo aziendale – gratuito
campione
L'e-mail di download arriverà a breve
Siamo fiduciosi riguardo al
unico
qualità dei nostri profili aziendali. Tuttavia, vogliamo che tu ottenga il massimo
benefico
decisione per la tua attività, quindi offriamo un campione gratuito che puoi scaricare
inviando il modulo sottostante
A cura di GlobalData
Varie agenzie di regolamentazione, inclusa la FDA, stanno attualmente rivedendo la piattaforma PCR completa Co-Dx che comprende PCR Home, PCR Pro, app mobile e il kit di test non è ancora disponibile in commercio.
Dwight Egan, CEO di Co-Diagnostics, ha dichiarato: “Questa nuova piattaforma tecnologica rappresenta un passo significativo verso l'avanzamento della missione dell'azienda volta ad aumentare l'accessibilità della diagnostica PCR.
“Oltre allo sviluppo di nuove tecnologie da zero da parte di un team di livello mondiale per decentralizzare la tecnologia diagnostica PCR e renderla disponibile presso il punto di cura e a domicilio, è stato necessario anche che la nuova tecnologia poter essere commercializzati a un prezzo rilevante in tutto il mondo.
“La diagnostica, insieme ai vaccini e alle terapie, è uno strumento vitale per aiutare a combattere malattie come la tubercolosi, che rimane un problema significativo in India e in molti altri paesi nonostante sia una malattia altamente curabile”.
L'azienda si concentra sullo sviluppo e sulla commercializzazione di tecnologie diagnostiche.
Queste tecnologie vengono sfruttate da test che rilevano e/o valutano le molecole di acido nucleico, inclusi DNA e RNA.
Nel novembre di quest'anno, il la società ha ricevuto una sovvenzione del valore di 8.97 milioni di dollari dalla Fondazione Bill & Melinda Gates per sostenere lo sviluppo di un test per la tubercolosi.
- Distribuzione di contenuti basati su SEO e PR. Ricevi amplificazione oggi.
- PlatoData.Network Generativo verticale Ai. Potenzia te stesso. Accedi qui.
- PlatoAiStream. Intelligenza Web3. Conoscenza amplificata. Accedi qui.
- PlatoneESG. Carbonio, Tecnologia pulita, Energia, Ambiente, Solare, Gestione dei rifiuti. Accedi qui.
- Platone Salute. Intelligence sulle biotecnologie e sulle sperimentazioni cliniche. Accedi qui.
- Fonte: https://www.medicaldevice-network.com/news/co-dx-fda-eua-covid-test/
- :ha
- :È
- :non
- $ SU
- 11
- 30
- 7
- 8
- 9
- a
- capace
- WRI
- accessibilità
- aggiunta
- amministrazione
- avanzando
- agenzie
- Tutti
- lungo
- anche
- an
- ed
- App
- Applicazioni
- SONO
- articolo
- valutare
- At
- autorizzazione
- disponibile
- bandiera
- BE
- essendo
- sotto
- benefico
- Conto
- affari
- by
- Materiale
- capacità
- capace
- ceo
- catena
- Info su
- COM
- combattere
- commercialmente
- azienda
- Società
- competitivo
- globale
- incluso
- che comprende
- fiducioso
- paesi
- COVID-19
- credito
- alle lezioni
- Le notizie del GIORNO
- decisione
- consegnare
- fornire risultati
- dimostrato
- Nonostante
- individuare
- rivelazione
- in via di sviluppo
- Mercato
- dispositivo
- diagnostica
- Malattia
- dna
- scaricare
- droga
- bordo
- emergenza
- fine
- Etere (ETH)
- valutazioni
- fda
- si concentra
- cibo
- Food and Drug Administration
- Food and Drug Administration (FDA)
- Nel
- modulo
- Fondazione
- Gratis
- da
- finanziamento
- futuro
- Guadagno
- Gates
- GlobalData
- concedere
- Avere
- aiutare
- vivamente
- Casa
- ORE
- Tuttavia
- HTTPS
- umano
- ICON
- in
- inclusi
- Compreso
- Aumento
- industria
- approfondimenti di settore
- Influenza
- intuizioni
- strumento
- IT
- SUO
- jpg
- kit
- principale
- leveraged
- piace
- make
- molti
- Rappresentanza
- cancelli di melinda
- verbale
- Missione
- Mobile
- mobile app
- dispositivo mobile
- mese
- maggior parte
- nasale
- quasi
- New
- Nuova piattaforma
- Nuove tecnologie
- notizie
- Newsletter
- Novembre
- of
- offrire
- on
- opera
- or
- Organizzazioni
- Altro
- nostro
- Azienda
- ancora
- pannello di eventi
- passato
- PCR
- piattaforma
- tecnologia della piattaforma
- Platone
- Platone Data Intelligence
- PlatoneDati
- punto
- lavori
- alimentato
- attualmente
- prezzo
- Pro
- Problema
- Profilo
- Profili
- qualità
- reazione
- tempo reale
- ricevuto
- normativo
- pertinente
- resti
- necessario
- riparazioni
- Risultati
- recensioni
- revisione
- RNA
- RSV
- Suddetto
- Risparmi
- cerca
- impostazioni
- ha mostrato
- shutterstock
- significativa
- singolo
- SIX
- Sei mesi
- smartphone
- So
- ricercato
- inizia a
- step
- sottomissione
- supporto
- SVG
- team
- Tecnologie
- Tecnologia
- test
- test
- che
- Il
- terapeutica
- questo
- quest'anno
- tre
- a
- verso
- unico
- us
- Cibo USA
- uso
- Utente
- vaccini
- vario
- virus
- importantissima
- volere
- we
- quale
- volere
- con
- classe mondiale
- In tutto il mondo
- valore
- anno
- ancora
- Tu
- Trasferimento da aeroporto a Sharm
- zefiro