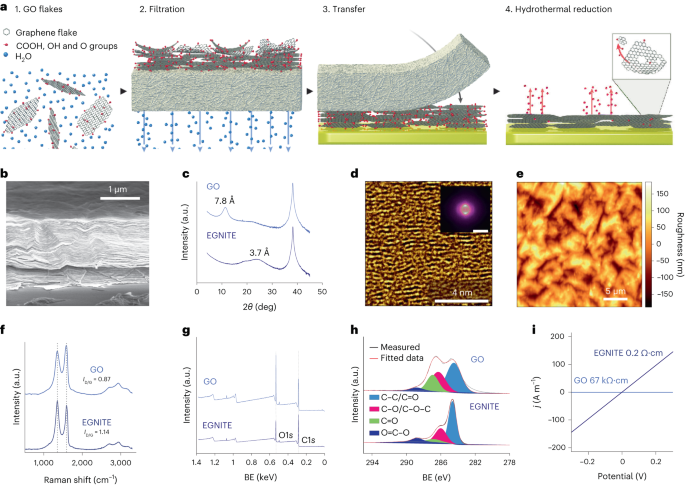
Preparazione e caratterizzazione dei materiali
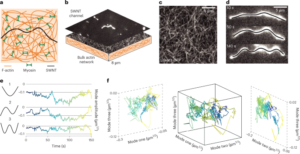
La soluzione acquosa GO è stata diluita in acqua deionizzata per ottenere 0.15 mg ml-1 soluzione e filtrata sotto vuoto attraverso una membrana di nitrocellulosa con pori di 0.025 μm, formando un film sottile di GO. La pellicola sottile è stata quindi trasferita sul substrato target utilizzando il trasferimento a umido in acqua deionizzata e un'ulteriore ricottura termica a 100°C per 2°min. La pila di film-substrato GO è stata ridotta idrotermicamente a 134 °C in un'autoclave standard per 3 h per formare EGNITE. Il substrato di base per tutti gli studi di caratterizzazione di EGNITE era un quadrato (1 × 1 cm2) di Si/SiO2 (400 μm/1 μm).
XPS
Le misurazioni XPS sono state eseguite con un analizzatore Phoibos 150 (SPECS) in condizioni di vuoto ultraelevato (pressione base, 5 × 10-10 mbar) con una sorgente di raggi X monocromatica Al Kα (1,486.74 eV). Gli spettri generali sono stati acquisiti con un'energia di passaggio di 50 eV e una dimensione del passo di 1 eV mentre gli spettri ad alta risoluzione sono stati acquisiti con un'energia di passaggio di 20 eV e una dimensione del passo di 0.05 eV. La risoluzione complessiva in queste ultime condizioni è 0.58 eV, come determinato misurando l'intera larghezza a metà massimo dell'Ag 3d5/2 picco di argento polverizzato. L’analisi XPS mostra una forte diminuzione dopo il trattamento idrotermale del picco C–O (associato a gruppi epossidici), ma un piccolo contributo di C–OH, C=O e C(O)OH dovuto a idrossili, carbonili e carbossili che rimangono dopo la riduzione. La deconvoluzione dell'O1s il picco conferma tale comportamento. Il contributo principale al C1s il segnale dopo la riduzione idrotermale, tuttavia, proviene sp2 orbitali C-C ibridati34,57.
Diffrazione di raggi X
Misure di diffrazione dei raggi X (θ-2θ scansione) sono stati eseguiti in un diffrattometro per la ricerca sui materiali (Malvern PANalytical). Questo diffrattometro ha un piano orizzontale ω-2θ goniometro (raggio 320 mm) con geometria a quattro cerchi e lavorato con un tubo radiogeno ceramico con anodo di Cu Kα (λ = 1.540598 Å). Il rilevatore utilizzato è un Pixcel che è un rilevatore di raggi X veloce basato sulla tecnologia Medipix2.
spettroscopia Raman
Le misurazioni della spettroscopia Raman sono state eseguite utilizzando uno spettrografo Witec dotato di una linea di eccitazione laser da 488 nm. Per le misurazioni, gli spettri Raman sono stati acquisiti utilizzando un obiettivo 50× e un reticolo da 600 scanalature per nm; la potenza del laser è stata mantenuta al di sotto di 1.5 mW per evitare il riscaldamento del campione.
TEM
Una lamella di fascio ionico focalizzato è stata preparata con un Helios NanoLab DualBeam (LMA-INA) per lo studio in sezione trasversale del campione EGNITE. Le analisi strutturali sono state eseguite mediante TEM utilizzando un microscopio Tecnai F20 operante a 200 kV, comprese le tecniche HRTEM e STEM anulare a campo scuro ad alto angolo. L'esperimento STEM-EELS è stato eseguito in un microscopio Tecnai F20 funzionante a 200 KeV, con apertura di 5 mm, lunghezza della fotocamera di 30 mm, un angolo di convergenza di 12.7 mrad e un angolo di raccolta di 87.6 mrad. Poiché abbiamo utilizzato 0.5 eV per pixel e 250 eV come energia iniziale nell'acquisizione della perdita del nucleo, non abbiamo acquisito il bordo Si K previsto a 1,839 eV, il bordo Pt M a 2,122 eV e il bordo Au M a 2,206 eV. La composizione atomica relativa di C–O è stata ottenuta focalizzando la nostra attenzione sullo strato GO ridotto e assumendo che gli archi analizzati (C e O nel nostro caso) si sommino al 100%. Questa ipotesi è valida nel nostro caso come evidenziato nell'art Informazioni supplementari mappe. La sezione d'urto differenziale di energia è stata calcolata utilizzando il modello Hartree-Slater e lo sfondo utilizzando un modello a basso consumo.
Conduttività elettrica
Le misurazioni della conduttività elettrica sono state eseguite utilizzando un sourcemeter Keithley 2400 in configurazione a due punti. I campioni misurati consistevano in film EGNITE di 1 × 1 cm2 sopra un SiO2 substrato.
L'analisi dei dati
La diffrazione dei raggi X, i dati Raman e XPS sono stati analizzati utilizzando i pacchetti Python 3.7 (Numpy, Pandas, Scipy, Xrdtools, Lmfit, Rampy, Peakutils, Matplotlib). La distanza tra i piani è stata calcolata dalle misurazioni della diffrazione dei raggi X secondo la legge di Snell. Una volta spostati i dati nel dominio spaziale, è stato adattato il massimo dei picchi. La distanza corrispondente ha fornito un valore medio della distanza tra i piani. Le deviazioni da tali valori medi sono state calcolate dall'intera larghezza a metà massimo degli adattamenti lorentziani dei picchi nel dominio spaziale. Le misurazioni della spettroscopia XPS e Raman sono state analizzate adattando una convoluzione di picchi sulle posizioni previste per le caratteristiche corrispondenti. I valori di conducibilità del GO e dell'EGNITE sono stati ottenuti montando il I-V curve misurate nelle misure di conducibilità elettrica secondo la legge di Ohm. I dati sono n = 1 per ogni misurazione.
Fabbricazione di array flessibili
La fabbricazione dei dispositivi è mostrata nella Figura supplementare. 4. I dispositivi sono stati fabbricati su Si/SiO da 4 pollici2 (400 μm/1 μm) wafer. Innanzitutto, uno strato di PI spesso 10 µm (PI-2611, HD MicroSystems) è stato rivestito con centrifugazione sul wafer e cotto in un'atmosfera ricca di azoto a 350 °C per 30 min. Tracce metalliche sono state modellate utilizzando la litografia ottica del fotoresist a inversione di immagine (AZ5214, Microchemicals). È stata utilizzata l'evaporazione con fascio di elettroni per depositare 20 nm di titanio e 200 di oro ed è stato eseguito il lift-off. Abbiamo utilizzato una pellicola EGNITE di circa 1 μm di spessore come compromesso tra prestazioni elettrochimiche e flessibilità dell'array. Dopo aver trasferito la pellicola GO, l'alluminio è stato evaporato con fascio elettronico e le aree sopra i futuri microelettrodi sono state definite utilizzando un fotoresist negativo (nLOF 2070, Microchemicals) e sollevate. Successivamente, il film GO è stato inciso ovunque tranne che per i futuri microelettrodi utilizzando un attacco con ioni reattivi all'ossigeno (RIE) per 5 minuti a 500 W e le colonne di alluminio protettive sono state incise con una soluzione diluita di acidi fosforico e nitrico. Quindi, uno strato di PI-3 spesso 2611 µm è stato depositato sul wafer e cotto come descritto in precedenza. Le aperture PI-2611 sul microelettrodo sono state quindi definite utilizzando un fotoresist spesso positivo (AZ9260, Microchemicals) che fungeva da maschera per un successivo RIE di ossigeno. Successivamente, i dispositivi sono stati modellati sullo strato PI, sempre utilizzando fotoresist AZ9260 e RIE. Lo strato di fotoresist è stato quindi rimosso in acetone e il wafer è stato pulito in alcool isopropilico ed essiccato. Infine, i dispositivi sono stati staccati dal wafer ed erano pronti per essere collocati in buste di sterilizzazione per essere trattati idrotermicamente a 134°C in un'autoclave standard per 3 ore.
Caratterizzazione elettrochimica del microelettrodo
La caratterizzazione elettrochimica dei microelettrodi è stata eseguita con un potenziostato Metrohm Autolab PGSTAT128N in 1× PBS (Sigma-Aldrich, P4417) contenente tampone fosfato 10 mM, NaCl 137 mM e KCl 2.7 mM a pH 7.4 e utilizzando una configurazione a tre elettrodi. Come riferimento è stato utilizzato un elettrodo Ag/AgCl (FlexRef, WPI) e come controelettrodo un filo di platino (Alfa Aesar, 45093).
Prima della valutazione delle prestazioni, gli elettrodi sono stati pulsati con 10,000 impulsi a carica bilanciata (1 ms, 15 μA). Esposizione degli elettrodi a protocolli di pulsazione continua preceduti da 100 cicli di voltammetria ciclica (da −0.9 a +0.8 V) a 50 mV s-1, 20 ripetizioni di 5,000 impulsi (1 ms) e rideterminazione del potenziale a circuito aperto.
L'analisi dei dati
I dati di caratterizzazione elettrochimica sono stati analizzati utilizzando i pacchetti Python 3.7 (Numpy, Pandas, Scipy, Pyeis, Lmfit, Matplotlib). I dati della spettroscopia di impedenza sono stati adattati a un modello elettrico equivalente costituito da una resistenza (R) in serie con un elemento a fase costante (CPE). Da lì, il valore CPE è stato approssimato a una capacità e diviso per l'area geometrica del microelettrodo per ottenere un valore equivalente per la capacità interfacciale di EGNITE. La capacità di accumulo di carica del microelettrodo (CSC) è stata calcolata da misurazioni di voltammetria ciclica integrando i regimi catodico e anodico della corrente misurata e normalizzando in base alla velocità di scansione. La capacità di immagazzinamento della carica catodica e anodica (cCSC e aCSC) alla velocità di scansione di 100 mV di EGNITE è 45.9 ± 2.4 e 34.6 ± 2.8 mC cm-2, rispettivamente (n = 3). Come riportato per gli altri materiali58, le CSC ottenute dipendono dalla velocità di scansione (Fig. 5). Per valutare la presenza di reazioni di riduzione dell'ossigeno, abbiamo misurato la forma d'onda CV sotto l'elettrolita spurgato con azoto59 e non hanno osservato differenze sostanziali nella forma d'onda (Fig. 6). Tuttavia, i nostri risultati non affrontano completamente l’impatto delle reazioni di riduzione dell’ossigeno nella capacità di iniezione di carica di EGNITE ed è necessario fare ulteriore lavoro per indagare adeguatamente su questo aspetto. La capacità di iniezione di carica del microelettrodo (CIC) è stata stabilita determinando l'ampiezza dell'impulso di corrente che ha suscitato una differenza di tensione (dopo aver rimosso la caduta ohmica) che corrispondeva alla finestra elettrochimica dell'acqua dell'elettrodo (−0.9 V per catodico e +0.8 V per anodico rispetto ad Ag/AgCl ) (Figura complementare. 17)60.
analisi statistica
I dati sono medi ± s.d., n = 18 per EIS e n = 3 per cronopotenziometrie. I dati della mappa dell'escursione della tensione capacitiva catodica sono la media delle escursioni della tensione capacitiva catodica per un evento per ciascuna forma di impulso di n = 3 elettrodi.
Valutazione della stabilità meccanica
Sonicazione ad ultrasuoni
Gli array di elettrodi EGNITE sono stati posizionati all'interno di un bicchiere riempito con acqua in un bagnomaria a ultrasuoni (Elmasonic P 180H). La sonicazione è stata applicata a 37 kHz per 15 min a 200 W, seguita da altri 15 min di sonicazione a 37 kHz con la potenza elevata a 300 W. Le immagini degli elettrodi sono state acquisite prima e dopo le fasi di sonicazione.
Prova di flessione
L'impostazione della piegatura (Fig. 2k) era costituito da tre aste cilindriche; quello centrale (diametro 700 μm) è stato abbassato, producendo angoli di piegatura di 131°. Per il test di flessione sono stati utilizzati tre array di microelettrodi flessibili. Ciascun array conteneva 18 microelettrodi di 50 µm di diametro. Due array sono stati misurati dopo 10 e 20 cicli mentre un dispositivo è stato misurato solo per 10 cicli poiché è stato danneggiato durante la manipolazione dopo la misurazione. Il ciclo di prova di flessione consisteva in un'applicazione di carico della durata di 10 s più 10 s senza carico. I dispositivi sono stati caratterizzati elettrochimicamente (EIS e CV) prima e dopo 10 e 20 cicli di piegatura.
Registrazione neurale epicorticale
Impianto epicorticale
Tutte le procedure sperimentali sono state eseguite in conformità con le raccomandazioni del Consiglio della Comunità Europea e con la legislazione francese per la cura e l'uso degli animali da laboratorio. I protocolli sono stati approvati dal comitato etico di Grenoble (ComEth) e autorizzati dal ministero francese (numero 04815.02). Ratti Sprague-Dawley (maschio, 4 mesi, peso ~600 g) sono stati anestetizzati per via intramuscolare con ketamina (50 mg per kg (peso corporeo)) e xilazina (10 mg per kg (peso corporeo)), e quindi fissati su un supporto stereotassico. La rimozione del cranio temporale ha esposto la corteccia uditiva. La dura madre è stata preservata per evitare di danneggiare il tessuto corticale. È stato praticato un foro al vertice per inserire l'elettrodo di riferimento, ed è stato praticato un secondo foro, a 7 mm in avanti dal primo, per inserire l'elettrodo di terra. Gli elettrodi erano pin spessi 0.5 mm utilizzati per le prese dei circuiti integrati. Sono stati posizionati in modo da stabilire un contatto elettrico con la dura madre e fissati al cranio con cemento dentale. Abbiamo quindi montato il nastro di microelettrodi di superficie sulla corteccia uditiva come mostrato in Fig. 3b. I modelli delle vene identificano la corteccia uditiva, nell’area 41 della mappa del cervello del ratto di Krieg. I segnali corticali sono stati simultaneamente amplificati con un guadagno di 1,000 e digitalizzati ad una frequenza di campionamento di 33 kHz. Un altoparlante posto a 20 cm davanti all’orecchio di un ratto, controlaterale alla corteccia esposta, trasmetteva stimoli acustici. Gli stimoli erogati sono stati monitorati da un microfono da 0.25 pollici (Brüel & Kjaer, 4939) posizionato vicino all'orecchio e presentati in livello di pressione sonora (dB SPL re 20 μPa). Esaminiamo le risposte di latenza media con vertice positivo (negativo verso l'alto) evocate dall'alternanza di clic a 80 dB SPL e stimoli di toneburst a 70 dB SPL con frequenze che vanno da 5 a 40 kHz, un tempo di salita e discesa di 5 ms e una durata di 200 ms.
L'analisi dei dati
I dati elettrofisiologici sono stati analizzati utilizzando i pacchetti Python 3.7 (Numpy, Pandas, Scipy, Neo, Elephant, Sklearn Matplotlib) e la libreria personalizzata PhyREC (https://github.com/aguimera/PhyREC). r.m.s. i valori sono stati calcolati con una finestra scorrevole di 20 ms a frequenze superiori a 200 Hz. Gli spettrogrammi sono stati calcolati per un intervallo compreso tra 70 Hz e 1.1 kHz. La PSD è stata calcolata su 60 secondi di registrazioni continue. Per un dato array di elettrodi sono stati calcolati due PSD: in vivo (IV) e post mortem (PM). L'SNR è espresso in dB (20 × ln(r.m.s.(IV)/r.m.s.(PM))) e interpolato per 20 punti distanziati logaritmicamente tra 10 Hz e 1 kHz.
analisi statistica
I dati neurali epicorticali presentati in Fig. 3 sono presi da misurazioni individuali su un singolo animale. Nella fig. 3c, vengono presentati i dati di 64 elettrodi. Nella fig. 3d, vengono presentati i dati di due elettrodi selezionati. Nella fig. 3f, PSD e SNR sono calcolati da 64 elettrodi EGNITE e sono mostrati come media ± s.d. Nella figura supplementare 12c, d i dati mediani sono presentati per 192 elettrodi EGNITE da n = 3 esperimenti e 60 elettrodi di platino da n = 1 esperimento.
Registrazione neurale intracorticale
Impianto intracorticale
Gli animali sono stati anestetizzati con una miscela di ketamina/xilazina (75:1, 0.35 ml/28 g i.p.) e questo stato è stato mantenuto con una maschera per inalazione che forniva isoflurano all'1.5%. Diverse microviti sono state posizionate nel cranio per stabilizzare l'impianto e quella sulla parte superiore del cervelletto è stata utilizzata come base generale. La sonda è stata impiantata nella corteccia prefrontale (coordinate: AP, 1.5 mm; ML, ±0.5 mm; DV, −1.7 mm dal bregma). L'impianto è stato eseguito rivestendo la sonda con maltosio (vedere il protocollo di seguito) per fornire rigidità temporanea alla sonda e facilitare l'inserimento della sonda. La sonda è stata sigillata con cemento dentale. I connettori TDT-ZifClip sono stati utilizzati per collegare la sonda al sistema elettrofisiologico tramite un cavo miniaturizzato. Dopo l'intervento, il topo è stato sottoposto a un periodo di recupero di 1 settimana ricevendo trattamenti analgesici (buprenorfina) e antinfiammatori (meloxicam). L'attività neurale è stata registrata con il sistema multicanale Open Ephys ad una frequenza di campionamento di 30 kHz con un amplificatore Intan RHD2132. Gli esperimenti sul compito uditivo sono stati condotti in una scatola insonorizzata, con due altoparlanti all'interno, utilizzando protocolli basati sul lavoro precedentemente descritto61. Lo stimolo sonoro consisteva in un clic di rumore bianco della durata di 15 ms, ripetuto 100 volte (cicli), ciascuno separato da 5 s (intervallo interstimolo). Durante l'attività l'animale ha potuto muoversi liberamente.
Protocollo di rinforzo del maltosio
Una soluzione acquosa di maltosio viene riscaldata fino al punto di transizione vetrosa (Tg), tra 130 e 160 °C, utilizzando una piastra calda o un forno a microonde. Una volta che il maltosio è viscoso, la parte posteriore della sonda viene messa in contatto solo con il maltosio. Quando il maltosio si raffredda, si irrigidisce e irrigidisce la sonda.
L'analisi dei dati
I segnali neurali provenienti da ciascun elettrodo sono stati filtrati offline per estrarre SUA e LFP. La SUA è stata stimata filtrando il segnale tra 450 e 6,000 Hz e i picchi dei singoli neuroni sono stati ordinati utilizzando l'analisi delle componenti principali con Offline Sorter v.4 (Plexon). Per ottenere LFP, i segnali sono stati sottocampionati a 1 kHz, detrendizzati e filtrati con notch per rimuovere gli artefatti della linea di rumore (50 Hz e le sue armoniche) con script scritti su misura in Python. L'AEP SNR è stato calcolato come il rapporto tra l'ampiezza del picco N1 e la s.d. di un periodo di 20 ms prima dello stimolo.
analisi statistica
I dati mostrati in Fig. 3h,XNUMX sono medi ± s.d., n = 30 come numero di prove medie. I dati registrati dallo stesso elettrodo vengono mostrati ai giorni 30, 60 e 90. Vengono presentati i dati di un singolo animale.
Biocompatibilità epicorticale cronica
Impianto chirurgico di dispositivi
Per questo studio sono stati utilizzati un totale di 27 ratti adulti, maschi, Sprague-Dawley (Charles River). Gli animali sono stati alloggiati a una temperatura ambiente di 21 ± 2 °C e un'umidità del 40–50%, su un ciclo di 12 h di luce/12 h di buio. I ratti sono stati alloggiati in gruppi e hanno avuto libero accesso alla dieta e all'acqua per tutto il periodo dell'esperimento. Le procedure sperimentali sono state condotte in conformità con l'Animal Welfare Act (1998), sotto l'approvazione del Ministero degli Interni del Regno Unito e dell'organismo locale di revisione etica per il benessere degli animali (AWERB). Gli animali sono stati anestetizzati con isoflurano (2-3%) per la durata dell'intervento chirurgico e la profondità dell'anestesia è stata monitorata mediante il test del riflesso del pizzicotto delle dita. Gli animali sono stati posti in un telaio stereotassico (Kopf, 900LS), posizionato sopra una coperta termica per mantenere la temperatura corporea. Un foro per craniotomia (~5 mm ×4 mm) è stato realizzato a 1 mm di distanza dalla linea mediana utilizzando un trapano dentale con una punta da 0.9 mm, la dura è stata rimossa e il dispositivo epicorticale è stato posizionato sulla superficie corticale del cervello. Il foro della craniotomia è stato sigillato con Kwik-sil, seguito da cemento dentale per fissarlo e la pelle suturata è stata chiusa. Sono state somministrate iniezioni sottocutanee di soluzione salina (1 ml per kg (peso corporeo)) e buprenorfina (0.03 mg per kg (peso corporeo)) per sostituire i liquidi persi e ridurre il dolore postoperatorio e l'anestesia è stata sospesa.
Raccolta ed elaborazione dei tessuti
Gli animali sono stati soppressi a 2, 6 o 12 settimane dopo l'impianto mediante un metodo appropriato per il tipo di analisi da eseguire.
Istologia e immunoistochimica
A 2, 6 o 12 settimane dall'impianto, i ratti sono stati soppressi tramite perfusione cardiaca con eparinizzato (10 U ml-1, Sigma-Aldrich) PBS, seguito da paraformaldeide al 4% (PFA, Sigma-Aldrich) in PBS. I cervelli sono stati postfissati in PFA al 4% per 24 ore, quindi trasferiti in saccarosio al 30% in PBS per almeno 48 ore prima del congelamento in isopentano. I cervelli sono stati quindi conservati a -80 °C fino alla criosezione a 25 μm. Il tessuto è stato quindi colorato con la molecola 1 dell'adattatore legante il calcio ionizzato (Iba-1) per determinare il livello di attivazione microgliale. In breve, le sezioni di tessuto sono state bloccate con siero di capra al 5% in PBS con Triton-X allo 0.1% per 1 ora prima dell'incubazione notturna a 4 °C con l'anticorpo primario anti-Iba-1 (1:1,000, 019-19741; Wako). Le sezioni sono state quindi colorate con l'anticorpo secondario, anti-coniglio Alexa Fluor 594 (1:400, A-11012; Thermo Fisher) per 1 ora a temperatura ambiente. I vetrini sono stati montati con vetrini coprioggetto utilizzando i mezzi di montaggio anti-sbiadimento Prolong Gold con 4,6-diamidino-2-fenilindolo (Thermo Fisher). La sonda copriva un'area di 3 × 3.7 mm2 sulla superficie corticale del cervello; le sezioni di tessuto selezionate per la colorazione coprivano 3.2 mm di lunghezza di questa regione. I vetrini sono stati sottoposti a scansione utilizzando uno scanner per vetrini per microscopio 3DHistech Pannoramic-250 a 20 × e le immagini sono state analizzate utilizzando CaseViewer v.2.4 (3DHistech). Per valutare l'attivazione della microglia, è stata coperta un'area di 3.2 mm, con un'immagine analizzata ogni 100 µm. Sono state scattate immagini con un ingrandimento di 8.5× che dettagliavano una sezione del sito della sonda epicorticale, a 3 mm dalla linea mediana del cervello, che comprendeva l'area direttamente sotto il sito della sonda.
Elaborazione delle immagini
I dati microscopici sono stati elaborati dalle immagini utilizzando un algoritmo per la caratterizzazione del fenotipo microglia (Figura 2 supplementare). 13). L'attivazione microgliale è stata analizzata utilizzando un CellProfiler* personalizzato (Broad Institute, v.3.1.9 da https://cellprofiler.org/) tubatura. Innanzitutto, il modulo EnhanceOrSuppressFeatures è stato utilizzato per migliorare le strutture filamentose come i neuriti applicando il metodo di miglioramento della tubeness. Dalle immagini migliorate, le celle sono state segmentate utilizzando il modulo awarePrimaryObjects. Le misurazioni preliminari delle cellule suggerivano che l'intervallo di diametro appropriato dell'oggetto era compreso tra 3 e 40 pixel. Gli oggetti al di fuori di questo intervallo di diametri o che toccavano il bordo dell'immagine venivano scartati. Le cellule sono state segmentate utilizzando una strategia di soglia adattiva Otsu a due classi con una dimensione della finestra adattiva di 50 pixel. Gli oggetti identificati dal modulo IdentificaPrimaryObjects sono stati immessi nel modulo MeasureObjectSizeShape per calcolare le proprietà necessarie per la classificazione delle celle. Nel modulo ClassifyObjects, la categoria su cui basare le classificazioni è stata specificata come AreaShape e l'estensione è stata selezionata come misurazione corrispondente. Le cellule sono state classificate come 'attivato" o "non attivato" in base alla proprietà Extent, che è il rapporto tra l'area occupata dalla cella e l'area occupata dal suo riquadro di delimitazione. Questo approccio di classificazione è stato razionalizzato dal fatto che le microglia attivate hanno corpi cellulari di grandi dimensioni e nessun processo, e quindi occupano una proporzione molto maggiore dei loro riquadri di delimitazione rispetto alle loro controparti non attivate. Infine, i moduli CalculateMath e ExportToSpreadsheet sono stati utilizzati per calcolare e produrre le statistiche desiderate.
analisi statistica
I set di dati sono n = 3 per ciascun tipo di dispositivo (impianto solo PI (PI); PI con oro microfabbricato esposto (oro); e PI con oro microfabbricato ed EGNITE (EGNITE) in tutti i momenti) ad eccezione dell'oro a 6 settimane che è n = 2 per i dati ELISA. Gli emisferi controlaterali sono stati combinati in ogni momento per dare n = 9 a 2 e 12 settimane dopo l'impianto e n = 8 a 6 settimane dopo l'impianto. L'analisi dei dati è stata eseguita utilizzando il software GraphPad Prism v.8. L’analisi statistica è stata completata utilizzando un’analisi della varianza a due vie (ANOVA) con il test di confronti multipli di Tukey, ove appropriato; P < 0.05 è stato ritenuto significativo.
ELISA
Dopo il periodo di impianto, gli animali sono stati terminati mediante lussazione cervicale. Il tessuto cerebrale è stato estratto sia dall'emisfero destro che da quello sinistro del cervello, congelato in azoto liquido e conservato a -80 °C fino a ulteriore utilizzo. Il tessuto è stato lisato utilizzando tampone di lisi NP-40 (150 mM NaCl, 50 mM Tris-Cl, sostituto Nonidet P1 all'40%, Fluka, pH regolato a 7.4) contenente inibitore della proteasi e della fosfatasi (Halt Protease and Phosphatase Inhibitor Cocktail, Thermo Fisher), seguita dalla rottura meccanica del tessuto (TissueLyser LT, Qiagen). I campioni sono stati quindi centrifugati per 10 min a 5,000 giri/min e il surnatante conservato a 4 °C fino al successivo utilizzo. Il pannello LEGENDplex Rat Inflammation Panel (numero di catalogo 740401, BioLegend), un kit ELISA multiplex basato su sfere, è stato utilizzato per quantificare le seguenti citochine; IL-1α, IL-1β, IL-6, IL-10, IL-12p70, IL-17A, IL-18, IL-33, CXCL1 (KC), CCL2 (MCP-1), stimolante le colonie di granulociti-macrofagi fattore, interferone-γ e fattore di necrosi tumorale. Il kit è stato utilizzato secondo le istruzioni del produttore, con proteine caricate a un volume fisso di 15 µl. Dopo l'incubazione con il surnatante, le sfere sono state analizzate su un citometro a flusso BD FACSVerse e i dati analizzati utilizzando il software di analisi dei dati LEGENDplex.
Stimolazione neurale
Impianto intrafascicolare
Tutti gli esperimenti sugli animali sono stati approvati dal Comitato Etico dell'Universitat Autònoma de Barcelona in conformità con la Direttiva del Consiglio delle Comunità Europee 2010/63/UE. Gli animali sono stati alloggiati a 22 ± 2 °C sotto un ciclo di 12 h di luce/12 h di buio con cibo e acqua liberamente disponibili. Il nervo sciatico di ratti femmine Sprague-Dawley anestetizzati (250-300 g, ~18 settimane) è stato esposto chirurgicamente e gli elettrodi TIME sono stati impiantati trasversalmente attraverso il nervo sciatico con l'aiuto di un ago dritto collegato a un filo ad anello 10-046. Il processo è stato monitorato al microscopio da dissezione per garantire la corretta posizione dei siti attivi all'interno dei fasci nervosi (Fig. 4b). Durante gli esperimenti, la temperatura corporea dell'animale veniva mantenuta con una piastra elettrica.
La stimolazione nervosa è stata effettuata applicando treni di impulsi di corrente bifasici di durata fissa di 100 μs per fase e di ampiezza crescente da 0 a 150 μA in passi di 1 o 3 μA a 3 Hz per 33 s (Stimolatore DS4, Digitimer) attraverso i diversi EGNITE microelettrodi. Contemporaneamente, i CMAP sono stati registrati dai muscoli GM, TA e PL utilizzando piccoli elettrodi ad ago (13 mm di lunghezza, 0.4 mm di diametro, elettrodi ad ago in acciaio inossidabile A-03-14BEP, Bionic) posizionati in ciascun muscolo62. L'elettrodo attivo è stato posizionato sul ventre muscolare ed il riferimento a livello del tendine. Le registrazioni elettromiografiche sono state amplificate (×100 per GM e TA, ×1,000 per PL; amplificatori P511AC, Grass), filtrate passa banda (da 3 Hz a 3 kHz) e digitalizzate con un sistema di registrazione PowerLab (PowerLab16SP, ADInstruments) a 20 kHz.
L'analisi dei dati
L'ampiezza di ciascun CMAP è stata misurata dal basale al picco negativo massimo. Le misurazioni del picco di tensione sono state normalizzate all'ampiezza CMAP massima ottenuta per ciascun muscolo nell'esperimento. Per ciascun sito attivo è stato calcolato un indice di selettività (SI) come rapporto tra l'ampiezza CMAP normalizzata per un muscolo, CMAPie la somma delle ampiezze CMAP normalizzate nei tre muscoli, seguendo la formula SIi = nWCPAi/∑nWCPAj, all'ampiezza minima della corrente di stimolazione che ha suscitato una risposta muscolare minima funzionalmente rilevante (definita come almeno il 5% di ampiezza CMAP per uno dei muscoli rispetto all'ampiezza CMAP massima di quel muscolo che era stata precedentemente determinata). Quindi, i siti attivi con il SI più alto per ciascuno dei tre muscoli sono stati selezionati come SI per ciascun muscolo in un dato esperimento.
Biocompatibilità intraneurale cronica
A seguito di una procedura precedentemente segnalata50,63, il nervo sciatico di ratti femmine Sprague-Dawley anestetizzati (250-300 g, ~18 settimane) è stato esposto e i dispositivi per la biocompatibilità in vivo con e senza EGNITE sono stati impiantati longitudinalmente nel ramo tibiale del nervo sciatico (n = 6–8 per gruppo). In breve, il nervo viene perforato alla triforcazione con un ago dritto collegato a un filo ad anello 10-0 (STC-6, Ethicon); il filo tira la punta a forma di freccia della striscia di elettrodi piegata. La punta è tagliata per togliere il filo e le punte di ciascun braccio sono leggermente piegate per evitare il ritiro del dispositivo. È stato scelto un impianto longitudinale perché consente uno studio migliore della risposta del corpo estraneo all'interno del nervo50.
Valutazione funzionale dei nervi e degli animali
Gli animali sono stati valutati durante il follow-up post-impianto mediante test di conduzione nervosa, algesimetria e locomozione su percorso pedonale.62. Per i test di conduzione, il nervo sciatico delle zampe impiantate e controlaterali è stato stimolato mediante elettrodi ad ago sull'incisura sciatica e il CMAP del muscolo PL è stato registrato come sopra. Sono state misurate la latenza e l'ampiezza del CMAP. Per il test algesimetrico, i ratti sono stati posizionati su una piattaforma di rete metallica ed è stato applicato uno stimolo meccanico non nocivo con una punta metallica collegata ad un algesimetro elettronico Von Frey (Bioseb). È stata misurata la soglia nocicettiva (forza in grammi alla quale gli animali hanno ritirato la zampa) delle zampe impiantate rispetto a quelle controlaterali. Per il test del percorso di camminata, la superficie plantare delle zampe posteriori è stata dipinta con inchiostro nero e ciascun ratto è stato lasciato camminare lungo un corridoio. Sono state raccolte le impronte e calcolato l'indice funzionale sciatico62.
Istologia
Dopo 2 o 8 settimane, gli animali sono stati perfusi con PFA (4%) e i nervi sciatici sono stati raccolti, postfissati, crioconservati e trattati per l'analisi istologica. Per la valutazione dell'FBR, i nervi sciatici sono stati tagliati in sezioni trasversali spesse 15 μm con un criostato (Leica CM190). I campioni sono stati colorati con anticorpi primari per assoni mielinizzati (anti-RT97 per etichettare Neurofilament 200K, 1:200; Developmental Studies Hybridoma Bank) e macrofagi (anti-Iba-1, 1:500; Wako). Quindi, le sezioni sono state incubate per 1 ora a temperatura ambiente con anticorpi secondari anti-topo Alexa Fluor 488 di asino e anti-coniglio Alexa Fluor 555 di asino (1:200, Invitrogen). Sono state selezionate sezioni rappresentative della parte centrale dell'impianto nel nervo tibiale, immagini scattate con un microscopio a epifluorescenza (Eclipse Ni, Nikon) collegato a una fotocamera digitale (DS-Ri2, Nikon) e analisi delle immagini eseguite con il software ImageJ (Istituti Nazionali della Sanità). È stata quantificata la quantità di cellule Iba-1 positive nell'intera area del nervo tibiale e lo spessore della capsula tissutale è stato misurato come la distanza media di ciascun lato dell'impianto dagli assoni più vicini.
analisi statistica
Per l'analisi statistica dei dati, abbiamo utilizzato l'ANOVA a una o due vie seguita dal test post hoc di Bonferroni per le differenze tra gruppi o tempi. Per la rappresentazione grafica e l'analisi è stato utilizzato il software GraphPad Prism. La significatività statistica è stata considerata quando P <0.05.
Reporting summary
Ulteriori informazioni sulla progettazione della ricerca sono disponibili nel Riepilogo dei rapporti sul portafoglio naturalistico collegato a questo articolo.
- Distribuzione di contenuti basati su SEO e PR. Ricevi amplificazione oggi.
- PlatoData.Network Generativo verticale Ai. Potenzia te stesso. Accedi qui.
- PlatoAiStream. Intelligenza Web3. Conoscenza amplificata. Accedi qui.
- PlatoneESG. Carbonio, Tecnologia pulita, Energia, Ambiente, Solare, Gestione dei rifiuti. Accedi qui.
- Platone Salute. Intelligence sulle biotecnologie e sulle sperimentazioni cliniche. Accedi qui.
- Fonte: https://www.nature.com/articles/s41565-023-01570-5
- :ha
- :È
- :non
- :Dove
- ][P
- $ SU
- 000
- 1
- 10
- 100
- 12
- 13
- 130
- 15%
- 150
- 160
- 19
- 1998
- 20
- 200
- 2010
- 2011
- 2014
- 2016
- 2018
- 2020
- 2022
- 22
- 24
- 25
- 250
- 26
- 27
- 28
- 30
- 300
- 320
- 33
- 35%
- 350
- 40
- 400
- 41
- 43
- 46
- 50
- 500
- 54
- 58
- 60
- 600
- 7
- 70
- 700
- 75
- 8
- 80
- 87
- 9
- 90
- a
- capace
- sopra
- accesso
- accordo
- Secondo
- acustico
- acquisire
- acquisito
- acquisizione
- operanti in
- Legge
- attivato
- Attivazione
- attivo
- attività
- adattabile
- aggiuntivo
- indirizzo
- Rettificato
- Adulto
- Dopo shavasana, sedersi in silenzio; saluti;
- AG
- ancora
- AL
- alcol
- Alexa
- algoritmo
- Tutti
- consente
- lungo
- am
- Ambientale
- quantità
- Amplified
- an
- analisi
- .
- Presentatrice
- ed
- animali
- animali
- Anticorpi
- anticorpo
- a parte
- Applicazioni
- applicato
- AMMISSIONE
- approccio
- opportuno
- approvazione
- approvato
- SONO
- RISERVATA
- aree
- ARM
- in giro
- Italia
- articolo
- AS
- valutare
- valutazione
- associato
- assunzione
- At
- Atmosfera
- atomico
- attenzione
- autorizzato
- disponibile
- evitare
- lontano
- sfondo
- Banca
- Barcellona
- base
- basato
- Linea di base
- BD
- BE
- Larghezza
- perché
- stato
- prima
- comportamento
- sotto
- Meglio
- fra
- rilegatura
- biomedico
- Po
- Nero
- bloccato
- corpi
- stile di vita
- entrambi
- Scatola
- scatole
- Cervello
- mente
- Branch di società
- brevemente
- ampio
- portato
- bufferizzare
- ma
- by
- cavo
- calcolare
- calcolato
- stanza
- Capacitivo
- Ultra-Grande
- che
- svolta
- Custodie
- Categoria
- cc2
- cella
- Celle
- cemento
- centrale
- sfide
- caratterizzato
- carica
- Charles
- chimico
- scelto
- classificazione
- classificato
- clicca
- chiuso
- cocktail
- collezione
- colonne
- combinato
- viene
- comitato
- Comunità
- comunità
- Completato
- composizione
- condizioni
- condotto
- conduttività
- Configurazione
- Connettiti
- collegato
- considerato
- Consistente
- costante
- contatti
- contenute
- continuo
- contributo
- Convergenza
- correggere
- Corrispondente
- corridoio
- corteccia
- Consiglio
- omologhi
- corso
- coperto
- critico
- Cross
- crioconservato
- Corrente
- costume
- taglio
- ciclo
- cicli
- citochine
- danneggiamento
- Scuro
- dati
- analisi dei dati
- Giorni
- de
- diminuire
- ritenuto
- definito
- del
- consegnato
- dipendere
- deposito
- depositato
- profondità
- descritta
- Design
- desiderato
- dettagliati
- Determinare
- determinato
- determinazione
- sviluppo
- dispositivo
- dispositivi
- DID
- Dieta
- differenza
- differenze
- diverso
- digitale
- digitalizzato
- diluito
- dirette
- direttamente
- lussazione
- Rottura
- distanza
- Diviso
- do
- dominio
- fatto
- giù
- Cadere
- dovuto
- durata
- durante
- E&T
- ogni
- bordo
- Elettrico
- Elettronico
- elemento
- elefante
- elevata
- che comprende
- energia
- accrescere
- migliorata
- aumento
- garantire
- attrezzato
- Equivalente
- sviluppate
- stimato
- Etere (ETH)
- etico
- EUR
- europeo
- EV
- valutato
- valutazione
- Evento
- Ogni
- ovunque
- evidenziato
- esaminare
- eccezione
- previsto
- esperimento
- sperimentale
- esperimenti
- esposto
- Esposizione
- espresso
- estensione
- estratto
- facilitare
- fatto
- fattore
- Autunno
- lontano
- FAST
- Caratteristiche
- la donna
- Fico
- figura
- pieno
- Film
- attraverso
- filtraggio
- Infine
- Nome
- adatto
- fisso
- Flessibilità
- flessibile
- flusso
- concentrato
- messa a fuoco
- seguito
- i seguenti
- cibo
- Nel
- forza
- estero
- modulo
- formula
- TELAIO
- Gratis
- liberamente
- congelamento
- Francese
- da
- anteriore
- congelati
- pieno
- completamente
- funzionale
- funzionalmente
- ulteriormente
- futuro
- Guadagno
- ha dato
- Generale
- geometria
- Dare
- dato
- vetro.
- GM
- Go
- Oro
- Grafene
- erba
- Terra
- Gruppo
- Gruppo
- linee guida
- ha avuto
- Metà
- Manovrabilità
- Avere
- Salute e benessere
- Aiuto
- emisferi
- ad alta risoluzione
- massimo
- titolare
- Foro
- Casa
- Home Office
- Orizzontale
- HOT
- Tuttavia
- HTTPS
- huang
- i
- identificato
- identificare
- IEEE
- Immagine
- analisi dell'immagine
- immagini
- Impact
- in
- Compreso
- crescente
- incubato
- INCUBAZIONE
- Index
- individuale
- infiammazione
- informazioni
- ingresso
- interno
- Istituto
- istruzioni
- integrato
- Integrazione
- destinato
- Interfaccia
- interfacce
- ai miglioramenti
- indagare
- IT
- SUO
- tenere
- kit
- Koch
- Discografica
- di laboratorio
- grandi
- superiore, se assunto singolarmente.
- laser
- Cognome
- Latenza
- dopo
- Legge
- strato
- meno
- a sinistra
- Legislazione
- Lunghezza
- Livello
- Biblioteca
- piace
- limiti
- linea
- LINK
- connesso
- Liquido
- caricare
- locale
- collocato
- posizioni
- Lunghi
- a lungo termine
- perso
- abbassato
- macrofagi
- fatto
- Principale
- mantenere
- make
- carta geografica
- Maps
- mask
- abbinato
- materiale
- Materiale
- matplotlib
- massimo
- mc
- significare
- si intende
- misurato
- misurazioni
- di misura
- meccanico
- Media
- metallo
- metodo
- microglia
- microfono
- Microscopio
- Microscopia
- In mezzo
- verbale
- minimo
- ordine
- ministero
- miscela
- ML
- modello
- modelli
- modulo
- moduli
- molecola
- monitorati
- mese
- mouse
- cambiano
- mosso
- MS
- multicanale
- muscolo
- nanotecnologia
- il
- National Institutes of Health
- Natura
- Vicino
- necessaria
- necrosi
- esigenze
- negativo.
- NEO
- rete
- Rete
- Neurale
- neurofilamento
- neuroni
- GENERAZIONE
- no
- Rumore
- numero
- numpy
- oggetto
- obiettivo
- oggetti
- osservare
- ottenere
- ottenuto
- of
- MENO
- Office
- offline
- Vecchio
- on
- una volta
- ONE
- esclusivamente
- aprire
- aperture
- operato
- or
- Altro
- nostro
- su
- produzione
- al di fuori
- ancora
- complessivo
- per una notte
- panoramica
- Oxygen
- Packages
- sentiero
- Dolore
- panda
- pannello di eventi
- parte
- passare
- modelli
- ZAMPE
- PBS
- Corrente di
- per
- performance
- eseguita
- periodo
- periferico
- fase
- fenotipo
- pino
- conduttura
- pixel
- posto
- Planes
- piattaforma
- platino
- Platone
- Platone Data Intelligence
- PlatoneDati
- più
- pm
- punto
- punti
- lavori
- posizione
- positivo
- Post
- potenziale
- energia
- preliminare
- preparazione
- preparato
- presenza
- presentata
- conservato
- pressione
- in precedenza
- primario
- Precedente
- sonda
- procedure
- processi
- elaborati
- i processi
- produzione
- Prodotti
- propriamente
- proprietà
- proprietà
- proporzione
- proteggere
- Proteine
- protocollo
- protocolli
- fornire
- fornitura
- Maglioni
- impulso
- Python
- R
- gamma
- che vanno
- RAT
- tasso
- rapporto
- RE
- reazione
- reazioni
- pronto
- ricevente
- raccomandazioni
- registrato
- registrazione
- recupero
- ridurre
- Ridotto
- riduzione
- riferimento
- rigenerazione
- regimi
- regione
- parente
- pertinente
- rimanere
- rimuovere
- rimosso
- rimozione
- ripetuto
- sostituire
- Segnalati
- Reportistica
- rappresentazione
- rappresentante
- riparazioni
- resistenza all'usura
- Risoluzione
- rispetto
- rispettivamente
- risposta
- risposte
- Risultati
- Inversione
- recensioni
- Nastro
- Ricco
- destra
- Aumento
- fiume
- Prenotazione sale
- Correre
- s
- stesso
- scansione
- script
- Secondo
- secondario
- Sezione
- sezioni
- sicuro
- vedere
- selezionato
- Serie
- Siero
- Set
- alcuni
- Forma
- mostrato
- Spettacoli
- lato
- Signal
- Segnali
- significato
- significativa
- Argento
- contemporaneamente
- singolo
- site
- Siti
- Taglia
- Pelle
- scivolo
- Diapositive
- scorrevole
- piccole
- Scatto
- Software
- soluzione
- Suono
- Fonte
- Spaziale
- Speaker
- Altoparlanti
- specificato
- occhiali
- Spettroscopia
- picchi
- Spin
- quadrato
- Stabilità
- stabilizzare
- pila
- Acciaio inossidabile
- Standard
- standardizzato
- Di partenza
- Regione / Stato
- statistiche
- statistica
- Steam
- acciaio
- gambo
- step
- Passi
- stimolo
- conservazione
- memorizzati
- dritto
- Strategia
- Striscia
- forte
- strutturale
- strutture
- studi
- Studio
- sottocutaneo
- successivo
- sostanziale
- tale
- somma
- superficie
- Chirurgia
- sistema
- T
- Fai
- preso
- Target
- Task
- tecniche
- Tecnologia
- temporaneo
- test
- test
- di
- che
- I
- L'area
- Il futuro
- Regno Unito
- loro
- poi
- Là.
- termico
- di
- questo
- quelli
- tre
- soglia
- Attraverso
- per tutto
- così
- tempo
- volte
- tipo
- suggerimenti
- fazzoletto di carta
- Titanio
- a
- TONE
- top
- Totale
- toccante
- verso
- pista
- forma
- trans
- trasferimento
- trasferito
- Trasferimento
- transizione
- trattati
- trattamento
- trattamenti
- studi clinici
- lezione
- seconda
- Digitare
- Uk
- ultrasuono
- per
- e una comprensione reciproca
- sottoposti
- fino a quando
- uso
- utilizzato
- utilizzando
- Vuoto
- un valido
- APPREZZIAMO
- Valori
- contro
- via
- vivo
- Tensione
- volume
- di
- W
- camminare
- a piedi
- Prima
- Water
- we
- settimana
- Settimane
- pesatura
- peso
- Benessere
- sono stati
- quando
- quale
- while
- bianca
- tutto
- finestra
- Wire
- con
- ritiro
- senza
- Lavora
- lavorato
- lavoro
- X
- raggi X
- zefiro