16. január 2024
(Nanowerk News) Egy kulcsfontosságú kémiai reakció – amelyben a protonok mozgása az elektróda felülete és az elektrolit között elektromos áramot vezet – számos energiatechnológia kritikus lépése, beleértve az üzemanyagcellákat és a hidrogéngáz előállítására használt elektrolizátorokat. Az MIT vegyészei most először térképezték fel részletesen, hogy ezek a protonkapcsolt elektrontranszferek hogyan történnek az elektródák felületén. Eredményeik segíthetnek a kutatóknak hatékonyabb üzemanyagcellák, akkumulátorok vagy más energiatechnológiák tervezésében. „Előrelépésünk ebben a cikkben az volt, hogy tanulmányozzuk és megértsük, hogy ezek az elektronok és protonok hogyan kapcsolódnak egymáshoz egy felületen, ami fontos az energiaátalakító eszközök vagy katalitikus reakciók szempontjából fontos katalitikus reakciók szempontjából” – mondja Yogesh Surendranath, a az MIT kémia és vegyészmérnök professzora és a tanulmány vezető szerzője. Eredményeik között a kutatók pontosan nyomon tudták követni, hogy az elektródát körülvevő elektrolitoldat pH-értékének változása hogyan befolyásolja a protonok mozgásának sebességét és az elektródán belüli elektronáramlást. Noah Lewis, az MIT végzős hallgatója a ma megjelenő tanulmány vezető szerzője Természet kémia („Molekuláris szintű mechanikai keret a határfelületi protoncsatolt elektrontranszfer kinetikához”). Ryan Bisbey, az MIT egykori posztdoktora; Karl Westendorff, az MIT végzős hallgatója; és Alexander Soudackov, a Yale Egyetem kutatója is a cikk szerzői.
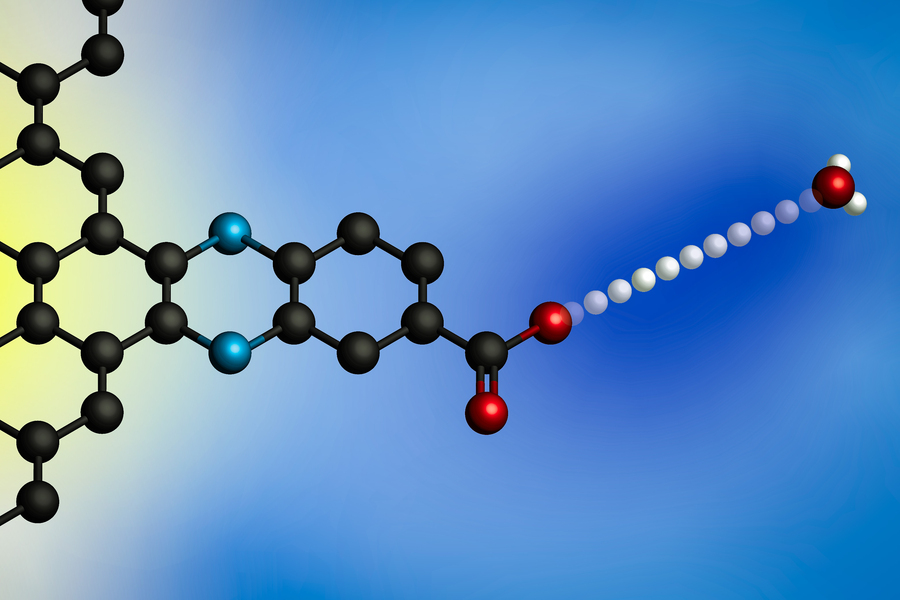 Elektromos potenciál alkalmazása hatására a proton átkerül a hidroniumionról (jobbra) az elektród felületére. Molekulárisan meghatározott protonkötő helyekkel rendelkező elektródák segítségével az MIT kutatói általános modellt dolgoztak ki ezekre a határfelületi protonkapcsolt elektronátviteli reakciókra. (Kép: a kutatók jóvoltából)
Elektromos potenciál alkalmazása hatására a proton átkerül a hidroniumionról (jobbra) az elektród felületére. Molekulárisan meghatározott protonkötő helyekkel rendelkező elektródák segítségével az MIT kutatói általános modellt dolgoztak ki ezekre a határfelületi protonkapcsolt elektronátviteli reakciókra. (Kép: a kutatók jóvoltából)
 Elektromos potenciál alkalmazása hatására a proton átkerül a hidroniumionról (jobbra) az elektród felületére. Molekulárisan meghatározott protonkötő helyekkel rendelkező elektródák segítségével az MIT kutatói általános modellt dolgoztak ki ezekre a határfelületi protonkapcsolt elektronátviteli reakciókra. (Kép: a kutatók jóvoltából)
Elektromos potenciál alkalmazása hatására a proton átkerül a hidroniumionról (jobbra) az elektród felületére. Molekulárisan meghatározott protonkötő helyekkel rendelkező elektródák segítségével az MIT kutatói általános modellt dolgoztak ki ezekre a határfelületi protonkapcsolt elektronátviteli reakciókra. (Kép: a kutatók jóvoltából)
Áthaladó protonok
Protonkapcsolt elektrontranszfer akkor következik be, amikor egy molekula, gyakran víz vagy sav, protont ad át egy másik molekulának vagy egy elektródfelületnek, ami arra készteti a proton akceptort, hogy szintén elektront vegyen fel. Ezt a fajta reakciót számos energetikai alkalmazáshoz hasznosították. „Ezek a protonkapcsolt elektronátviteli reakciók mindenütt jelen vannak. Gyakran kulcsfontosságú lépések a katalitikus mechanizmusokban, és különösen fontosak az energiaátalakítási folyamatokban, mint például a hidrogéntermelés vagy az üzemanyagcella-katalízis” – mondja Surendranath. A hidrogént előállító elektrolizátorban ezt a megközelítést használják a protonok vízből való eltávolítására, és elektronok hozzáadására a protonokhoz, hogy hidrogéngázt képezzenek. Az üzemanyagcellában elektromosság keletkezik, amikor a protonokat és elektronokat eltávolítják a hidrogéngázból, és oxigénhez adják, hogy vizet képezzenek. A protonkapcsolt elektrontranszfer gyakori számos más típusú kémiai reakcióban, például a szén-dioxid redukciójában (a szén-dioxid kémiai üzemanyaggá alakítása elektronok és protonok hozzáadásával). A tudósok nagyon sokat tanultak arról, hogyan mennek végbe ezek a reakciók, amikor a proton akceptorok molekulák, mivel pontosan tudják szabályozni az egyes molekulák szerkezetét, és megfigyelni, hogyan haladnak át az elektronok és a protonok közöttük. Ha azonban egy elektróda felületén protonkapcsolt elektrontranszfer megy végbe, a folyamatot sokkal nehezebb tanulmányozni, mivel az elektródák felületei általában nagyon heterogének, és sok különböző helyük van, amelyekhez a proton potenciálisan kötődhet. Ennek az akadálynak a leküzdésére az MIT csapata kifejlesztett egy módszert az elektródafelületek tervezésére, amely sokkal pontosabban szabályozza az elektródafelület összetételét. Elektródáik grafénlapokból állnak, amelyek felületéhez szerves, gyűrűt tartalmazó vegyületek kapcsolódnak. Mindegyik szerves molekula végén egy negatív töltésű oxigénion található, amely képes protonokat fogadni a környező oldatból, aminek következtében egy elektron áramlik az áramkörből a grafitos felületre. „Létrehozhatunk egy olyan elektródát, amely nem áll sokféle helyből, hanem egyetlen, nagyon jól meghatározott helyek egységes tömbje, amelyek mindegyike azonos affinitással képes megkötni a protont” – mondja Surendranath. "Mivel ezek a nagyon jól körülhatárolt helyszínek vannak, ez lehetővé tette számunkra, hogy valóban megfejtsük ezeknek a folyamatoknak a kinetikáját." Ezzel a rendszerrel a kutatók meg tudták mérni az elektromos áram áramlását az elektródákhoz, ami lehetővé tette számukra, hogy kiszámítsák a protontranszfer sebességét az oxigénionhoz a felszínen egyensúlyi állapotban – abban az állapotban, amikor a proton adományozás sebessége a felszínre. és a felszínről az oldatba való visszajuttatás egyenlő. Megállapították, hogy a környező oldat pH-ja jelentős hatással van erre az arányra: A legmagasabb értékek a pH-skála legszélső végén fordultak elő – pH 0, a legsavasabb, és pH 14, a legbázikusabb. Ezen eredmények magyarázatára a kutatók egy olyan modellt fejlesztettek ki, amely két lehetséges reakción alapul, amelyek az elektródán előfordulhatnak. 3O+), amelyek erősen savas oldatokban nagy koncentrációban vannak, protonokat juttatnak a felszínre oxigénionok, így vizet termelnek. A másodikban a víz protonokat szállít a felszíni oxigénionokhoz, hidroxidionokat (OH-), amelyek erősen bázikus oldatokban nagy koncentrációban vannak jelen. A pH 0-nál a sebesség azonban körülbelül négyszer gyorsabb, mint a 14-es pH-nál, részben azért, mert a hidronium gyorsabban adja le a protonokat, mint a víz.Egy reakció az újragondolásra
A kutatók meglepetésükre azt is felfedezték, hogy a két reakció sebessége nem azonos semleges pH 7-nél, ahol a hidrogén és a hidroxid koncentrációja egyenlő, hanem pH 10-nél, ahol a hidroxidionok koncentrációja 1 milliószorosa a hidroniuménak. A modell azt sugallja, hogy ennek az az oka, hogy a hidrogénből vagy vízből származó protonadást magában foglaló előrelépési reakció nagyobb mértékben járul hozzá a teljes sebességhez, mint a visszafelé irányuló reakció, amely magában foglalja a protonok vízzel vagy hidroxiddal történő eltávolítását. A jelenlegi modellek arra vonatkozóan, hogy ezek a reakciók hogyan játszódnak le az elektródák felületén, azt feltételezik, hogy az előre és hátrafelé irányuló reakciók egyenlő mértékben járulnak hozzá a teljes sebességhez, ezért az új eredmények azt sugallják, hogy ezeket a modelleket újra kell gondolni, mondják a kutatók. "Ez az alapértelmezett feltevés, hogy az előre és fordított reakciók egyenlő mértékben járulnak hozzá a reakciósebességhez" - mondja Surendranath. „Megtalálásunk valóban szemet nyit, mert azt a feltételezést, amelyet az emberek az üzemanyagcella-katalízistől a hidrogénfejlődésig minden elem elemzésére használnak, újra meg kell vizsgálnunk.” A kutatók most kísérleti rendszerük segítségével azt vizsgálják, hogy az elektródát körülvevő elektrolitoldathoz különböző típusú ionok hozzáadása hogyan gyorsíthatja vagy lassíthatja a protonkapcsolt elektronáramlás sebességét. „Rendszerünkkel tudjuk, hogy a telephelyeink állandóak és nem hatnak egymásra, így leolvashatjuk, hogy a megoldás változása milyen hatással van a felszíni reakcióra” – mondja Lewis.- SEO által támogatott tartalom és PR terjesztés. Erősödjön még ma.
- PlatoData.Network Vertical Generative Ai. Erősítse meg magát. Hozzáférés itt.
- PlatoAiStream. Web3 Intelligence. Felerősített tudás. Hozzáférés itt.
- PlatoESG. Carbon, CleanTech, Energia, Környezet, Nap, Hulladékgazdálkodás. Hozzáférés itt.
- PlatoHealth. Biotechnológiai és klinikai vizsgálatok intelligencia. Hozzáférés itt.
- Forrás: https://www.nanowerk.com/news2/green/newsid=64425.php
- :van
- :is
- :nem
- :ahol
- $ UP
- 1
- 10
- 11
- 13
- 14
- 16
- 7
- 8
- a
- Képes
- Rólunk
- Elfogad!
- hozzá
- hozzáadott
- hozzáadásával
- előre
- érint
- érintő
- Alexander
- megengedett
- Is
- között
- an
- elemez
- és a
- Másik
- Megjelenik
- alkalmazások
- Alkalmazása
- megközelítés
- VANNAK
- Sor
- AS
- feltételezni
- feltevés
- At
- szerző
- szerzők
- vissza
- alapján
- alapvető
- akkumulátorok
- BE
- mert
- óta
- között
- kötődik
- kötés
- de
- by
- számít
- TUD
- szén
- szén-dioxid
- okai
- sejt
- Cellák
- Központ
- változik
- Változások
- töltött
- kémiai
- kémia
- Kémikusok
- Közös
- összetétel
- koncentráció
- állandó
- kontextus
- contribuer
- hozzájárul
- ellenőrzés
- Átalakítás
- tudott
- Pár
- teremt
- kritikai
- Jelenlegi
- találka
- üzlet
- alapértelmezett
- meghatározott
- szállít
- szállít
- Design
- részlet
- fejlett
- Eszközök
- különböző
- nehéz
- felfedezett
- Sokféleség
- do
- Nem
- Ennek
- adomány
- le-
- meghajtók
- minden
- hatás
- hatékony
- elektromos
- villamos energia
- elektrolit
- elektronok
- végén
- vége
- energia
- Mérnöki
- egyenlő
- egyaránt
- Egyensúlyi
- Eter (ETH)
- minden
- evolúció
- pontosan
- példa
- létező
- kísérleti
- Magyarázza
- szélső
- gyorsabb
- megtalálása
- megállapítások
- vezetéknév
- első
- áramlási
- A
- forma
- Korábbi
- Előre
- talált
- négy
- Keretrendszer
- ból ből
- Üzemanyag
- üzemanyagcellák
- üzemanyagok
- GAS
- általános
- generált
- generáló
- generáció
- ad
- diplomás
- Grafén
- nagy
- történik
- kiaknázva
- Legyen
- Szív
- segít
- Magas
- legnagyobb
- Hogyan
- azonban
- HTTPS
- hidrogén
- kép
- fontos
- in
- Beleértve
- bele
- bevonásával
- IT
- jpg
- Karl
- Kulcs
- Kedves
- Ismer
- vezet
- tanult
- Lajos
- sok
- Lehet..
- eszközök
- intézkedés
- mechanizmusok
- Középső
- millió
- MIT
- MIT végzett
- modell
- modellek
- molekula
- több
- hatékonyabb
- a legtöbb
- mozgás
- mozgalom
- sok
- Természet
- Szükség
- negatívan
- Semleges
- Új
- Noé
- Most
- megfigyelni
- akadály
- előfordul
- történt
- of
- gyakran
- on
- or
- organikus
- Más
- mi
- ki
- felett
- átfogó
- Overcome
- Oxigén
- Papír
- rész
- különösen
- elhalad
- Emberek (People)
- Plató
- Platón adatintelligencia
- PlatoData
- lehetséges
- potenciális
- potenciálisan
- pontos
- pontosan
- folyamat
- Folyamatok
- gyárt
- Egyetemi tanár
- protonok
- Arány
- Az árak
- reakció
- reakciók
- Olvass
- tényleg
- csökkentés
- eltávolítás
- eltávolítása
- eltávolított
- Megújuló
- megújuló energia
- kutatás
- kutatók
- Eredmények
- felfedi
- fordított
- jobb
- Ryan
- s
- azonos
- azt mondják
- azt mondja,
- Skála
- Tudós
- tudósok
- Második
- idősebb
- felépítés
- jelentős
- egyetlen
- weboldal
- Webhely (ek)
- lassú
- So
- megoldások
- Megoldások
- valami
- sebesség
- Állami
- Lépés
- Lépései
- serkenti
- erősen
- struktúra
- diák
- Tanulmány
- Tanul
- ilyen
- javasol
- javasolja,
- felületi
- meglepetés
- környező
- rendszer
- Vesz
- csapat
- Technologies
- mint
- hogy
- A
- Az állam
- azok
- Őket
- Ezek
- ők
- ezt
- azok
- idő
- alkalommal
- nak nek
- Ma
- nyom
- átruházás
- transzferek
- kettő
- típus
- típusok
- mindenütt jelenlevő
- megértés
- egyetemi
- kibontani
- us
- használt
- segítségével
- rendszerint
- nagyon
- volt
- Víz
- Út..
- we
- jól definiált
- voltak
- Mit
- amikor
- ami
- széles
- val vel
- belül
- zephyrnet