16. május 2023. (Nanowerk News) Egy új tanulmány új képet ad arról, hogy a baktériumsejtek hogyan javítják folyamatosan DNS-ük hibás részeit. Megjelent a folyóiratban Sejt (“RNA Polymerase Drives Ribonucleotide Excision DNA Repair in E. coli"), a jelentés leírja a DNS-javítási útvonal mögött meghúzódó molekuláris mechanizmust, amely megakadályozza egy bizonyos típusú molekuláris építőelem, a ribonukleotidok genetikai kódokba való téves beépítését. Az ilyen hibák gyakoriak a baktériumok és más szervezetek kódmásolási folyamatában. Tekintettel arra, hogy a ribonukleotidok téves beépülése káros DNS-kód-változásokat (mutációkat) és DNS-töréseket eredményezhet, minden organizmusban kialakult egy DNS-javító útvonal, az úgynevezett ribonukleotid kivágási javítás (RER), amely gyorsan kijavítja az ilyen hibákat.
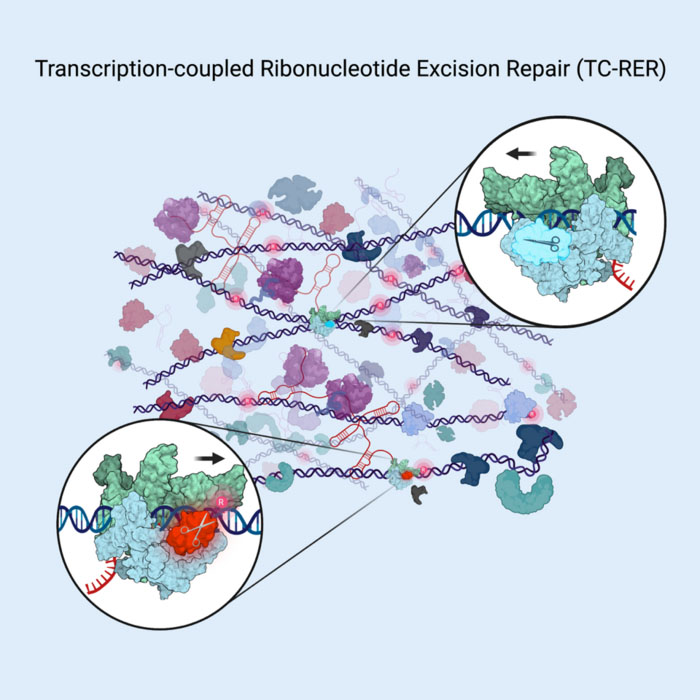 Az RNAseHII vizsgálati enzim úgy javítja a DNS-t, hogy a genetikai kódot olvasó enzimen, az RNS-polimerázon halad, és kivágja (lásd az ollót) a rosszul elhelyezett kódbetűket, amikor „meglátja” azokat a bakteriális genetikai anyagban. (© Cell Press) Tavaly egy Evgeny Nudler, PhD, Julie Wilson Anderson professzor, a NYU Langone Health Biokémiai és Molekuláris Farmakológiai Tanszékének professzora által vezetett csapat két elemzést tett közzé a DNS-javításról az életben. E. coli sejteket. Azt találták, hogy bizonyos típusú DNS-károsodások (tömeges elváltozások), például az UV-besugárzás által okozott sérülések javulása nagyrészt azért következhet be, mert a sérült kódszakaszokat először az RNS-polimeráz nevű fehérjegép azonosította. Az RNS-polimeráz lefelé halad a DNS-láncon, leolvassa a DNS „betűk” kódját, miközben utasításokat ír át RNS-molekulákra, amelyek aztán irányítják a fehérjeépítést. Nudler és munkatársai azt találták, hogy a transzkripciós folyamat során az RNS-polimeráz DNS-elváltozásokat is talál, majd platformként szolgál a DNS-javító gép összeállításához, az úgynevezett NUcleotide Excision Repair (NER) komplexhez. A NER ezután kivágja a talált hibás DNS-t, és lecseréli egy pontos másolatra. Az RNS-polimeráz hatása nélkül kevés NER fordul elő élő baktériumokban. Most a Cellben végzett új tanulmány szolgáltatja az első bizonyítékot arra, hogy a NER-útvonalhoz hasonlóan a RER is szorosan kapcsolódik a transzkripcióhoz. A tanulmány szerzői bizonyítékot találtak arra, hogy a RER-ben részt vevő kulcsenzim, az RNaseHII szintén együttműködik az RNS-polimerázzal, mivel az élő baktériumsejtek DNS-láncaiban hibásan beépült ribonukleotidokat keres. „Eredményeink továbbra is ösztönöznek bizonyos alapelvek újragondolására a DNS-javítás területén” – mondja Nudler, a Howard Hughes Medical Institute egyik kutatója. "Csapatunk azt tervezi, hogy megvizsgálja, hogy az RNS-polimeráz mindenféle probléma után vizsgálja-e a DNS-t, és nem csak a baktériumokban, hanem az emberi sejtekben is kiváltja-e a genomjavítást."
Az RNAseHII vizsgálati enzim úgy javítja a DNS-t, hogy a genetikai kódot olvasó enzimen, az RNS-polimerázon halad, és kivágja (lásd az ollót) a rosszul elhelyezett kódbetűket, amikor „meglátja” azokat a bakteriális genetikai anyagban. (© Cell Press) Tavaly egy Evgeny Nudler, PhD, Julie Wilson Anderson professzor, a NYU Langone Health Biokémiai és Molekuláris Farmakológiai Tanszékének professzora által vezetett csapat két elemzést tett közzé a DNS-javításról az életben. E. coli sejteket. Azt találták, hogy bizonyos típusú DNS-károsodások (tömeges elváltozások), például az UV-besugárzás által okozott sérülések javulása nagyrészt azért következhet be, mert a sérült kódszakaszokat először az RNS-polimeráz nevű fehérjegép azonosította. Az RNS-polimeráz lefelé halad a DNS-láncon, leolvassa a DNS „betűk” kódját, miközben utasításokat ír át RNS-molekulákra, amelyek aztán irányítják a fehérjeépítést. Nudler és munkatársai azt találták, hogy a transzkripciós folyamat során az RNS-polimeráz DNS-elváltozásokat is talál, majd platformként szolgál a DNS-javító gép összeállításához, az úgynevezett NUcleotide Excision Repair (NER) komplexhez. A NER ezután kivágja a talált hibás DNS-t, és lecseréli egy pontos másolatra. Az RNS-polimeráz hatása nélkül kevés NER fordul elő élő baktériumokban. Most a Cellben végzett új tanulmány szolgáltatja az első bizonyítékot arra, hogy a NER-útvonalhoz hasonlóan a RER is szorosan kapcsolódik a transzkripcióhoz. A tanulmány szerzői bizonyítékot találtak arra, hogy a RER-ben részt vevő kulcsenzim, az RNaseHII szintén együttműködik az RNS-polimerázzal, mivel az élő baktériumsejtek DNS-láncaiban hibásan beépült ribonukleotidokat keres. „Eredményeink továbbra is ösztönöznek bizonyos alapelvek újragondolására a DNS-javítás területén” – mondja Nudler, a Howard Hughes Medical Institute egyik kutatója. "Csapatunk azt tervezi, hogy megvizsgálja, hogy az RNS-polimeráz mindenféle probléma után vizsgálja-e a DNS-t, és nem csak a baktériumokban, hanem az emberi sejtekben is kiváltja-e a genomjavítást."
 Az RNAseHII vizsgálati enzim úgy javítja a DNS-t, hogy a genetikai kódot olvasó enzimen, az RNS-polimerázon halad, és kivágja (lásd az ollót) a rosszul elhelyezett kódbetűket, amikor „meglátja” azokat a bakteriális genetikai anyagban. (© Cell Press) Tavaly egy Evgeny Nudler, PhD, Julie Wilson Anderson professzor, a NYU Langone Health Biokémiai és Molekuláris Farmakológiai Tanszékének professzora által vezetett csapat két elemzést tett közzé a DNS-javításról az életben. E. coli sejteket. Azt találták, hogy bizonyos típusú DNS-károsodások (tömeges elváltozások), például az UV-besugárzás által okozott sérülések javulása nagyrészt azért következhet be, mert a sérült kódszakaszokat először az RNS-polimeráz nevű fehérjegép azonosította. Az RNS-polimeráz lefelé halad a DNS-láncon, leolvassa a DNS „betűk” kódját, miközben utasításokat ír át RNS-molekulákra, amelyek aztán irányítják a fehérjeépítést. Nudler és munkatársai azt találták, hogy a transzkripciós folyamat során az RNS-polimeráz DNS-elváltozásokat is talál, majd platformként szolgál a DNS-javító gép összeállításához, az úgynevezett NUcleotide Excision Repair (NER) komplexhez. A NER ezután kivágja a talált hibás DNS-t, és lecseréli egy pontos másolatra. Az RNS-polimeráz hatása nélkül kevés NER fordul elő élő baktériumokban. Most a Cellben végzett új tanulmány szolgáltatja az első bizonyítékot arra, hogy a NER-útvonalhoz hasonlóan a RER is szorosan kapcsolódik a transzkripcióhoz. A tanulmány szerzői bizonyítékot találtak arra, hogy a RER-ben részt vevő kulcsenzim, az RNaseHII szintén együttműködik az RNS-polimerázzal, mivel az élő baktériumsejtek DNS-láncaiban hibásan beépült ribonukleotidokat keres. „Eredményeink továbbra is ösztönöznek bizonyos alapelvek újragondolására a DNS-javítás területén” – mondja Nudler, a Howard Hughes Medical Institute egyik kutatója. "Csapatunk azt tervezi, hogy megvizsgálja, hogy az RNS-polimeráz mindenféle probléma után vizsgálja-e a DNS-t, és nem csak a baktériumokban, hanem az emberi sejtekben is kiváltja-e a genomjavítást."
Az RNAseHII vizsgálati enzim úgy javítja a DNS-t, hogy a genetikai kódot olvasó enzimen, az RNS-polimerázon halad, és kivágja (lásd az ollót) a rosszul elhelyezett kódbetűket, amikor „meglátja” azokat a bakteriális genetikai anyagban. (© Cell Press) Tavaly egy Evgeny Nudler, PhD, Julie Wilson Anderson professzor, a NYU Langone Health Biokémiai és Molekuláris Farmakológiai Tanszékének professzora által vezetett csapat két elemzést tett közzé a DNS-javításról az életben. E. coli sejteket. Azt találták, hogy bizonyos típusú DNS-károsodások (tömeges elváltozások), például az UV-besugárzás által okozott sérülések javulása nagyrészt azért következhet be, mert a sérült kódszakaszokat először az RNS-polimeráz nevű fehérjegép azonosította. Az RNS-polimeráz lefelé halad a DNS-láncon, leolvassa a DNS „betűk” kódját, miközben utasításokat ír át RNS-molekulákra, amelyek aztán irányítják a fehérjeépítést. Nudler és munkatársai azt találták, hogy a transzkripciós folyamat során az RNS-polimeráz DNS-elváltozásokat is talál, majd platformként szolgál a DNS-javító gép összeállításához, az úgynevezett NUcleotide Excision Repair (NER) komplexhez. A NER ezután kivágja a talált hibás DNS-t, és lecseréli egy pontos másolatra. Az RNS-polimeráz hatása nélkül kevés NER fordul elő élő baktériumokban. Most a Cellben végzett új tanulmány szolgáltatja az első bizonyítékot arra, hogy a NER-útvonalhoz hasonlóan a RER is szorosan kapcsolódik a transzkripcióhoz. A tanulmány szerzői bizonyítékot találtak arra, hogy a RER-ben részt vevő kulcsenzim, az RNaseHII szintén együttműködik az RNS-polimerázzal, mivel az élő baktériumsejtek DNS-láncaiban hibásan beépült ribonukleotidokat keres. „Eredményeink továbbra is ösztönöznek bizonyos alapelvek újragondolására a DNS-javítás területén” – mondja Nudler, a Howard Hughes Medical Institute egyik kutatója. "Csapatunk azt tervezi, hogy megvizsgálja, hogy az RNS-polimeráz mindenféle probléma után vizsgálja-e a DNS-t, és nem csak a baktériumokban, hanem az emberi sejtekben is kiváltja-e a genomjavítást."
Élvonalbeli technikák
A ribonukleotidok (az RNS építőkövei) és a dezoxiribonukleotidok (DNS-komponensek) rokon vegyületek. Miközben a sejtek DNS-láncokat másolnak és építenek fel a baktériumsejtekben, gyakran tévedésből ribonukleotidokat építenek be a DNS-láncokba a dezoxiribonukleotidok helyett, mivel ezek csak egyetlen oxigénatommal különböznek egymástól – állítják a tanulmány szerzői. A baktériumsejtekben a DNS-polimeráz III-ról ismert, hogy körülbelül 2,000 ilyen hibát követ el minden alkalommal, amikor lemásolja a sejt genetikai anyagát. A genom integritásának megőrzése érdekében a rosszul elhelyezett ribonukleotidok nagy részét a RER útvonal eltávolítja, de a kulcskérdés az volt, hogy az RNaseHII hogyan talál ilyen gyorsan viszonylag ritka ribonukleotid léziókat az érintetlen sejt-DNS-kódok „óceánjában”. A 2022-es tanulmányukhoz hasonlóan a kutatók kvantitatív tömegspektrometriával és in vivo fehérje-fehérje térhálósítással térképezték fel a kémiailag kapcsolt fehérjék közötti távolságot, és így határozták meg az RNázHII és az RNS polimeráz kulcsfontosságú felületeit, amint azok élő baktériumsejtekben kölcsönhatásba lépnek. Ily módon megállapították, hogy a legtöbb RNázHII molekula RNS polimerázzal párosul. Ezenkívül kriogén elektronmikroszkópiát (CryoEM) alkalmaztak az RNS-polimerázhoz kötött RNaseHII nagy felbontású struktúráinak rögzítésére, hogy felfedjék a RER komplexet meghatározó fehérje-fehérje kölcsönhatásokat. Továbbá a szerkezetvezérelt genetikai kísérletek, amelyek gyengítették az RNS polimeráz/RNázHII kölcsönhatást, veszélyeztették a RER-t. "Ez a munka egy olyan modellt támogat, amelyben az RNaseHII a DNS-ben letapogatja a rosszul elhelyezett ribonukleotidokat azáltal, hogy RNS polimerázt használ, miközben az a DNS mentén mozog" - mondja Zhitai Hao, az első tanulmány szerzője, Nudler laboratóriumának posztdoktori tudósa. "Ez a munka létfontosságú a DNS-javítási folyamat alapvető megértéséhez, és messzemenő klinikai következményei vannak."- SEO által támogatott tartalom és PR terjesztés. Erősödjön még ma.
- PlatoAiStream. Web3 adatintelligencia. Felerősített tudás. Hozzáférés itt.
- A jövő pénzverése – Adryenn Ashley. Hozzáférés itt.
- Részvények vásárlása és eladása PRE-IPO társaságokban a PREIPO® segítségével. Hozzáférés itt.
- Forrás: https://www.nanowerk.com/news2/biotech/newsid=63002.php
- :van
- :is
- :nem
- :ahol
- 000
- 10
- 11
- 12
- 2022
- 2023
- 7
- 9
- a
- Rólunk
- pontos
- Akció
- mellett
- Hozzáteszi
- Minden termék
- mentén
- Is
- között
- an
- és a
- bármilyen
- VANNAK
- AS
- Assembly
- At
- atom
- szerző
- szerzők
- Baktériumok
- alapvető
- mert
- óta
- mögött
- között
- Blokk
- Blocks
- köteles
- szünetek
- épít
- Épület
- de
- by
- hívott
- TUD
- elfog
- okozott
- Cellák
- Központ
- bizonyos
- lánc
- láncok
- Változások
- Klinikai
- kód
- bonyolult
- alkatrészek
- Veszélyeztetett
- folyamatosan
- folytatódik
- példányban
- számlálók
- Pár
- összekapcsolt
- kriogén
- vágás
- találka
- osztály
- eltökélt
- DID
- különbözik
- közvetlen
- dna
- le-
- alatt
- él
- csiszolókő
- hibák
- Minden
- bizonyíték
- alakult ki
- kísérletek
- messze nyúló
- hibás
- mező
- leletek
- vezetéknév
- A
- Előre
- talált
- gyakori
- további
- genom
- adott
- kellett
- Legyen
- Egészség
- nagy felbontású
- Hogyan
- HTTPS
- emberi
- azonosított
- if
- kép
- következményei
- in
- befogadás
- bele
- inspirál
- Intézet
- utasítás
- sértetlenség
- kölcsönhatásba
- kölcsönhatás
- kölcsönhatások
- bele
- vizsgálja
- részt
- IT
- folyóirat
- jpg
- Kulcs
- ismert
- labor
- keresztnév
- Tavaly
- Led
- mint
- összekapcsolt
- kis
- élő
- gép
- fenntartása
- csinál
- térkép
- Tömeg
- anyag
- mechanizmus
- orvosi
- Mikroszkópia
- Középső
- rosszul
- hibákat
- modell
- molekuláris
- a legtöbb
- Motors
- mozog
- Új
- Most
- NYU
- of
- gyakran
- on
- csak
- Más
- mi
- ki
- Oxigén
- partnerek
- kép
- Hely
- tervek
- emelvény
- Plató
- Platón adatintelligencia
- PlatoData
- nyomja meg a
- elvek
- problémák
- folyamat
- Egyetemi tanár
- Fehérje
- Fehérjék
- biztosít
- közzétett
- mennyiségi
- kérdés
- gyorsan
- radikálisan
- RITKA
- Olvasás
- összefüggő
- viszonylag
- eltávolított
- javítás
- jelentést
- kutatók
- eredményez
- Eredmények
- mutatják
- lovaglás
- RNS
- azt mondják
- azt mondja,
- szakaszok
- lát
- szolgálja
- egyetlen
- So
- tanulmányok
- Tanulmány
- ilyen
- Támogatja
- csapat
- hogy
- A
- azok
- Őket
- akkor
- Ezek
- ők
- ezt
- azok
- szorosan
- idő
- nak nek
- kettő
- típus
- típusok
- megértés
- használt
- fontos
- vivo
- Út..
- JÓL
- amikor
- vajon
- ami
- míg
- Wilson
- val vel
- nélkül
- Munka
- év
- zephyrnet