A rákos betegek térben modulált sugárnyalábokkal történő kezelése elpusztíthatja a daganatokat, miközben minimalizálja a közeli szervek és az egészséges szövetek károsodását. Ez az ötlet a proton minisugár sugárterápia (pMBRT) mögött, egy olyan feltörekvő kezelési technika, amely egy sor szubmilliméter méretű sugárnyalábot használ a terápiás dózis leadására.
A mininyalábok váltakozó nagy dózisú csúcsokat és alacsony dózisú völgyeket tartalmaznak, amely mintázat kevésbé káros az egészséges szövetekre sekély mélységben. Nagyobb mélységben ezek a nyalábok fokozatosan kiszélesednek, hogy homogén dóziseloszlást hozzanak létre a céltérfogaton belül. Kis állatokon végzett vizsgálatok kimutatták, hogy a pMBRT drámai mértékben képes csökkenti a normál szöveti toxicitást, És egyenértékű vagy jobb tumorkontroll, összehasonlítva a hagyományos protonterápiával.
"A proton-minisugár sugárterápia már a preklinikai vizsgálatok során jelentős növekedést mutatott a terápiás indexben" - mondja Ramon Ortiz ból ből Institut Curie. "Ezek az ígéretes eredmények ösztönzik ennek a technikának a klinikai területre való átültetését." Ezzel a céllal Ortiz (jelenleg az UC San Francisco-ban) és munkatársai az Institut Curie-ben értékelték a pMBRT előnyeit a rákáttétek kezelésében, és beszámoltak eredményeikről Orvosi fizika.
pMBRT forgatókönyvek szimulálása
A metasztatikus betegségek a rákkal összefüggő halálozások 90%-áért felelősek. A metasztázisokat általában sztereotaxiás sugárterápiás (SRT) technikákkal kezelik, de a helyi kontrollhoz szükséges dózist gyakran korlátozza a közeli normális szövetekre gyakorolt toxicitás kockázata. Az agyi áttétek esetében például az SRT-vel kezelt betegek felénél sugárzás által kiváltott agyi nekrózisról számoltak be.
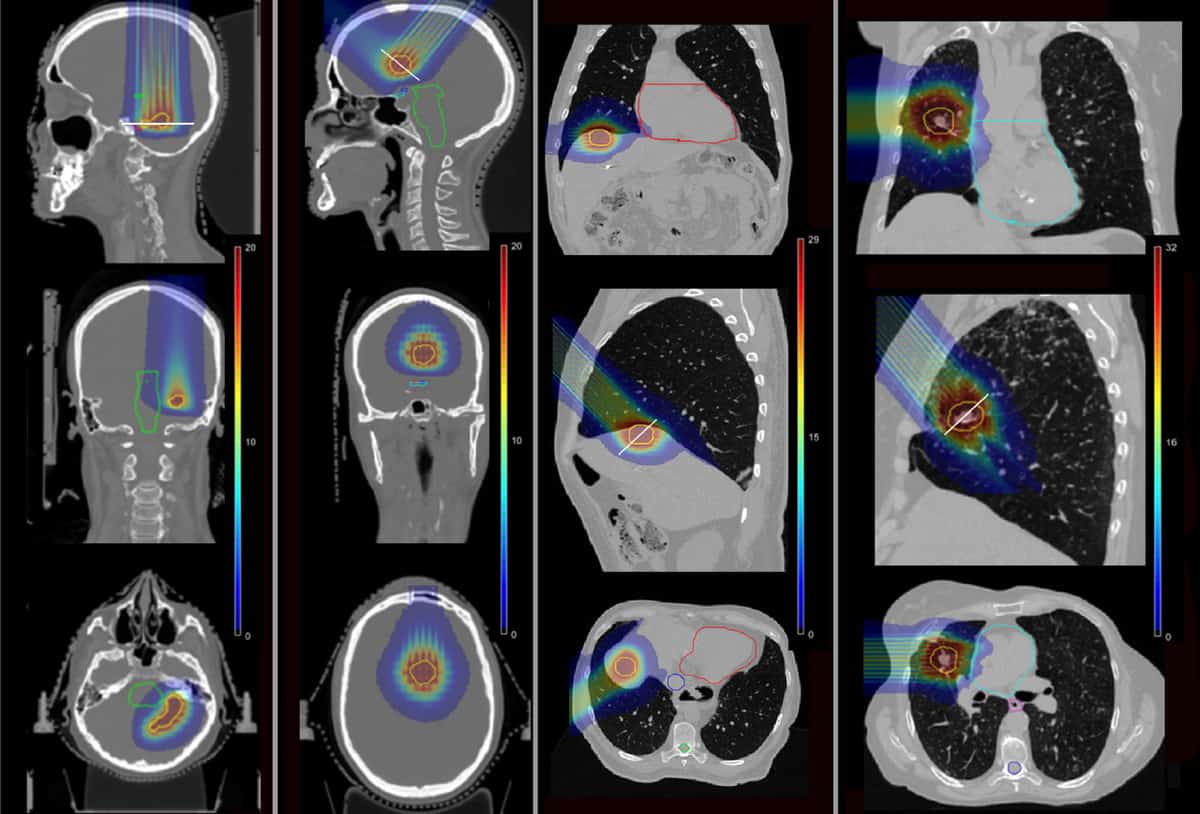
Annak megállapítására, hogy a pMBRT csökkentheti-e az ilyen szövődményeket, a csapat Monte Carlo szimulációkat használt a dóziseloszlások kiszámításához négy olyan beteg esetében, akik korábban SRT-ben részesültek az Institut Curie-ban. A betegeket áttétes elváltozásokkal kezelték az agy halántéklebenyében, homloklebenyében, a májban és a tüdőben.
A kutatók egyfrakciós pMBRT-terveket szimuláltak, egy vagy két kezelési mezőt használva, hogy ugyanazt a biológiai ekvivalens dózist (BED) juttatják el a daganat célpontjához, mint az SRT-hez előírták. Modelleztek egy sárgaréz minisugaras kollimátort, amely 400 μm × 5.6 cm-es réseket tartalmaz különböző középponti elválasztásoknál, hogy keskeny és szélesebb távolságú mininyalábokat hozzon létre. Ezután kiszámították a négy betegeset dóziseloszlását, a pMBRT, az SRT és a hagyományos protonterápia esetében.
A szűk térközű pMBRT tervekben, amelyek egyenletes dóziseloszlást hoznak létre a céltérfogatban, a tumorlefedettség hasonló volt, vagy valamivel jobb volt, mint az SRT tervekben. A szélesebb távolságú pMBRT nyalábokat használó tervek, amelyek kvázi egyenletes dóziseloszlást biztosítanak a célpontnak, alacsonyabb tumorlefedettséggel rendelkeztek.
Fontos, hogy a pMBRT jelentősen csökkentette a kritikus struktúrák dózisát az SRT-hez képest. Az első agyi esetben a pMBRT 44%-kal (jobb akusztikus ideg) és 100%-kal (bal akusztikus ideg) csökkentette az átlagos BED-t a veszélyeztetett szervekhez (OAR). A második agyi kezelés során a pMBRT teljesen megkímélte az OAR-okat, beleértve a látótraktust, az agytörzset és a chiasmát.
A máj esetében a máj és a bordák átlagos BED értéke 25%-kal, illetve 75%-kal csökkent, miközben elkerülték a felső vena cava besugárzását. A tüdő esetében pedig az OAR-ek adagja 11%-kal (bordák) és 100%-kal (tüdőartéria és hörgők) csökkent. A pMBRT és a hagyományos protonterápia között az átlagos BED az OAR-okhoz képest többnyire hasonló volt.
A kutatók a pMBRT lehetséges káros hatásait is vizsgálták a normál szövetekre. A két agyi metasztázis esetében például kiszámították az egészséges agyszövetbe juttatott dózist. Figyelembe vették a standard frakcionált besugárzás dózishatárait, amelyben a normalizált összdózis 2 Gy-frakciónál (NTD)2.0) 72 Gy 5%-os valószínűséggel XNUMX éven belül radionekrózist okoz.
Minden pMBRT-terv esetén a maximális völgy NTD2.0 az egészséges agyba (61 Gy(RBE) a temporális lebeny esetében és 47 Gy(RBE) a frontális lebeny esetében) e dózistolerancia-küszöb alatt maradt, ellentétben a hagyományos protonterápiával. A tüdő- és májmetasztázisban szenvedő betegeknél a tüdő- és májszövetek átlagos dózisai a pMBRT-tervekben szintén jóval a maximálisan tolerálható átlagos dózis alatt voltak.
Klinikai előnyök
A tanulmányban figyelembe vett pMBRT-kezeléseket csak egy vagy két minisugár-tömb segítségével adták le. Az SRT kezelésekhez képest kevesebb mező (három vagy négy ív) alkalmazása kevesebb betegpozíciót igényel, csökkentve a frakciókezelési időt, valamint csökkenti a kis dózisoknak kitett normál szövetek térfogatát. Ezenkívül a pMBRT egy kezelési frakcióban történő bejuttatása jelentősen csökkenti a teljes kezelési időt az SRT tervekhez képest, amelyek három-öt frakciót használtak.

Minisugár sugárterápia: a fotonoktól a töltött részecskékig
A kutatók rámutatnak arra, hogy az ebben a munkában értékelt pMBRT-tervek klinikailag megvalósíthatók az Orsay Protonterápiás Központban a preklinikai vizsgálatok során már bevezetett felépítéssel, a cél- és szervmozgások a kezelés során ellenőrzött módon, mint az SRT és a protonterápia esetében.
Ortiz elmondja Fizika Világa hogy az Institut Curie most az I/II. fázisú klinikai vizsgálatok lehetőségéről tárgyal. „Ezek értékelnék a neurotoxicitást és a tumorkontroll arányát a visszatérő glioblastoma multiforme proton-minisugárral történő kezelésében” – magyarázza. "E tanulmány célja, hogy hozzájáruljon ezeknek a klinikai vizsgálatoknak az előkészítéséhez."
- SEO által támogatott tartalom és PR terjesztés. Erősödjön még ma.
- Platoblockchain. Web3 metaverzum intelligencia. Felerősített tudás. Hozzáférés itt.
- Forrás: https://physicsworld.com/a/proton-minibeams-could-improve-treatment-of-cancer-metastases/
- 10
- a
- Fiókok
- mellett
- kedvezőtlen
- célok
- Minden termék
- már
- és a
- állatok
- Sor
- elkerülve
- mögött
- lent
- Előnyök
- Jobb
- között
- Agy
- sárgaréz
- Rák
- eset
- esetek
- Központ
- töltött
- Klinikai
- klinikai vizsgálatok
- munkatársai
- Oszlopok
- általában
- képest
- teljesen
- Kiszámít
- figyelembe vett
- kontraszt
- contribuer
- ellenőrzés
- vezérelt
- hagyományos
- tudott
- lefedettség
- teremt
- kritikai
- halálesetek
- szállít
- szállított
- átadó
- mélységben
- elpusztítani
- Határozzuk meg
- megbeszélése
- betegség
- terjesztés
- disztribúció
- domain
- drámaian
- alatt
- hatások
- csiszolókő
- ösztönzése
- Egyenértékű
- értékelni
- értékelték
- példa
- Elmagyarázza
- kitett
- Fields
- vezetéknév
- töredék
- Francisco
- ból ből
- Nyereség
- fokozatosan
- nagyobb
- fél
- káros
- egészséges
- HTTPS
- ötlet
- kép
- végre
- javul
- in
- Más
- Beleértve
- index
- információ
- Laboratóriumi vizsgálatok eredményei
- kérdés
- csak egy
- vezetékek
- Korlátozott
- határértékek
- Máj
- helyi
- Elő/Utó
- max-width
- maximális
- minimalizálása
- mozgás
- Természet
- normális
- ONE
- nyitva
- Más
- vázolt
- beteg
- betegek
- Mintás
- fázis
- Fotonok
- tervezés
- tervek
- Plató
- Platón adatintelligencia
- PlatoData
- pont
- lehetőség
- lehetséges
- korábban
- valószínűség
- biztató
- Sugárzás
- Sugárkezelés
- Az árak
- kapott
- csökkenteni
- Csökkent
- csökkenti
- csökkentő
- maradt
- figyelemre méltó
- Számolt
- kötelező
- megköveteli,
- kutatók
- illetőleg
- Eredmények
- Kockázat
- azonos
- San
- San Francisco
- azt mondja,
- Második
- sekély
- mutatott
- jelentősen
- hasonló
- kicsi
- standard
- tanulmányok
- Tanulmány
- ilyen
- felettes
- cél
- csapat
- technikák
- megmondja
- A
- azok
- Gyógyászati
- terápia
- három
- küszöb
- miniatűr
- idő
- szövetek
- nak nek
- tolerancia
- Végösszeg
- Fordítás
- kezelésére
- kezelés
- vizsgálatok
- igaz
- használ
- Völgy
- különféle
- kötet
- kötetek
- vajon
- ami
- míg
- WHO
- belül
- Munka
- lenne
- év
- zephyrnet