Anyagelőkészítés és jellemzés
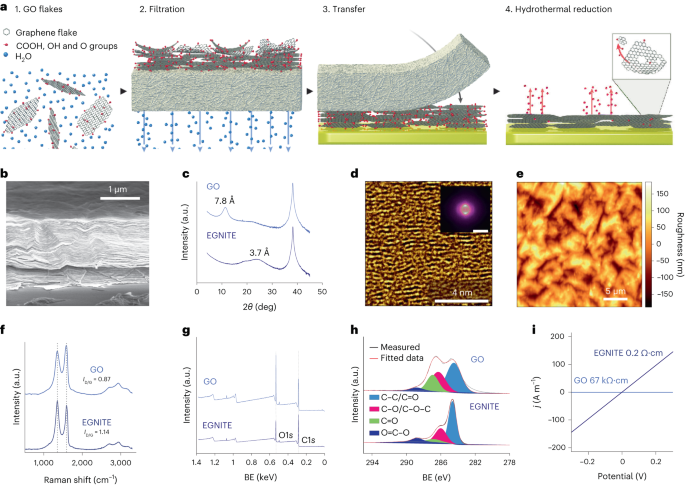
A vizes GO-oldatot ionmentesített vízzel hígítottuk, hogy 0.15 mg-os oldatot kapjunk.-1 0.025 µm pórusméretű nitrocellulóz membránon vákuumban szűrjük, vékony GO filmet képezve. A vékony filmet ezután a megcélzott szubsztrátumra vittük át nedves átvitellel ionmentesített vízben, majd további hőkezeléssel 100 °C-on 2 percig. A GO film-szubsztrát köteget hidrotermikusan redukáltuk 134 °C-on egy szabványos autoklávban 3 órán keresztül, hogy EGNITE-et kapjunk. Az EGNITE összes jellemzési vizsgálatának alapszubsztrátja egy négyzet (1 × 1 cm2) Si/SiO2 (400 μm/1 μm).
XPS
Az XPS méréseket Phoibos 150 analizátorral (SPECS) végeztük ultramagas vákuum körülmények között (alapnyomás, 5 × 10).-10 mbar) monokromatikus Al Kα röntgenforrással (1,486.74 eV). Az áttekintő spektrumokat 50 eV áteresztő energiával és 1 eV lépésmérettel, a nagyfelbontású spektrumokat pedig 20 eV áteresztő energiával és 0.05 eV lépésmérettel vettük fel. A teljes felbontás az utolsó körülmények között 0.58 eV, amelyet úgy határoztak meg, hogy a teljes szélességet az Ag 3 maximum felénél mértük.d5/2 csúcs porlasztott ezüst. Az XPS analízis erős csökkenést mutat a C–O csúcs hidrotermális kezelése után (az epoxidcsoportokhoz kapcsolódóan), de a C–OH, C=O és C(O)OH kismértékű hozzájárulását a hidroxil-, karbonil- és karboxilcsoportok miatt. csökkentése után is megmarad. Az O1 dekonvolúciójas csúcs megerősíti az ilyen viselkedést. A fő hozzájárulás a C1s jel azonban a hidrotermális redukció után származik sp2 hibridizált C–C pályák34,57.
röntgendiffrakció
Röntgen diffrakciós mérések (θ-2θ szkennelés) Materials Research Diffractometer (Malvern PANalytical) segítségével végeztük. Ez a diffraktométer vízszintes ω-2θ goniométer (320 mm sugarú) négykörös geometriában, és Cu Kα anódos kerámia röntgencsővel dolgozott (λ = 1.540598 Å). Az alkalmazott detektor egy Pixcel, amely egy Medipix2 technológián alapuló gyors röntgendetektor.
Raman spektroszkópia
A Raman-spektroszkópiás méréseket 488 nm-es lézergerjesztő vonallal felszerelt Witec spektrográf segítségével végeztük. A mérésekhez a Raman-spektrumokat 50×-es objektívvel és 600 barázda/nm-es ráccsal vettük fel; A lézer teljesítményét 1.5 mW alatt tartottuk a minta melegítésének elkerülése érdekében.
TEM
Az EGNITE minta keresztmetszeti vizsgálatához Helios NanoLab DualBeam (LMA-INA) készülékkel fókuszált ionnyaláb lamellát készítettem. A szerkezeti elemzéseket TEM segítségével, 20 kV-on működő Tecnai F200 mikroszkóppal végeztük, beleértve a HRTEM és a nagy szögű gyűrűs sötét mező STEM technikákat. A STEM-EELS kísérletet 20 KeV-on működő Tecnai F200 mikroszkóppal végeztük, 5 mm rekesznyílással, 30 mm kamerahosszal, 12.7 mrad konvergenciaszöggel és 87.6 mrad gyűjtési szöggel. Mivel pixelenként 0.5 eV-ot és 250 eV-ot használtunk kiindulási energiaként a magveszteség felvételénél, nem kaptuk meg az 1,839 eV-nál várt Si K-élt, 2,122 eV-nál a Pt M-élt és az Au M-élt 2,206 eV. A relatív C–O atomi összetételt úgy kaptuk meg, hogy figyelmünket a redukált GO rétegre összpontosítjuk, és feltételezzük, hogy az elemzett élek (esetünkben C és O) összege 100%. Ez a feltevés esetünkben érvényes, amint azt a Kiegészítő információk térképek. Az energiakülönbség keresztmetszetét a Hartree–Slater modellel, a hátteret pedig alacsony teljesítményű modellel számítottuk ki.
Elektromos vezetőképesség
Az elektromos vezetőképesség méréseket Keithley 2400 forrásmérővel végeztük kétpontos konfigurációban. A mért minták 1 × 1 cm-es EGNITE filmekből álltak2 egy SiO tetején2 szubsztrát.
Az adatok elemzése
A röntgendiffrakciós, Raman és XPS adatokat Python 3.7 csomagok (Numpy, Pandas, Scipy, Xrdtools, Lmfit, Rampy, Peakutils, Matplotlib) segítségével elemeztük. A síkok közötti távolságot a röntgendiffrakciós mérésekből számítottuk ki a Snell-törvény szerint. Miután az adatokat áthelyeztük a térbeli tartományba, a csúcsok maximumát illesztettük. A megfelelő távolság megadta a síkok közötti távolság középértékét. Az ezektől az átlagértékektől való eltéréseket a térbeli csúcsok Lorentzi-illesztéseinek teljes szélességéből számítottuk. Az XPS- és Raman-spektroszkópiás méréseket úgy elemeztük, hogy a csúcsok konvolúcióját illesztettük a megfelelő jellemzők várható helyére. A GO és az EGNITE vezetőképességi értékeit a I-V az elektromos vezetőképesség-mérések során mért görbék Ohm törvényének megfelelően. Az adatok n = 1 minden méréshez.
Rugalmas tömb gyártás
Az eszközök gyártása a kiegészítő ábrán látható. 4. Az eszközöket 4 hüvelykes Si/SiO-n gyártották2 (400 μm/1 μm) ostya. Először egy 10 µm vastag PI (PI-2611, HD MicroSystems) réteget centrifugáltunk az ostyára, és nitrogénben gazdag atmoszférában 350 °C-on 30 percig sütjük. A fémnyomokat a képfordító fotoreziszt (AZ5214, Microchemicals) optikai litográfiájával mintáztuk meg. Elektronsugaras bepárlással 20 nm-es titánt és 200 nm aranyat raktak le, majd a kiemelkedést végrehajtották. Az elektrokémiai teljesítmény és a tömb rugalmassága közötti kompromisszumként körülbelül 1 μm vastagságú EGNITE fóliát használtunk. A GO film átvitele után az alumíniumot e-sugárral elpárologtattuk, és negatív fotoreziszt (nLOF 2070, Microchemicals) segítségével meghatároztuk a jövőbeli mikroelektródák tetején lévő területeket, majd kiemeltük. Ezután a GO filmet a jövőbeni mikroelektródákon kívül mindenhol lemarattuk oxigénreaktív ion maratással (RIE) 5 percen keresztül 500 W-on, és a védő alumínium oszlopokat foszforsav és salétromsav hígított oldatával marattuk. Ezután egy 3 µm vastag PI-2611 réteget helyeztünk az ostyára, és a korábban leírtak szerint megsütöttük. Ezután a mikroelektródán lévő PI-2611 nyílásokat pozitív vastag fotoreziszttel (AZ9260, Microchemicals) határoztuk meg, amely maszkként működött a következő oxigén RIE számára. Később az eszközöket a PI rétegre mintázták, ismét AZ9260 fotoreziszt és RIE segítségével. A fotoreziszt réteget ezután acetonban eltávolítjuk, és az ostyát izopropil-alkoholban megtisztítjuk és kiszárítjuk. Végül az eszközöket leválasztották az ostyáról, és készen álltak sterilizáló tasakokba helyezni, hogy 134 °C-on hidrotermikusan kezeljék őket egy szabványos autoklávban 3 órán keresztül.
Mikroelektródák elektrokémiai jellemzése
A mikroelektródák elektrokémiai jellemzését Metrohm Autolab PGSTAT128N potenciosztáttal végeztük 1×PBS-ben (Sigma-Aldrich, P4417), amely 10 mM foszfátpuffert, 137 mM NaCl-t és 2.7 mM a7.4.c45093-konfigurációt tartalmazott. Referenciaként Ag/AgCl elektródát (FlexRef, WPI), ellenelektródaként platinahuzalt (Alfa Aesar, XNUMX) használtunk.
A teljesítmény értékelése előtt az elektródákat 10,000 1 töltéskiegyenlített impulzussal (15 ms, 100 µA) impulzáltak. Az elektródák folyamatos pulzálási protokolloknak való kitétele 0.9 ciklikus voltammetriás ciklussal (-0.8-+50 V) történt XNUMX mV s-on-1, 20 impulzus (5,000 ms) 1 ismétlése és a nyitott áramköri potenciál újra meghatározása.
Az adatok elemzése
Az elektrokémiai jellemzési adatokat Python 3.7 csomagokkal (Numpy, Pandas, Scipy, Pyeis, Lmfit, Matplotlib) elemeztük. Az impedancia spektroszkópiai adatokat egy egyenértékű elektromos modellre illesztettük, amely egy ellenállásból (R) egy állandó fázisú elemmel (CPE) sorba kapcsolva. Innentől kezdve a CPE értéket egy kapacitásra közelítettük, és elosztottuk a mikroelektróda geometriai területével, hogy egyenértékű értéket kapjunk az EGNITE határfelületi kapacitására. A mikroelektródák töltéstároló kapacitását (CSC) ciklikus voltammetriás mérésekből számítottuk ki a mért áram katódos és anódos rezsimjének integrálásával és a pásztázási sebességgel történő normalizálással. A katódos és anódos töltéstároló kapacitás (cCSC és aCSC) az EGNITE 100 mV-os pásztázási sebességénél 45.9 ± 2.4 és 34.6 ± 2.8 mC cm-2, illetve (n = 3). Amint azt más anyagoknál közöltük58, a kapott CSC-k a szkennelési sebességtől függenek (kiegészítő ábra. 5). Az oxigénredukciós reakciók jelenlétének felmérésére megmértük a CV hullámformát nitrogénnel öblített elektrolit alatt.59 és nem figyeltek meg lényeges különbségeket a hullámformában (kiegészítő ábra). 6). Eredményeink azonban nem foglalkoznak teljes mértékben az oxigénredukciós reakciók hatásával az EGNITE töltésinjektálási kapacitásában, és további munkát kell végezni ennek megfelelő vizsgálatára. A mikroelektróda töltésinjektálási kapacitását (CIC) úgy határoztuk meg, hogy meghatároztuk az áramimpulzus amplitúdóját, amely feszültségkülönbséget váltott ki (az ohmos csepp eltávolítása után), amely megfelelt az elektród elektrokémiai vízablakának (-0.9 V katódos és +0.8 V anódos versus Ag/AgCl ) (Kiegészítő ábra. 17)60.
Statisztikai analízis
Az adatok átlag ± s.d., n = 18 az EIS és n = 3 a kronopotenciometriákhoz. A katódos kapacitív feszültségkiugró térkép adatai a katódos katódfeszültség kiugró értékek átlagai egy eseményre, minden impulzusalaknál. n = 3 elektróda.
Mechanikai stabilitás értékelése
Ultrahangos ultrahangos kezelés
Az EGNITE elektródasorokat vízzel töltött főzőpohárba helyeztük ultrahangos vízfürdőben (Elmasonic P 180H). Az ultrahangos kezelést 37 kHz-en, 15 percig 200 W-on végeztük, majd további 15 percnyi ultrahangos kezelést 37 kHz-en 300 W-ra emelt teljesítmény mellett.
Hajlítási teszt
A hajlítási beállítás (ábra. 2k) három hengeres rúdból állt; a középsőt (átmérő, 700 µm) leeresztettük, 131°-os hajlítási szöget produkálva. A hajlítási teszthez három rugalmas mikroelektróda tömböt használtunk. Mindegyik tömb 18 50 µm átmérőjű mikroelektródát tartalmazott. Két tömböt 10 és 20 ciklus után mértünk, míg egy eszközt csak 10 cikluson keresztül mértünk, mivel a mérés utáni kezelés során megsérült. A hajlítási tesztciklus 10 s hosszú terhelésből és 10 s terhelés nélküli alkalmazásból állt. Az eszközöket elektrokémiailag jellemeztük (EIS és CV) 10 és 20 hajlítási ciklus előtt és után.
Epikortikus idegi felvétel
Epikortikus beültetés
Minden kísérleti eljárást az Európai Közösség Tanácsának ajánlásaival és a laboratóriumi állatok gondozására és felhasználására vonatkozó francia jogszabályokkal összhangban végeztek. A protokollokat a grenoble-i etikai bizottság (ComEth) hagyta jóvá, és a francia minisztérium engedélyezte (04815.02 szám). Sprague–Dawley patkányok (hím, 4 hónaposak, súlyuk ~600 g) ketaminnal (50 mg/kg (testtömeg)) és xilazinnal (10 mg/kg (testtömeg)) intramuszkulárisan érzéstelenítettük, majd sztereotaxiás tartóra rögzítettük. A halántékkoponya eltávolításakor szabaddá vált a hallókéreg. A Dura mater-t megőrizték, hogy elkerüljék a kérgi szövet károsodását. A csúcson egy lyukat fúrtak a referenciaelektróda behelyezéséhez, és egy második lyukat fúrtak, 7 mm-re az elsőtől előre, a földelő elektróda behelyezéséhez. Az elektródák 0.5 mm vastag tűk voltak, amelyeket integrált áramköri aljzatokhoz használtak. Úgy helyezték el őket, hogy elektromosan érintkezzenek a dura materrel, és fogászati cementtel rögzítették a koponyához. Ezután a felületi mikroelektróda szalagot a hallókéregre szereltük, amint az ábra mutatja. 3b. A vénaminták azonosítják a hallókérget, Krieg patkányagytérképének 41. területén. A kérgi jeleket egyidejűleg erősítették fel 1,000-es erősítéssel, és 33 kHz-es mintavételi frekvenciával digitalizálták. A patkány füle előtt 20 cm-rel, a szabaddá vált kéreggel ellenoldali hangszóró akusztikus ingereket adott. A kiadott ingereket egy 0.25 hüvelykes mikrofonnal (Brüel & Kjaer, 4939) figyeltük, amelyet a fül közelében helyeztek el, és hangnyomásszinten mutatták be (dB SPL re 20 μPa). Megvizsgáljuk a vertex-pozitív (negatív felfelé irányuló) középső késleltetési válaszokat váltakozó kattanások által kiváltott 80 dB SPL-nél, és hangkitörési ingereket 70 dB SPL-nél 5-40 kHz frekvenciájú, 5-200 kHz-es emelkedési és süllyedési idővel. XNUMX ms időtartamú.
Az adatok elemzése
Az elektrofiziológiai adatokat Python 3.7 csomagokkal (Numpy, Pandas, Scipy, Neo, Elephant, Sklearn Matplotlib) és a PhyREC egyéni könyvtárral elemeztük.https://github.com/aguimera/PhyREC). R.m.s. az értékeket 20 ms-os csúszó ablakkal számítottuk ki 200 Hz feletti frekvenciákon. A spektrogramokat 70 Hz és 1.1 kHz közötti tartományra számítottuk. A PSD-t a folyamatos felvételek 60 másodpercére számolták. Egy adott elektródasorra két PSD-t számítottunk: in vivo (IV) és post mortem (PM). Az SNR-t dB-ben fejezzük ki (20 × ln(r.m.s.(IV)/r.m.s.(PM))), és 20 pontra interpoláljuk, logaritmikusan 10 Hz és 1 kHz között.
Statisztikai analízis
ábrán látható epikortikus neurális adatok. 3 egyetlen állaton végzett egyedi mérésekből veszik. ábrán. 3c64 elektróda adatait mutatjuk be. ábrán. 3d, két kiválasztott elektróda adatai jelennek meg. ábrán. 3f, a PSD-t és az SNR-t 64 EGNITE elektródából számítják ki, és átlag ± s.d. A kiegészítő ábrán. 12c, d A medián adatokat 192 EGNITE elektródára mutatjuk be n = 3 kísérlet és 60 platinaelektróda innen n = 1 kísérlet.
Intrakortikális idegi felvétel
Intrakortikális beültetés
Az állatokat ketamin/xilazin (75:1, 0.35 ml/28 g i.p.) keverékével érzéstelenítettük, és ezt az állapotot 1.5% izofluránt tartalmazó inhalációs maszkkal tartottuk fenn. Számos mikrocsavart helyeztek a koponyába az implantátum stabilizálása érdekében, és a kisagy tetején lévőt általános talajként használták. A szondát a prefrontális kéregbe ültettük be (koordináták: AP, 1.5 mm; ML, ±0.5 mm; DV, -1.7 mm a bregmától). A beültetést úgy végeztük, hogy a szondát maltózzal vonták be (lásd az alábbi protokollt), hogy átmeneti merevséget biztosítsanak és megkönnyítsék a szonda behelyezését. A szondát fogászati cementtel zárták le. A szondát TDT-ZifClip csatlakozókkal csatlakoztatták az elektrofiziológiai rendszerhez miniatűr kábelen keresztül. A műtét után az egér 1 hetes gyógyulási perióduson esett át fájdalomcsillapító (buprenorfin) és gyulladáscsökkentő (meloxicam) kezelésben. Az idegi aktivitást a többcsatornás Open Ephys rendszerrel rögzítették 30 kHz-es mintavételezési frekvenciával, Intan RHD2132 erősítővel. Az auditív feladatkísérletek hangszigetelt dobozban történtek, benne két hangszóróval, a korábban leírt munkán alapuló protokollok segítségével.61. A hanginger egy 15 ms hosszú fehér zajos kattanásból állt, amelyet 100-szor ismételtek (ciklusok), és mindegyiket 5 másodperc választja el (interstimulus intervallum). A feladat során az állat szabadon mozoghatott.
Maltóz merevítő protokoll
A maltóz vizes oldatát üvegesedési pontig melegítik (Tg), 130 és 160°C között, főzőlappal vagy mikrohullámú sütővel. Miután a maláta viszkózus, a szonda hátoldala csak a malátacukorral érintkezik. Ahogy a maltóz lehűl, megmerevíti és megmerevíti a szondát.
Az adatok elemzése
Az egyes elektródák neurális jeleit offline szűrtük, hogy kivonjuk a SUA-t és az LFP-ket. A SUA-t a jel 450 és 6,000 Hz közötti szűrésével becsülték meg, és az egyes neuronokból származó tüskéket az Offline Sorter v.4 (Plexon) főkomponens-analízisével rendezték. Az LFP-k megszerzéséhez a jeleket 1 kHz-re mintavételeztük, trendmentesítettük és bevágásokkal szűrtük, hogy eltávolítsuk a zajvonal műtermékeket (50 Hz és harmonikusai) egyedileg megírt Python szkriptekkel. Az AEP SNR-t a csúcs N1 amplitúdója és az s.d. 20 ms-os periódusban az ingerlés előtt.
Statisztikai analízis
ábrán látható adatok. 3 óra, i átlag ± s.d., n = 30, mint az átlagolt kísérletek száma. Ugyanarról az elektródáról felvett adatokat a 30., 60. és 90. napon mutatjuk be. Egyetlen állat adatait mutatjuk be.
Krónikus epikortikális biokompatibilitás
Eszközök sebészeti beültetése
Összesen 27 felnőtt, hím Sprague–Dawley patkányt használtak ehhez a vizsgálathoz (Charles River). Az állatokat 21 ± 2 °C környezeti hőmérsékleten és 40-50% páratartalom mellett tartottuk, 12 órás világos/12 órás sötét ciklusban. A patkányokat csoportokban tartottuk, és szabad hozzáférést kaptak a táplálékhoz és a vízhez a kísérleti időszak alatt. A kísérleti eljárásokat az Animal Welfare Act (1998) szerint hajtották végre, az Egyesült Királyság Belügyminisztériuma és a helyi állatjóléti etikai felülvizsgálati testület (AWERB) jóváhagyásával. Az állatokat a műtét idejére izofluránnal (2-3%) altattuk, az érzéstelenítés mélységét a lábujjcsípés reflex teszttel követtük. Az állatokat egy sztereotaxiás keretbe (Kopf, 900LS) helyeztük, amely egy hőtakaró felett helyezkedett el a testhőmérséklet fenntartása érdekében. Egy koponyatómiás lyuk (~5 mm ×4 mm) 1 mm-re a középvonaltól 0.9 mm-es sorjafúróval ellátott fogászati fúróval készült, a durát eltávolítottuk, és az epikortikális eszközt az agy kérgi felületére helyeztük. A koponyavágási lyukat Kwik-sil-lel lezárták, majd a rögzítéshez fogászati cementet használtak, és a bőrt összevarrták. Sóoldat (1 ml/testtömeg-kg) és buprenorfin (0.03 mg/ttkg) szubkután injekciókat adtak az elvesztett folyadékpótlás és a posztoperatív fájdalom csökkentésére, az érzéstelenítést pedig visszavonták.
A szövetek gyűjtése és feldolgozása
Az állatokat a beültetés után 2, 6 vagy 12 héttel leállítottuk az elvégzendő elemzés típusának megfelelő módszerrel.
Szövettan és immunhisztokémia
2., 6. vagy 12. héttel a beültetés után a patkányokat heparinizált (10 U ml) szívperfúzióval fejeztük be.-1, Sigma-Aldrich) PBS, majd 4% paraformaldehid (PFA, Sigma-Aldrich) PBS-ben. Az agyakat 4 órán át utófixáltuk 24%-os PFA-ban, majd 30%-os PBS-ben lévő szacharózba vittük át legalább 48 órára, mielőtt izopentánban fagyasztották volna. Az agyakat ezután –80 °C-on tároltuk a 25 µm-es kriometszésig. A szövetet ezután ionizált kalciumkötő adaptermolekulára (Iba-1) festettük, hogy meghatározzuk a mikroglia aktiváció szintjét. Röviden, a szövetmetszeteket PBS-ben, 1% Triton-X-et tartalmazó 5% kecskeszérummal blokkoltuk 0.1 órán át, majd egy éjszakán át 1 °C-on inkubáltuk az anti-Iba-4 primer antitesttel (1:1, 1,000-019; Wako). A metszeteket ezután másodlagos antitesttel, anti-nyúl Alexa Fluor 19741-gyel (594:1, A-400; Thermo Fisher) festettük szobahőmérsékleten 11012 órán át. A tárgylemezeket fedőlemezekkel szerelték fel 1-diamidino-4,6-fenil-indollal (Thermo Fisher) tartalmazó Prolong Gold fakulásgátló rögzítőanyaggal. A szonda 2 ×3 mm-es területet fed le2 az agy kérgi felületén; a festésre kiválasztott szövetmetszetek 3.2 mm hosszúságúak ezen a területen. A tárgylemezeket 3DHistech Pannoramic-250 mikroszkópos tárgylemezszkennerrel készítettük 20×-os képfelvétellel, és a képeket CaseViewer v.2.4 (3DHistech) segítségével elemeztük. A mikroglia aktiváció meghatározásához egy 3.2 mm-es területet lefedtünk, és 100 µm-enként egy képet elemeztünk. A képeket 8.5-szeres nagyítással készítettük, amelyek az epikortikális szonda helyének egy részét részletezték, 3 mm-re az agy középvonalától, és a közvetlenül a szonda helye alatti területet felölelik.
Képfeldolgozás
A mikroszkópos adatokat a mikroglia fenotípus jellemzésére szolgáló algoritmus segítségével képfeldolgozással dolgozták fel (kiegészítő ábra). 13). A mikroglia aktiválását egy egyedi CellProfiler* (Broad Institute, v.3.1.9 from https://cellprofiler.org/) csővezeték. Először is, az EnhanceOrSuppressFeatures modult használták a fonalas struktúrák, például a neuritok javítására a tubusnövelő módszer alkalmazásával. A továbbfejlesztett képekből a cellákat az IdentifyPrimaryObjects modul segítségével szegmentáltuk. A sejtek előzetes mérései arra utaltak, hogy a megfelelő tárgyátmérő tartomány 3-40 pixel volt. Az ezen az átmérőtartományon kívül eső vagy a kép szélét érintő tárgyakat eldobtuk. A sejteket kétosztályos Otsu adaptív küszöbstratégiával szegmentáltuk, 50 pixel adaptív ablakmérettel. Az IdentifyPrimaryObjects modul által azonosított objektumok a MeasureObjectSizeShape modulba kerültek a cellaosztályozáshoz szükséges tulajdonságok kiszámításához. A ClassifyObjects modulban az osztályozás alapjául szolgáló kategória az AreaShape volt, és az Extent lett kiválasztva megfelelő mérésként. A sejteket a következőképpen osztályozták "aktivált” vagy „nem aktivált” az Extent tulajdonságuk alapján, amely a cella által elfoglalt terület és a határolókeret által elfoglalt terület aránya. Ezt az osztályozási megközelítést racionalizálta az a tény, hogy az aktivált mikrogliák nagy sejttesttel rendelkeznek, és nincsenek folyamatok, és így sokkal nagyobb arányt foglalnak el határoló dobozaikban, mint nem aktivált társaik. Végül a CalculateMath és az ExportToSpreadsheet modulokat használták a kívánt statisztikák kiszámításához és kiadásához.
Statisztikai analízis
Az adatkészletek n = 3 minden eszköztípusra (csak PI-implantátum (PI); PI mikrogyártott arannyal (arany); és PI mikrogyártott arannyal és EGNITE-tel (EGNITE) minden időpontban), kivéve a 6 hetes aranyat, amely n = 2 ELISA adatok esetén. Az ellenoldali féltekéket minden időpontban kombináltuk, hogy megadjuk n = 9 2 és 12 héttel az implantáció után és n = 8 6 héttel a beültetés után. Az adatok elemzése a GraphPad Prism v.8 szoftverrel történt. A statisztikai elemzést kétirányú varianciaanalízissel (ANOVA) végeztük el, adott esetben Tukey többszörös összehasonlítás tesztjével; P < 0.05 volt szignifikáns.
ELISA
A beültetési időszakot követően az állatokat nyaki diszlokációval fejeztük be. Az agyszövetet mind a jobb, mind a bal agyféltekéből kinyertük, folyékony nitrogénben lefagyasztottuk, és –80 °C-on tároltuk a további felhasználásig. A szövetet NP-40 lízispufferrel lizáltuk (150 mM NaCl, 50 mM Tris-Cl, 1% Nonidet P40 helyettesítő, Fluka, pH 7.4-re beállítva), amely proteázt és foszfatáz inhibitort (Halt Protease Inhibitioner, Fishermocktailhibitor The Costackataser) tartalmazott. ezt követi a szövet mechanikai szétszakítása (TissueLyser LT, Qiagen). A mintákat ezután 10 percig centrifugáltuk 5,000 fordulat/perc sebességgel, és a felülúszót 4 °C-on tároltuk a további felhasználásig. A LEGENDplex Rat Inflammation Panel (katalógusszám: 740401, BioLegend), egy gyöngy alapú multiplex ELISA készletet futtattuk a következő citokinek mennyiségi meghatározására; IL-1α, IL-1β, IL-6, IL-10, IL-12p70, IL-17A, IL-18, IL-33, CXCL1 (KC), CCL2 (MCP-1), granulocita-makrofág telep-stimuláló faktor, interferon-γ és tumor nekrózis faktor. A készletet a gyártó utasításai szerint futtattuk, 15 µl rögzített térfogatú fehérjével. A felülúszóval való inkubálást követően a gyöngyöket BD FACSVerse áramlási citométeren futtattuk, és az adatokat LEGENDplex adatelemző szoftverrel elemeztük.
Neurális stimuláció
Intrafascicularis beültetés
Minden állatkísérletet jóváhagyott az Universitat Autònoma de Barcelona etikai bizottsága az Európai Közösségek Tanácsának 2010/63/EU irányelvével összhangban. Az állatokat 22 ± 2 °C-on tartottuk 12 órás világos/12 órás sötét ciklusban, ahol az élelmiszer és a víz szabadon hozzáférhető volt. Altatott nőstény Sprague-Dawley patkányok ülőidege (250-300 g, ~18 hetes) műtéti úton exponáltuk, és a TIME elektródákat keresztirányban beültették az ülőidegre egy 10-0 hurokszálhoz rögzített egyenes tű segítségével.46. A folyamatot disszekciós mikroszkóp alatt követtük, hogy megbizonyosodjunk az aktív helyek megfelelő elhelyezkedéséről az idegfacsontokon belül. 4b). A kísérletek során az állat testhőmérsékletét melegítőpárnával tartottuk fenn.
Az idegstimulációt fix időtartamú, 100 µs/fázisú kétfázisú áramimpulzusok alkalmazásával végeztük, és az amplitúdót 0-ról 150 µA-re növeltük 1 vagy 3 µA lépésekben 3 Hz-en 33 másodpercig (Stimulátor N és ITE, különböző DigiEGtimer 4 mikroelektródák. Ezzel egyidejűleg a CMAP-okat a GM, TA és PL izmokból rögzítettük kis tűelektródákkal (13 mm hosszú, 0.4 mm átmérőjű, rozsdamentes acél tűelektródák A-03-14BEP, Bionic), amelyeket mindegyik izomba helyeztek.62. Az aktív elektródát az izomhasra helyeztük, a referencia pedig az ín szintjén. Az elektromiográfiás felvételeket felerősítették (×100 GM és TA, × 1,000 PL; P511AC erősítők, Grass), sáváteresztő szűréssel (3 Hz-3 kHz), majd PowerLab rögzítési rendszerrel digitalizáltuk (PowerLab16SP, ADInstruments).
Az adatok elemzése
Mindegyik CMAP amplitúdóját az alapvonaltól a maximális negatív csúcsig mértük. A feszültségcsúcs méréseket a kísérletben minden egyes izomra kapott maximális CMAP amplitúdóra normalizáltuk. A szelektivitási indexet (SI) minden aktív helyre kiszámítottuk az egyik izom normalizált CMAP amplitúdója, a CMAP arányaként.iés a normalizált CMAP amplitúdók összege a három izomban az SI képlet szerinti = nCMAPi/∑nCMAPj, azon a minimális stimulációs áram amplitúdóján, amely funkcionálisan minimális izomreakciót váltott ki (amely legalább 5%-os CMAP amplitúdóként van meghatározva az egyik izom esetében, az adott izom korábban meghatározott maximális CMAP amplitúdójához képest). Ezután a három izom mindegyikénél a legmagasabb SI-vel rendelkező aktív helyeket választottuk ki az egyes izmok SI-jeként egy adott kísérletben.
Krónikus intraneurális biokompatibilitás
Egy korábban bejelentett eljárást követve50,63, altatott Sprague–Dawley nőstény patkányok ülőidege (250-300 g, ~18 hetes) exponáltuk, és az EGNITE-tel és anélkül való in vivo biokompatibilitást biztosító eszközöket hosszirányban beültettük az ülőideg sípcsont ágába.n = 6–8 csoportonként). Röviden, az ideget a trifurkációnál átszúrjuk egy egyenes tűvel, amely egy 10-0 hurokszálhoz van rögzítve (STC-6, Ethicon); a menet meghúzza a hajlított elektródacsík nyíl alakú hegyét. A hegyet levágják, hogy eltávolítsák a cérnát, és mindkét kar hegye kissé meg van hajlítva, hogy elkerülje a készülék kihúzását. A longitudinális implantátumot azért választottuk, mert ez lehetővé teszi az idegben lévő idegentestreakció jobb tanulmányozását50.
Ideg- és állati funkcionális értékelés
Az állatokat a beültetés utáni nyomon követés során idegvezetési, algezimetriás és sétapályás mozgási tesztek segítségével értékelték.62. A vezetési tesztekhez a beültetett és az ellenoldali mancsok ülőidegét tűelektródákkal stimuláltuk az ülőizom bevágásánál, és a PL izom CMAP-ját a fentiek szerint rögzítettük. Megmértük a CMAP látenciáját és amplitúdóját. Az algezimetriás teszthez patkányokat dróthálós platformra helyeztünk, és mechanikus, nem káros ingert alkalmaztunk egy elektronikus Von Frey algeziméterhez (Bioseb) csatlakoztatott fémhegy segítségével. Megmértük a beültetett mancsok nociceptív küszöbértékét (az az erő grammban, amelynél az állatok kihúzták a mancsot) az ellenoldali mancsok ellen. A sétálópálya-teszthez a hátsó mancsok talpi felületét fekete tintával festették le, és minden patkányt hagytak egy folyosón sétálni. A lábnyomokat összegyűjtöttük, és kiszámítottuk az ülői funkcionális indexet62.
Szövettan
2 vagy 8 hét elteltével az állatokat PFA-val (4%) perfundáltuk, és az ülőidegeket begyűjtöttük, utófixáltuk, mélyhűtöttük és szövettani elemzés céljából feldolgoztuk. Az FBR értékeléséhez az ülőidegeket kriosztáttal (Leica CM15) 190 μm vastag keresztmetszetekre vágtuk. A mintákat myelinizált axonok (anti-RT97 a Neurofilament 200K jelölésére, 1:200; Developmental Studies Hybridoma Bank) és makrofágok (anti-Iba-1, 1:500; Wako) elleni primer antitestekkel festették. Ezután a metszeteket 1 órán át szobahőmérsékleten inkubáltuk a szamár anti-egér Alexa Fluor 488 és a szamár anti-nyúl Alexa Fluor 555 (1:200, Invitrogen) másodlagos antitestekkel. A sípcsont idegben lévő implantátum központi részéből reprezentatív metszeteket választottunk ki, a képeket digitális fényképezőgéphez (DS-Ri2, Nikon) csatlakoztatott epifluoreszcens mikroszkóppal (Eclipse Ni, Nikon) készítettük, és a képelemzést ImageJ szoftverrel (National Institutes) végeztük. egészségügy). Számszerűsítettük az Iba-1-pozitív sejtek mennyiségét a sípcsont ideg teljes területén, és a szövetkapszula vastagságát az implantátum mindkét oldalának a legközelebbi axonokhoz való átlagos távolságaként mértük.
Statisztikai analízis
Az adatok statisztikai elemzéséhez egy- vagy kétutas ANOVA-t, majd Bonferroni post hoc tesztet használtunk a csoportok vagy időpontok közötti különbségek megállapítására. GraphPad Prism szoftvert használtunk a grafikus ábrázoláshoz és elemzéshez. Statisztikai szignifikanciát akkor vettek figyelembe P <0.05.
Jelentési összefoglaló
A kutatástervezésről további információk a Nature Portfolio Reporting Összefoglaló ehhez a cikkhez kapcsolódik.
- SEO által támogatott tartalom és PR terjesztés. Erősödjön még ma.
- PlatoData.Network Vertical Generative Ai. Erősítse meg magát. Hozzáférés itt.
- PlatoAiStream. Web3 Intelligence. Felerősített tudás. Hozzáférés itt.
- PlatoESG. Carbon, CleanTech, Energia, Környezet, Nap, Hulladékgazdálkodás. Hozzáférés itt.
- PlatoHealth. Biotechnológiai és klinikai vizsgálatok intelligencia. Hozzáférés itt.
- Forrás: https://www.nature.com/articles/s41565-023-01570-5
- :van
- :is
- :nem
- :ahol
- ][p
- $ UP
- 000
- 1
- 10
- 100
- 12
- 13
- 130
- 15%
- 150
- 160
- 19
- 1998
- 20
- 200
- 2010
- 2011
- 2014
- 2016
- 2018
- 2020
- 2022
- 22
- 24
- 25
- 250
- 26
- 27
- 28
- 30
- 300
- 320
- 33
- 35%
- 350
- 40
- 400
- 41
- 43
- 46
- 50
- 500
- 54
- 58
- 60
- 600
- 7
- 70
- 700
- 75
- 8
- 80
- 87
- 9
- 90
- a
- Képes
- felett
- hozzáférés
- összhangban
- Szerint
- akusztikus
- szerez
- szerzett
- beszerzés
- át
- törvény
- aktív
- Az aktiválás
- aktív
- tevékenység
- adaptív
- További
- cím
- Beállított
- Felnőtt
- Után
- AG
- újra
- AL
- Alkohol
- Alexa
- algoritmus
- Minden termék
- lehetővé teszi, hogy
- mentén
- am
- Környező
- összeg
- Erősített
- an
- elemzések
- elemzés
- Horgony
- és a
- állat
- állatok
- Az antitestek
- ellenanyag
- külön
- Alkalmazás
- alkalmazott
- Alkalmazása
- megközelítés
- megfelelő
- jóváhagyás
- jóváhagyott
- VANNAK
- TERÜLET
- területek
- ARM
- körül
- Sor
- cikkben
- AS
- értékeli
- értékelés
- társult
- feltevés
- At
- Légkör
- atom
- figyelem
- felhatalmazott
- elérhető
- elkerülése érdekében
- el
- háttér
- Bank
- barcelona
- bázis
- alapján
- kiindulási
- BD
- BE
- Gerenda
- mert
- óta
- előtt
- viselkedés
- lent
- Jobb
- között
- kötés
- orvosbiológiai
- Bit
- Fekete
- zárolt
- testületek
- test
- mindkét
- Doboz
- dobozok
- Agy
- agyvelő
- Ág
- tömören
- széles
- hozott
- ütköző
- de
- by
- kábel
- számít
- számított
- szoba
- kapacitív
- Kapacitás
- ami
- végrehajtott
- eset
- Kategória
- ccl2
- sejt
- Cellák
- cement
- központi
- kihívások
- jellemzett
- díj
- Károly
- kémiai
- választott
- besorolás
- osztályozott
- kettyenés
- zárt
- koktél
- gyűjtemény
- Oszlopok
- kombinált
- jön
- bizottság
- Közösségek
- közösség
- Befejezett
- összetétel
- Körülmények
- lefolytatott
- vezetőképesség
- Configuration
- Csatlakozás
- összefüggő
- figyelembe vett
- Összeáll
- állandó
- kapcsolat
- tartalmazott
- folyamatos
- hozzájárulás
- Konvergencia
- kijavítására
- Megfelelő
- folyosó
- kéreg
- Tanács
- társaik
- tanfolyam
- fedett
- kritikai
- Kereszt
- mélyhűtve tartósítva
- Jelenlegi
- szokás
- vágás
- ciklus
- ciklusok
- citokinek
- káros
- sötét
- dátum
- adatelemzés
- Nap
- de
- csökkenés
- tekinteni
- meghatározott
- del
- szállított
- függ
- letét
- letétbe
- mélység
- leírt
- Design
- kívánatos
- részletes
- Határozzuk meg
- eltökélt
- meghatározó
- fejlődési
- eszköz
- Eszközök
- DID
- Diéta
- különbség
- különbségek
- különböző
- digitális
- digitalizált
- hígított
- közvetlen
- közvetlenül
- elmozdulás
- Zavar
- távolság
- megosztott
- do
- domain
- csinált
- le-
- Csepp
- két
- időtartama
- alatt
- E&T
- minden
- él
- elektromos
- Elektronikus
- elem
- elefánt
- emelkedett
- átfogó
- energia
- növelése
- fokozott
- fokozás
- biztosítására
- felszerelt
- Egyenértékű
- megalapozott
- becsült
- Eter (ETH)
- etikai
- EUR
- európai
- EV
- értékelték
- értékelés
- esemény
- Minden
- mindenhol
- bizonyít
- megvizsgálni
- kivétel
- várható
- kísérlet
- kísérleti
- kísérletek
- kitett
- Exponálás
- kifejezve
- mérték
- kivonat
- megkönnyítése
- tény
- tényező
- Esik
- messze
- GYORS
- Jellemzők
- női
- Füge
- Ábra
- megtöltött
- Film
- filmek
- szűrő
- Végül
- vezetéknév
- szerelvény
- rögzített
- Rugalmasság
- rugalmas
- áramlási
- összpontosított
- összpontosítás
- követ
- következő
- élelmiszer
- A
- Kényszer
- külföldi
- forma
- képlet
- KERET
- Ingyenes
- önként
- Fagyasztó
- francia
- ból ből
- front
- fagyasztva
- Tele
- teljesen
- funkcionális
- funkcionálisan
- további
- jövő
- Nyereség
- adott
- általános
- geometria
- Ad
- adott
- üveg
- GM
- Go
- Arany
- Grafén
- fű
- Földi
- Csoport
- Csoportok
- irányelvek
- kellett
- fél
- Kezelés
- Legyen
- Egészség
- segít
- félgömbök
- nagy felbontású
- legnagyobb
- tartó
- Lyuk
- Kezdőlap
- Otthoni munkavégzés
- Vízszintes
- FORRÓ
- azonban
- HTTPS
- huang
- i
- azonosított
- azonosítani
- IEEE
- kép
- képelemzés
- képek
- Hatás
- in
- Beleértve
- növekvő
- inkubált
- INKUBÁCIÓ
- index
- egyéni
- gyulladás
- információ
- bemenet
- belső
- Intézet
- utasítás
- integrált
- integrálása
- szándékolt
- Felület
- interfészek
- bele
- vizsgálja
- IT
- ITS
- tartotta
- készlet
- Koch
- Címke
- laboratórium
- nagy
- nagyobb
- lézer
- keresztnév
- Késleltetés
- a későbbiekben
- Törvény
- réteg
- legkevésbé
- balra
- Jogalkotás
- Hossz
- szint
- könyvtár
- mint
- korlátozások
- vonal
- LINK
- összekapcsolt
- Folyadék
- kiszámításának
- helyi
- található
- helyszínek
- Hosszú
- hosszú lejáratú
- elveszett
- leeresztett
- makrofágok
- készült
- Fő
- fenntartása
- csinál
- térkép
- Térképek
- maszk
- párosított
- anyag
- anyagok
- matplotlib
- maximális
- mc
- jelent
- eszközök
- megmért
- mérés
- mérések
- mérő
- mechanikai
- Média
- fém
- módszer
- mikrogliák
- mikrofon
- Mikroszkóp
- Mikroszkópia
- Középső
- perc
- minimális
- minimum
- minisztérium
- keverék
- ML
- modell
- modellek
- modul
- Modulok
- molekula
- ellenőrizni
- hónap
- egér
- mozog
- áthelyezve
- MS
- többcsatornás
- muscle
- nanotechnológia
- nemzeti
- National Institutes of Health
- Természet
- Közel
- elengedhetetlen
- elhalás
- igények
- negatív
- NEO
- háló
- hálózat
- ideg-
- neurofilamentum
- neuronok
- következő
- nem
- Zaj
- szám
- számtalan
- tárgy
- célkitűzés
- objektumok
- megfigyelni
- szerez
- kapott
- of
- kedvezmény
- Office
- Nem elérhető
- Régi
- on
- egyszer
- ONE
- csak
- nyitva
- nyílások
- hajtású
- or
- Más
- mi
- ki
- teljesítmény
- kívül
- felett
- átfogó
- éjszakai
- áttekintés
- Oxigén
- csomagok
- párna
- Fájdalom
- pandák
- panel
- rész
- elhalad
- minták
- MANCS
- PBS
- Csúcs
- mert
- teljesítmény
- teljesített
- időszak
- kerületi
- fázis
- fenotípus
- csapok
- csővezeték
- pixel
- helyezett
- Planes
- emelvény
- platina
- Plató
- Platón adatintelligencia
- PlatoData
- plusz
- pm
- pont
- pont
- portfolió
- pozíció
- pozitív
- állás
- potenciális
- hatalom
- előzetes
- előkészítés
- előkészített
- jelenlét
- bemutatott
- konzervált
- nyomás
- korábban
- elsődleges
- Előzetes
- szonda
- eljárások
- folyamat
- feldolgozott
- Folyamatok
- termelő
- Termékek
- megfelelően
- ingatlanait
- ingatlan
- arány
- védelme
- Fehérje
- protokoll
- protokollok
- ad
- amely
- Húz
- impulzus
- Piton
- R
- hatótávolság
- kezdve
- PATKÁNY
- Arány
- hányados
- RE
- reakció
- reakciók
- kész
- fogadó
- ajánlások
- feljegyzett
- felvétel
- felépülés
- csökkenteni
- Csökkent
- csökkentés
- referencia
- regenerálódás
- rezsimek
- vidék
- relatív
- marad
- eltávolítása
- eltávolított
- eltávolítása
- megismételt
- cserélni
- Számolt
- Jelentő
- képviselet
- reprezentatív
- kutatás
- Ellenállás
- Felbontás
- tisztelet
- illetőleg
- válasz
- válaszok
- Eredmények
- megfordítás
- Kritika
- szalag
- Gazdag
- jobb
- Emelkedik
- Folyó
- Szoba
- futás
- s
- azonos
- beolvasás
- szkriptek
- Második
- másodlagos
- Rész
- szakaszok
- biztonság
- lát
- kiválasztott
- Series of
- Szérum
- Szettek
- számos
- Alak
- mutatott
- Műsorok
- oldal
- Jel
- jelek
- jelentőség
- jelentős
- Ezüst
- egyszerre
- egyetlen
- weboldal
- Webhely (ek)
- Méret
- Bőr
- Csúszik
- Diák
- csúszó
- kicsi
- Snap
- szoftver
- megoldások
- hang
- forrás
- térbeli
- Hangszóró
- hangszórók
- meghatározott
- szemüveg
- spektroszkópia
- tüskék
- Centrifugálás
- négyzet
- Stabilitás
- stabilizálni
- verem
- Rozsdamentes acél
- standard
- szabvány
- Kezdve
- Állami
- statisztikai
- statisztika
- Gőz
- acél-
- Származik
- Lépés
- Lépései
- inger
- tárolás
- memorizált
- egyenes
- Stratégia
- Strip
- erős
- szerkezeti
- struktúrák
- tanulmányok
- Tanulmány
- bőr alatti
- későbbi
- lényeges
- ilyen
- összeg
- felületi
- Sebészet
- rendszer
- T
- Vesz
- meghozott
- cél
- Feladat
- technikák
- Technológia
- ideiglenes
- teszt
- tesztek
- mint
- hogy
- A
- A terület
- A jövő
- Az Egyesült Királyságban
- azok
- akkor
- Ott.
- termikus
- ők
- ezt
- azok
- három
- küszöb
- Keresztül
- egész
- Így
- idő
- alkalommal
- típus
- tippek
- szövet
- Titán
- nak nek
- TONE
- felső
- Végösszeg
- megható
- felé
- vágány
- vonatok
- transz
- átruházás
- átment
- Átadó
- átmenet
- kezelt
- kezelés
- kezelések
- vizsgálatok
- oktatói
- kettő
- típus
- Uk
- ultrahang
- alatt
- megértés
- esett át
- -ig
- használ
- használt
- segítségével
- Vákuum
- érvényes
- érték
- Értékek
- Ellen
- keresztül
- vivo
- Feszültség
- kötet
- az
- W
- séta
- gyalogos
- volt
- Víz
- we
- hét
- Hetek
- mérés
- súly
- Jólét
- voltak
- amikor
- ami
- míg
- fehér
- egész
- ablak
- Huzal
- val vel
- visszavonás
- nélkül
- Munka
- dolgozott
- dolgozó
- X
- röntgen
- zephyrnet