Minden reagenst a beszerzett állapotban használtunk, hacsak másként nem jelezzük. Minden vegyszert a Sigma Aldrich cégtől vásároltunk, kivéve a számlálógyöngyöket (CountBright Absolute Counting Beads, Invitrogen). ζ- A potenciált Zetasizer NanoZS90 (Malvern Instruments) segítségével mérték. A részecskék méretét és morfológiáját SEM vizsgálta egy JEOL JSM 7800F Prime mikroszkóppal, integrált EDS-sel az elemanalízis érdekében. A részecskeméretet 50 független részecske mérésével határoztuk meg. A rádiós azonnali vékonyréteg-kromatográfiát (ITLC) Agilent Technologies üveg-mikroszálas kromatográfiás papírra fejlesztették ki, amelyet kovasavval impregnáltak, és Lablogic Flow-count TLC szkennerrel és BioScan B-FC-3200 fotosokszorozócső (PMT) detektorral Laura szoftverrel elemezték. Az ITLC mozgófázis 0.175 M citromsavból és 0.325 M trinátrium-citrátból állt vízben, hacsak másképp nem jelezzük. A radioaktív mintákat Capintec CRC-25R (Capintec) vagy LKB Wallac 1282 Compugamma CS (PerkinElmer) segítségével mértük, amelyekhez az adatokat EdenTerm szoftverrel gyűjtöttük. Az áramlási citometriás kísérleteket BD FACSMelody sejtosztályozóban hajtottuk végre a BD FACSChorus szoftverrel. A PET/CT képeket NanoPET/CT szkennerrel (Mediso) vettük, Nucline v.0.21 szoftverrel rekonstruáltuk, a képeket VivoQuant szoftverrel (3.5-ös verzió, InviCRO) elemeztük. A Listmode adatokat a Mediso által kifejlesztett speciális MATLAB szoftverrel szereztük be. Az autoradiográfiát GE Amersham Typhoon készülékkel végeztük.
Szubmikrométer méretű szilícium-dioxid részecskék szintézise
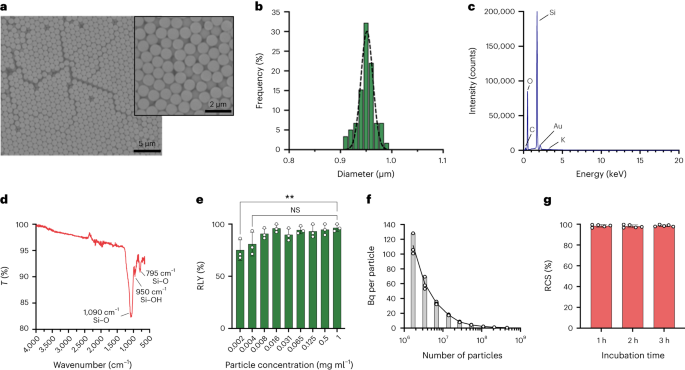
A részecskéket Stöber-módszerrel szintetizálták. Ez a módszer a szilícium-alkoxidok hidrolízisén és kondenzációján alapul, monodiszperz, gömb alakú szilícium-dioxid részecskék előállítására.27. Szilíciumforrásként tetraetil-ortoszilikátot (TEOS), báziskatalizátorként ammóniát, elektrolitként kálium-kloridot használtak. A TEOS etanolos oldatát folyamatosan adtuk a katalizátort és az elektrolitot tartalmazó oldathoz. A reagens kiindulási mennyiségének vagy adagolási sebességének módosítása eltéréseket eredményez a részecskeméretben, amint azt korábban közöltük28. Itt két oldat készült a részecskék szintézise előtt: az 1. oldat 19.0 mmol TEOS-t tartalmaz 33.3 ml etanolban és a 2. oldat, amely 0.23 mmol KCl-t tartalmaz 9 ml ammóniában, 65 ml etanolban és 6.75 ml hidrogénben.2O. A szintézishez a 2. oldatot egy 250 ml-es gömblombikba helyeztük, amelyet 50 °C-ra melegítettünk, keverés közben 300 fordulat/perc sebességgel 15 percig. Ezután az 1. oldatot cseppenként hozzáadtuk a 2. oldathoz (adagolási sebesség 0.2 ml perc).-1). Az 1. oldat hozzáadása után a kapott részecskéket centrifugálással tisztítjuk 18,300 XNUMX °C-ong 3 percig, majd ötször mossuk EtOH-val. Végül a SiO2 A mikrorészecskéket vákuumban szárítottuk.
A mikrométer alatti részecskék oltása szilán-PEG-gel5k
A 20 mg ml-1 szilán-PEG oldat5k (Sigma Aldrich) 98%-os EtOH-ban adtunk smSiP oldatához 5 mg ml-ben.-1 EtOH-ban 98% és 2.8% ammónia. Az elegyet egy éjszakán át szobahőmérsékleten keverjük, és a részecskéket centrifugálással kinyerjük 18,300 XNUMX °C-on.g 3 percig. Végül a részecskéket háromszor mostuk desztillált vízzel, és egy éjszakán át vákuumban szárítottuk. A mosóoldatokat egy éjszakán át fagyasztva szárítottuk, és a kötetlen szilán-PEG mennyiségét5k súlyozva a reakcióhozam kiszámításához. A 0.05 mg ml-1 smSiP–PEG oldata5k desztillált vízben végzett további radioaktív jelölési reakciókhoz.
[68Ga]GaCl3
A gallium-68 úgy eluálódott, mint [68Ga]GaCl3 egy Eckerttől és Zieglertől 68Ge/68Ga generátor ultratiszta HCl-ben (4 ml, 0.1 M), a jó gyártási gyakorlat követelményei szerint (ABX) gyártva.
Koncentrációja a [68Ga]GaCl3 kationcserével történő elúció
Az elúció koncentrációját a kiegészítő ábrán leírt beállítással végeztük. 1. Először a 4 ml-es [68Ga]GaCl3 Az eluátumot egy Strata-XC 33u kazettára (Phenomenex) töltöttük, és az eluátumot eldobtuk. Ezután a patront 5 ml aceton/0.1 M HCl (80:20) oldattal mostuk, és az eluátumot elöntöttük. Végül a koncentrált [68Ga]GaCl3 700 µl aceton/0.05 M HCl (98:2) oldat hozzáadásával összegyűjtöttük, nitrogénatmoszférában szárítottuk.2 50 µl 0.5 M HEPES pufferben (pH 4.9) újraszuszpendáljuk. A rádió-TLC-t a minőség-ellenőrzés különböző szakaszaiban végeztük. A protokoll körülbelül 20 percet vesz igénybe, 86.2 ± 8.5%-os visszanyerési hozamot biztosítva.
Szilícium-dioxid részecskék radioaktív jelölése különböző koncentrációkban 68Ga
A szilícium-dioxid részecskéket különböző koncentrációkban (1 és 0.002 mg ml között) szuszpendáltuk.-10.5 M HEPES pufferben (pH 4.9). Ezután az oldatból 50 µl-t adtunk egy reakciócsőbe, mielőtt hozzáadtuk a koncentrált [68Ga]GaCl3 Elúció 50 µl 0.5 M HEPES pufferben (pH 4.9). A reakciókat 90 °C-on 30 percig végeztük, és radio-TLC-vel számítottuk ki a radiokémiai hozamot.
Részecskekoncentráció mérése áramlási citometriával
A részecskekoncentrációkat áramlási citometriával számítottuk ki számlálógyöngyök (CountBright Absolute Counting Beads, Invitrogen) segítségével, a gyártó utasításait követve. A szilícium-dioxid részecskéket 0.05 mg ml-ben újraszuszpendáltuk-110 percig ultrahanggal kezeltük, és egy 10 µm-es levágási méretű szűrőn (KX Syringe Filter, Nylon, 25 mm, 10 µm) engedtük át. A CountBright Absolute Counting Beads gyöngyöket szobahőmérsékletre melegítettük, és 30 másodpercig vortexeltük. Ezután 50 µl gyöngyöt adtunk 300 µl szilícium-dioxid-részecskékhez, és az elegyet 30 percig vortexeltük, hogy homogén oldatot kapjunk. A mintát az áramlási citométeren futtattuk, és az előre irányuló szórás (FSC) küszöbértékét úgy állítottuk be, hogy az tartalmazza a gyöngyöket és a részecskéket a lineáris FSC versus lineáris oldali szórási diagramon. Ezt követően a fluoreszcencia detektor feszültségét beállítottuk a számláló gyöngyökhöz, és kapuzási stratégiát hajtottunk végre a szilícium-dioxid részecskék és a számláló gyöngyök populációinak izolálására. Végül kapukat rajzoltunk a részecskékre és az abszolút számláló gyöngyökre, és minden mintánál 1,000 gyöngy eseményt rögzítettünk. Ezzel a stratégiával az oldatban lévő részecskék számát a következő egyenlettel számítottuk ki:
$$begin{array}{l}displaystyle{mathrm{Absolute}},{mathrm{count}},left(frac{mathrm{Particles}}{{{upmu l}}}right)=displaystylefrac{({mathrm{ Részecskék}},{mathrm{count}},times,{mathrm{Counting}},{mathrm{beads}},{mathrm{volume}})}{({mathrm{Counting}},{mathrm{beads}} ,{mathrm{count}},times,{mathrm{Particles}},{mathrm{volume}})} alkalommal,{matehrm{Counting}},{matehrm{beads}},{matehrm{concentration}}left(frac) {{mathrm{Beads}}}{{{upmu l}}}jobb)end{array}$$
500 smSiP radioaktív jelölése
Ötszáz smSiP-t adtunk 50 µl koncentrált [68Ga]GaCl3 eluálás 0.5 M HEPES pufferben, pH 4.9. Ezután 5.6 µl poliszorbát 80-at adtunk hozzá, és az elegyet 90 °C-on 30 percig 900 fordulat/perc sebességgel melegítettük termikus keverőben. Ezt követően egy végső többlépéses tisztítási protokollt terveztek a nem reagált/kolloid anyagok eltávolítására 68Ga. 10 mikroliter 5 mM EDTA-t adtunk hozzá, és az elegyet 3 percig szobahőmérsékleten inkubáltuk. Ezután a részecskéket 18,300 percig XNUMX XNUMX °C-on centrifugáltukg500 µl 1 mM EDTA + 0.1% poliszorbát 80-at tartalmazó PBS-ben újraszuszpendáljuk, és 10 másodpercig óvatosan vortexeljük. A részecskéket ismét centrifugáltuk, 0.1 mM EDTA + 0.1% poliszorbát 80 PBS-ben készült oldatával mostuk, és óvatosan vortexeltük 10 másodpercig. Végül a részecskéket centrifugáltuk, és még ötször mostuk PBS + 0.1% poliszorbát 80-zal, majd 500 µl PBS-ben újraszuszpendáltuk. A radioaktív jelölési reakciót radio-TLC-vel követtük az egymást követő reakciólépések során, hogy értékeljük a kolloidok jelenlétét (amelyek összetéveszthetők a részecskékkel, ha nem távolítják el megfelelően), a részecskék radioaktív jelölését és a végtermék tisztaságát. Az RLY-t a részecskékben és a felülúszókban lévő radioaktivitás mennyiségének összehasonlításával számítottuk ki a mosási lépések után.
Frakcionálást
A frakcionálási stratégiához 0.5 µl és 20 µl közötti térfogatok 68Ga-smSiP 1 µl elméleti koncentrációban-1 1 µl-es lépésekben (0.5, 1, 2, 3…) adtunk különböző mintacsövekbe, és PBS-t adtunk hozzá, hogy a végső térfogat 50 µl legyen. Ezután az első csőből 37.5 µl-t pipettáztunk egy második mintacsőbe, 25 µl-t a második csőből egy harmadik csőbe, végül 12.5 µl-t a harmadik csőből egy negyedik csőbe. Ez a stratégia mintánként négy csövet biztosít, amelyek végső térfogata 12.5 µl. Az egyes csövekben a radioaktivitást gamma-számlálóval mértük, és az értékeket kBq-ben számítottuk ki egy kalibrációs görbe segítségével további összehasonlítás és elemzés céljából. A radioaktivitás nagy részét csak egy csőben tartalmazó mintákat 30 másodpercig szobahőmérsékleten ultrahanggal kezeltük, és egy második frakcionálási lépésnek vetettük alá. Ezután azokat a mintákat, amelyekben az összes radioaktivitást egyetlen csőben találták (a másik három csőben elhanyagolható aktivitással), további in vivo/ex vivo kísérletekhez használták fel.
PET/CT fantomképalkotás
Az egyikkel fantomképalkotási kísérletet végeztek 68Ga-smSiP. Kanült használtunk a részecskék mintacsőbe való bejuttatására annak értékelésére, hogy egyetlen részecske maradhat-e a kanülcsőben a beadás során. Röviden, a fantomcsövet a nanoPET/CT-szkennerbe helyeztük úgy, hogy a kanül hegyének vége a csőhöz volt rögzítve. A PET-gyűjtés megkezdése után a 100 µl PBS-ben újraszuszpendált részecskéket a kanül elejére erősített inzulinfecskendővel juttattuk be. Ezután a kanült 50 µl PBS-sel mostuk, hogy biztosítsuk a részecske bejutását a fantomcsőbe. A PET felvételt 2 órán keresztül végeztük, majd standard CT-vizsgálatot végeztünk.
In vivo PET/CT képalkotás
Az állatokon végzett képalkotó vizsgálatok etikailag felülvizsgálták és az Animals (Scientific Procedures) Act 1986 (ASPA) Egyesült Királyság Belügyminisztériumának állatkísérletekre vonatkozó előírásai szerint végezték el. Az in vivo képalkotást egészséges, 8 hetes BALB/c egereken végeztük. Az állatokat izofluránnal (2-3% oxigénben) érzéstelenítettük, kanülbe helyeztük és altatásban a szkennerágyra helyeztük. Az ágyat belső levegőáram segítségével 37 °C-ra melegítettük, hogy az állat normál testhőmérsékleten tartható legyen, a légzésszámot pedig 60-80 percenkénti lélegzetvétellel figyeljük és tartjuk.-1 az egész szkennelés alatt. Az állatok hőmérsékletének ellenőrzése fontos, mivel a hőmérséklet váratlan csökkenése a vérben lévő részecske sebességének csökkenéséhez vezethet. Egy 68Ga-smSiP (n = 4) vagy 68Ga-smSiP–PEG5k részecske (n = 2) a kanülön keresztül 100 µl PBS-ben adtuk be, majd a PET-gyűjtés megkezdése után 50 µl PBS-sel mostuk (1:5 koincidencia mód; 5 ns koincidencia időablak). A PET-et 2 órán keresztül rögzítettük, majd félkör alakú CT-vizsgálatot végeztünk. Az állat testhőmérsékletét és légzési gyakoriságát a teljes folyamat során monitoroztuk. A dinamikus PET/CT képeket Tera-Tomo 3D rekonstrukcióval (400–600 keV energiaablak, 1:5 koincidencia mód, 20 iteráció és 1 részhalmaz) rekonstruáltuk 0.4 × 0.4 × 0.4 mm-es voxelmérettel.3 és korrigált a csillapítás, szóródás és bomlás szempontjából. A lista módú adatok az összes PET/PEPT beszerzéshez megtalálhatók 68Ga-smSiP a ref. 29 és a 68Ga-smSiP–PEG5k ref. 30.
Valós idejű követés
Először az adatok exportálásra kerültek a szkennerből listmode formátumban (vagyis olyan formátumban, amely időbélyeggel és kristályindexszel rendelkezik az észlelt koincidencia-fotonokhoz). Geometriai transzformációt alkalmaztunk a kristályindexek mm-ben megadott pozícióra való konvertálására. A birminghami módszer iteratív módon számítja ki az MDP-t az összes LoR részhalmazából. Ezt úgy teszi, hogy eldobja azokat a LoR-eket, amelyek egy beállított távolságnál távolabb vannak az MDP-től, mivel ezek valószínűleg hamis LoR-ekből származnak, például olyan LoR-kből, amelyek szóródásból származhatnak. Az MDP minden iterációval finomodik; az iterációk számát hatékonyan a f-tényező, és az adott részhalmazon belüli végső részecskepozíció becslésére használt LoR-ek teljes számára vonatkozik (például egy fA 0.5-ös tényező azt jelenti, hogy az iterációs hurok akkor fejeződik be, amikor az alhalmaz LoR-einek 50%-a megmarad). Az egy részhalmazban használt LoR-ek száma csökkenthető az időbeli mintavétel javítása érdekében (az alhalmazok időben egymás után vannak átfedés nélkül), a pozíció bizonytalanságának növelése árán (az algoritmus további részleteit Parker et al.5) A birminghami módszert használták a PET-szkennerből származó lista módú adatok elemzésére. Az egerekben lévő részecskék nyomon követésére adaptív mintaméretet használtunk. A minta méretét úgy állítottuk be, hogy a megfelelő időbeli mintavétel egyensúlyát biztosítsa, miközben minimalizálja a pozicionálási hibákat. 100 és 200 LoR közötti mintaméretet használtak a szkennelések korai szakaszában (<60 s a vizsgálat kezdetétől). f = 0.1, körülbelül 1-5 másodperces intervallumot eredményezve. 60 másodpercnél hosszabb szkennelési időknél a minta mérete 1,000 és 2,000 között változott, ami az in vivo kísérlettől függően 30 és 60 másodperc közötti időintervallumot eredményezett. Az MDP kiszámításához használt számlálások számát (a végső iterációban) úgy kaphatjuk meg, hogy a minta méretét megszorozzuk f-tényező érték. Ezek a paraméterek a korábbi tapasztalatokon alapultak, és korábbi publikációk alapján készültek1.
A sebességet mint (sqrt{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) ahol ({v}_{m}^{2}) a sebesség a x, y és a z irányban.
Ex vivo szervfelvétel
A különböző szervekben történő felvételt gammaszámlálással értékeltük. Az in vivo PET/CT leképezést követően az állatokat nyaki diszlokációval leöltük, a szerveket kimetszettük, és gamma-számlálóban (LKB Wallac 1282 Compugamma CS) lemértük a radioaktivitás-számlálást. Az adatokat százalékos befecskendezett dózisban fejeztük ki (dózis a szervben/teljes injektált dózis) szövet grammonként (%ID g-1).
Autoradiográfia
A tüdő radioaktivitását sugárdetektorral (EP15 szonda, Morgan) követték nyomon, és a tüdőt szikével kis részekre vágták, amíg a radioaktív jelet tartalmazó kis szövetrészletet megkapták. A szövetet –80 °C-os izopropanolban pillanatok alatt lefagyasztottuk. Közvetlenül a fagyasztás után a szövetet optimális vágási hőmérsékletű közegbe ágyaztuk, és kriosztátban 20 µm-es szeletekre vágtuk. Minden szeletet felmértünk a detektorral, amíg meg nem találtuk a radioaktív szeletet. Az előző (háttér alatti), radioaktív és következő (háttér alatti) szeletet Superfrost mikroszkóp tárgylemezre (Epredia) helyeztük. A megmaradt szövet többi része is a háttér alatt volt. A három metszetet tartalmazó mikroszkóp tárgylemezét ragasztófóliával fedtük le, és egy éjszakán át GE autoradiográfiás lemezre helyeztük. A lemezt GE Amersham Typhoon segítségével elemeztük 25 µm felbontással és 4,000 PMT beállítással. Az autoradiográfiás képet ráhelyeztük a szövet képére, amely egy radioaktivitási pontot mutatott a radioaktív szeletben. A számszerűsítéshez standardokat készítettünk különböző ismert tevékenységekben, és mindegyiket 1 µl-es kvintettként vettük észre a papíron. A foltokat ugyanabban a tároló foszforszűrőben, a GE-től származó BAS-IP MS-ben (Multipurpose Standard) inkubáltuk, mint az egyes részecskéket. A kép az Amersham Typhoon 5-tel készült, a Control Software 2.0-s verziójával foszfor üzemmódban, 100 µm pixelmérettel és 4,000 érzékenységgel. A képeket az ImageQantTL v10.0-261 szoftverrel, a gél kvantifikációs eszköztár segítségével számszerűsítettük. A foltokat úgy korrigáltuk, hogy állandó háttérként a folt előtti vagy utáni régiót választottuk. A kapott folt térfogatát használtuk a részecske Bq-jának kiszámításához a kalibrációs görbe alapján.
Statisztika és reprodukálhatóság
Kvantitatív elemzéshez legalább három biológiai ismétlést elemeztünk, kivéve az in vivo adatokat. 68Ga-smSiP–PEG5k (n = 2). Az adatokat közönséges egytényezős varianciaanalízissel (ANOVA) elemeztük Dunnett többszörös összehasonlítási tesztjével és Student-féle teszttel. t-teszt. A P a <0.05 értéket statisztikailag szignifikánsnak tekintettük.
- SEO által támogatott tartalom és PR terjesztés. Erősödjön még ma.
- PlatoData.Network Vertical Generative Ai. Erősítse meg magát. Hozzáférés itt.
- PlatoAiStream. Web3 Intelligence. Felerősített tudás. Hozzáférés itt.
- PlatoESG. Carbon, CleanTech, Energia, Környezet, Nap, Hulladékgazdálkodás. Hozzáférés itt.
- PlatoHealth. Biotechnológiai és klinikai vizsgálatok intelligencia. Hozzáférés itt.
- Forrás: https://www.nature.com/articles/s41565-023-01589-8
- :is
- :nem
- :ahol
- ][p
- 000
- 1
- 10
- 100
- 12
- 15%
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- Abszolút
- összhangban
- Elérése
- szerzett
- beszerzés
- felvásárlások
- törvény
- tevékenységek
- tevékenység
- adaptív
- hozzáadott
- hozzáadásával
- mellett
- Beállított
- beadott
- igazgatás
- előlegek
- Után
- később
- újra
- AIR
- AL
- algoritmus
- Minden termék
- Is
- Ammónia
- összeg
- an
- elemzés
- elemzés
- Horgony
- és a
- állat
- állatok
- alkalmazott
- körülbelül
- VANNAK
- felmerülhet
- AS
- At
- b
- háttér
- Egyenleg
- bázis
- alapján
- alap
- BD
- BE
- előtt
- Kezdet
- lent
- között
- Birmingham
- vér
- test
- tömören
- hoz
- ütköző
- by
- számít
- számított
- kiszámítja
- számítás
- TUD
- végrehajtott
- Katalizátor
- sejt
- vegyszerek
- választja
- kettyenés
- egybeesés
- összehasonlítás
- összehasonlítások
- áll
- sűrített
- koncentráció
- lefolytatott
- zavaros
- folyamatos
- figyelembe vett
- állandó
- folyamatosan
- ellenőrzés
- vezérelt
- megtérít
- korrigált
- Költség
- tudott
- Számláló
- számolás
- fedett
- Kristály
- cs
- görbe
- vágás
- vágás
- dátum
- szállít
- szállított
- kézbesítés
- attól
- leírt
- tervezett
- részletek
- észlelt
- eltökélt
- fejlett
- különbségek
- különböző
- irányok
- elmozdulás
- távolság
- nem
- adag
- húzott
- Csepp
- alatt
- dinamikus
- e
- E&T
- minden
- Korai
- hatékonyan
- elektrolit
- beágyazott
- kibocsátás
- munkavállaló
- végén
- energia
- Mérnöki
- biztosítására
- felszerelés
- hibák
- becslés
- Eter (ETH)
- értékelni
- értékelték
- események
- példa
- Kivéve
- kizárás
- tapasztalat
- kísérlet
- kísérletek
- kifejezve
- hamis
- Füge
- Film
- szűrő
- utolsó
- Végül
- vezetéknév
- öt
- áramlási
- követ
- következő
- A
- formátum
- Előre
- talált
- négy
- Negyedik
- Fagyasztó
- ból ből
- fagyasztva
- FSC
- további
- Gates
- ge
- generátor
- üveg
- jó
- irányító
- Gramm
- Növekedés
- egészséges
- itt
- Kezdőlap
- Otthoni munkavégzés
- HTTPS
- if
- kép
- képek
- Leképezés
- azonnal
- fontos
- javul
- in
- tartalmaz
- növekvő
- inkubált
- független
- index
- indexek
- tájékoztatták
- azonnali
- utasítás
- műszer
- eszközök
- integrált
- Felület
- belső
- bele
- IT
- ismétlés
- iterációk
- Tart
- ismert
- Kx
- vezet
- Valószínű
- LINK
- Tüdő
- fenntartása
- gyártott
- gyártási
- anyag
- Lehet..
- eszközök
- megmért
- mérő
- közepes
- módszer
- mód
- egerek
- mikron
- Mikroszkóp
- perc
- minimalizálása
- minimum
- keverő
- keverék
- ML
- Mobil
- Mód
- ellenőrizni
- több
- Morgan
- a legtöbb
- MS
- többszörös
- szaporodását
- nanotechnológia
- Természet
- következő
- nem
- normális
- szám
- szerez
- kapott
- of
- Office
- on
- ONE
- csak
- ellentétes
- optimálisan
- or
- rendes
- Más
- másképp
- ki
- felett
- éjszakai
- Oxigén
- Papír
- paraméterek
- részecske
- Elmúlt
- PBS
- mert
- százalék
- teljesített
- kedvenc
- fantom
- fázis
- Fotonok
- kép
- pixel
- helyezett
- Plató
- Platón adatintelligencia
- PlatoData
- populációk
- porció
- pozíció
- helymeghatározás
- pozitron
- gyakorlat
- előkészített
- jelenlét
- előző
- korábban
- Első
- Előzetes
- szonda
- eljárások
- folyamat
- gyárt
- Termékek
- megfelelően
- protokoll
- ad
- biztosít
- amely
- vásárolt
- világítás
- mennyiségi meghatározás
- mennyiségi
- mennyiség
- R
- Sugárzás
- rádió
- hatótávolság
- Arány
- reakció
- reakciók
- real-time
- kapott
- új
- feljegyzett
- felépülés
- Csökkent
- csökkentés
- referencia
- kifinomult
- vidék
- előírások
- vonatkozik
- marad
- megmaradó
- eltávolítása
- eltávolított
- megismétli
- követelmények
- Felbontás
- REST
- kapott
- Kritika
- felül
- Szoba
- futás
- s
- azonos
- beolvasás
- letapogatás
- vizsgál
- SCI
- tudományos
- Képernyő
- Második
- másodperc
- szakaszok
- SEM
- Érzékenység
- készlet
- beállítás
- felépítés
- mutató
- Sigma
- Jel
- jelentős
- Szilícium
- egyetlen
- Méret
- méretek
- Szelet
- Csúszik
- kicsi
- Snap
- szoftver
- megoldások
- Megoldások
- forrás
- különleges
- Spot
- foltok
- állapota
- standard
- szabványok
- kezdet
- Kezdve
- meghatározott
- statisztikusan
- Lépés
- Lépései
- tárolás
- Stratégia
- folyam
- tanult
- tanulmányok
- Tanul
- elegendő
- kínálat
- megkérdezett
- szintézis
- tart
- technika
- Technologies
- teszt
- mint
- hogy
- A
- akkor
- elméleti
- termikus
- Ezek
- Harmadik
- ezt
- három
- küszöb
- Keresztül
- egész
- idő
- alkalommal
- időbélyeg
- típus
- szövet
- nak nek
- szerszám
- Eszköztár
- Végösszeg
- vágány
- Csomagkövetés
- Átalakítás
- csapdába
- kettő
- Uk
- Bizonytalanság
- alatt
- Váratlan
- egységek
- -ig
- használt
- segítségével
- Vákuum
- érték
- Értékek
- Sebesség
- változat
- Ellen
- vivo
- Feszültség
- kötet
- kötetek
- voxel
- W
- volt
- mosás
- Víz
- voltak
- amikor
- vajon
- ami
- míg
- egész
- lesz
- ablak
- val vel
- belül
- Hozam
- engedett
- így
- zephyrnet
- Postai irányítószám