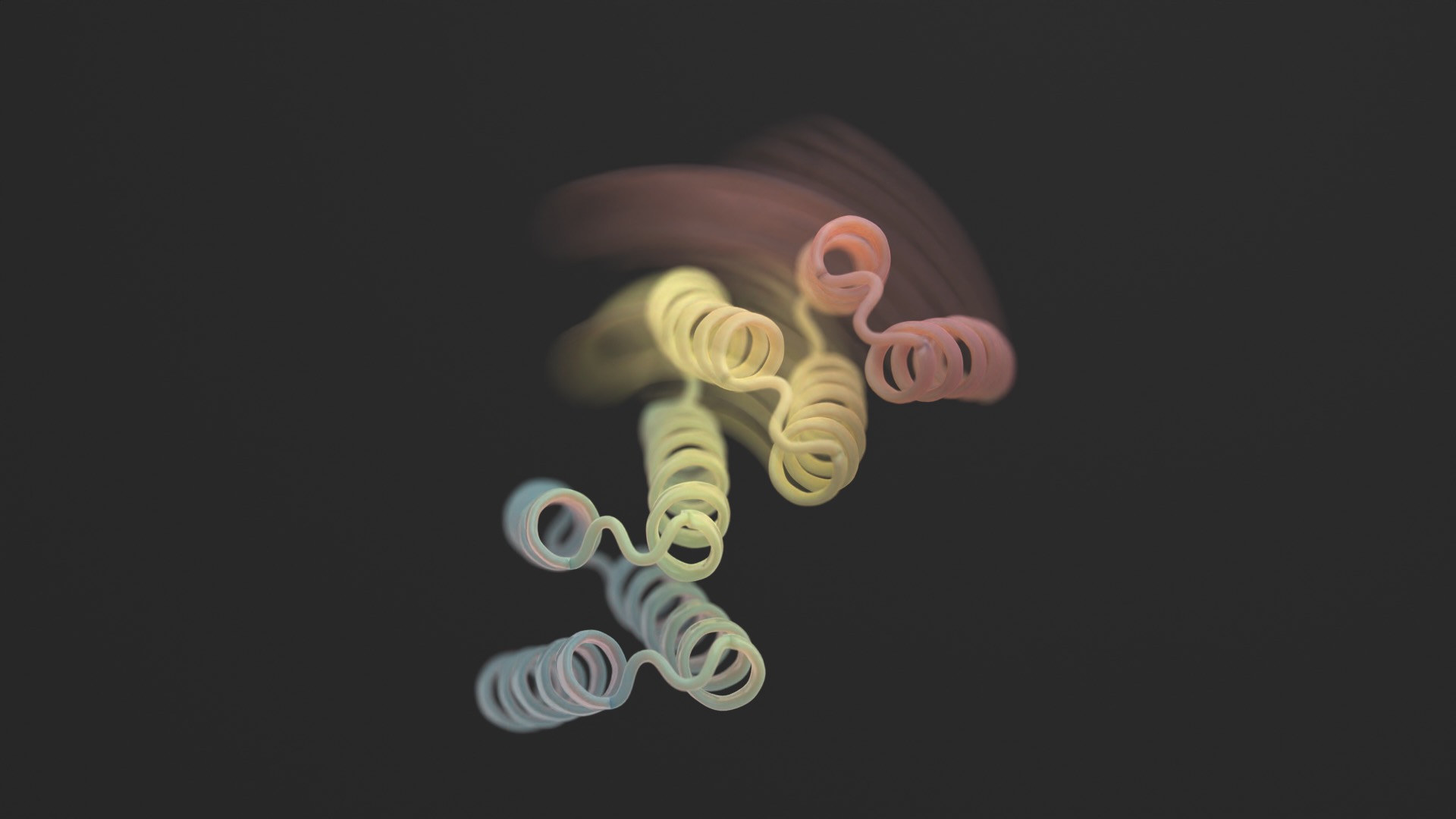
Gyakran úgy gondoljuk, hogy a fehérjék megváltoztathatatlan 3D-s szobrok.
Ez nem egészen helyes. Sok fehérje transzformátor, amely a biológiai szükségletektől függően csavarja és változtatja alakját. Az egyik konfiguráció a szélütés vagy a szívroham káros jeleit továbbíthatja. Egy másik blokkolhatja a keletkező molekuláris kaszkádot, és korlátozhatja a károkat.
Bizonyos értelemben a fehérjék biológiai tranzisztorokként működnek – a test molekuláris „számítógépének” gyökerében található ki-be kapcsolók, amelyek meghatározzák, hogyan reagál a külső és belső erőkre és visszacsatolásokra. A tudósok régóta tanulmányozták ezeket az alakváltó fehérjéket, hogy megfejtsék testünk működését.
De miért csak a természetre hagyatkozna? Létrehozhatunk-e a semmiből a biológiai univerzum számára ismeretlen biológiai „tranzisztorokat”?
Írja be az AI-t. Több mély tanulási módszer már képes pontosan megjósolni a fehérjeszerkezeteketfél évszázados áttörés készül. A későbbi, egyre erősebb algoritmusokat használó tanulmányok hallucinált fehérjestruktúrákat mutattak ki, amelyeket az evolúciós erők nem kötnek le.
Ezeknek a mesterséges intelligencia által generált struktúráknak azonban van egy bukása: bár rendkívül bonyolultak, a legtöbb teljesen statikus – lényegében egyfajta digitális fehérjeszobor, amely az időben megdermedt.
Egy új tanulmány in Tudomány ez a hónap megtörte a penészt azzal, hogy rugalmassá tette a designer fehérjéket. Az új struktúrák nem korlátlanul torzulnak. A tervező fehérjék azonban két különböző formában stabilizálódhatnak – gondoljunk a csuklóra nyitott vagy zárt konfigurációban – egy külső biológiai „zártól” függően. Mindegyik állapot analóg a számítógép „0” vagy „1” értékével, amely ezt követően vezérli a cella kimenetét.
"Korábban csak olyan fehérjéket tudtunk létrehozni, amelyeknek egyetlen stabil konfigurációja volt" - mondta Dr. Florian Praetorius, a tanulmány szerzője, a Washingtoni Egyetem munkatársa. "Most végre létrehozhatunk olyan fehérjéket, amelyek mozognak, ami rendkívüli alkalmazási lehetőségeket nyit meg."
Dr. David Baker, a vezető szerzőnek vannak ötletei: „A környezetben lévő vegyi anyagokra reagáló nanostruktúrák kialakításától a gyógyszerszállítási alkalmazásokig most kezdjük kiaknázni a bennük rejlő lehetőségeket.”
AI-ban készült fehérjeházasság
Egy kis biológia 101.
A fehérjék építik és működtetik testünket. Ezek a makromolekulák a DNS-ből kezdik útjukat. A genetikai információ aminosavakká, egy fehérje építőköveivé alakul át – képgyöngyökké egy húron. Ezután minden szálat bonyolult 3D-s formákká hajtogatnak, egyes részek pedig a többihez tapadnak. Másodlagos struktúráknak nevezett konfigurációk úgy néznek ki, mint a Twizzler. Mások szőnyegszerű lepedőkbe szőnek. Ezek az alakzatok tovább épülnek egymásra, és rendkívül kifinomult fehérjearchitektúrát alkotnak.
Ha megértjük, hogyan nyerik el a fehérjék alakjukat, potenciálisan a semmiből újakat tervezhetünk, kiterjesztve a biológiai univerzumot, és új fegyvereket hozhatunk létre a vírusfertőzések és más betegségek ellen.
Még 2020-ban a DeepMind AlphaFold és David Baker laborja, a RoseTTAFold megtörte a strukturális biológiai internetet azzal, hogy pusztán aminosavszekvenciáik alapján pontosan megjósolta a fehérjeszerkezeteket.
Azóta a mesterséges intelligencia modellek szinte minden ismert – és a tudomány számára ismeretlen – fehérje alakját megjósolták. Ezek a hatékony eszközök máris átformálják a biológiai kutatást, segítve a tudósokat, hogy gyorsan megtalálják a lehetséges célpontokat az antibiotikum rezisztencia elleni küzdelem, tanulmányozza a DNS-ünk „háza”., új vakcinákat kifejleszteni vagy akár az agyat pusztító betegségekre is fényt derítenek, mint pl Parkinson kór.
Aztán jött egy bomba: az olyan generatív mesterséges intelligencia modellek, mint a DALL-E és a ChatGPT, lenyűgöző kilátásokat kínáltak. A fehérjeszerkezetek egyszerű megjóslása helyett miért ne álmodja meg az AI-t teljesen újszerű fehérjeszerkezetek helyett? A kalciumszint szabályozására hormonokat megkötő fehérjétől a mesterséges enzimek amelyek katalizálják a biolumineszcenciát, a kezdeti eredmények lelkesedést váltottak ki, és az AI által tervezett fehérjékben rejlő lehetőségek végtelennek tűntek.
E felfedezések élén Baker laboratóriuma áll. Röviddel a RoseTTAFold kiadása után továbbfejlesztették azt az algoritmust, amellyel a fehérjék funkcionális helyeit szegezték le – ahol az más fehérjékkel, gyógyszerekkel vagy antitestekkel kölcsönhatásba lép –, megnyitva a tudósok előtt az utat kiötöl új gyógyszereket, amelyeket még nem képzeltek el.
Egy dolog azonban hiányzott: a rugalmasság. Számos fehérje „kódeltolódása” alakul ki, hogy megváltoztassák biológiai üzenetüket. Az eredmény szó szerint élet vagy halál lehet: például egy Bax nevű fehérje, megváltoztatja az alakját olyan konformációba, amely sejthalált vált ki. A béta-amiloid, az Alzheimer-kórban szerepet játszó fehérje köztudottan más formát ölt, mivel károsítja az agysejteket.
A hasonló flip-flop fehérjéket hallucináló mesterséges intelligencia közelebb vihet bennünket e biológiai rejtvények megértéséhez és összefoglalásához, ami új orvosi megoldásokhoz vezet.
Zsanér, vonal és süllyesztő
Egyetlen fehérjét atomi szinten megtervezni – és remélni, hogy élő sejtben is működik – nehéz. Egyet két konfigurációval megtervezni egy rémálom.
Laza hasonlatként gondoljunk a felhőben lévő jégkristályokra, amelyek végül hópelyhekké formálódnak, mindegyik más szerkezetű. Az AI feladata, hogy olyan fehérjéket állítson elő, amelyek képesek váltani két különböző „hópehely” között ugyanazon aminosav „jégkristályok” felhasználásával, és mindegyik állapot egy „be” vagy „ki” kapcsolónak felel meg. Ezenkívül a fehérjének jól kell játszania az élő sejtekben.
A csapat több szabállyal indult. Először is, minden egyes szerkezetnek jelentősen eltérőnek kell lennie a két állapot között – például egy álló vagy ülő emberi profilnak. Ezt az atomok közötti távolság mérésével ellenőrizhették – magyarázta a csapat. Másodszor, a változásnak gyorsan kell megtörténnie. Ez azt jelenti, hogy a fehérje nem tud teljesen kibontakozni, mielőtt újra összeállna egy másik formába, ami időbe telik.
Aztán van néhány alapszabály a funkcionális fehérjéhez: mindkét állapotban jól kell játszania a testnedvekkel. Végül kapcsolóként kell működnie, megváltoztatva az alakját a bemenetektől és a kimenetektől függően.
„Ezen tulajdonságok egyetlen fehérjerendszerben való megfelelése kihívást jelent” – mondta a csapat.
Az AlphaFold, a Rosetta és a proteinMPNN keverékének felhasználásával a végső kialakítás úgy néz ki, mint egy zsanér. Két merev része van, amelyek egymáshoz képest mozoghatnak, míg egy másik darab összehajtva marad. Normális esetben a fehérje zárva van. A trigger egy kis peptid – egy rövid aminosavlánc –, amely a csuklópántokhoz kötődik, és kiváltja annak alakváltozását. Ezeket az úgynevezett „effektor peptideket” gondosan megtervezték a specifitás érdekében, csökkentve annak esélyét, hogy megragadjanak a nem célzott részeken.
A csapat először sötétben világító trigger peptideket adott hozzá több csuklópánthoz. A későbbi elemzés megállapította, hogy a kioldó könnyen megragadta a csuklópántot. A fehérje konfigurációja megváltozott. A józanság ellenőrzéseként az alakot korábban AI-analízis segítségével megjósolták.
A fehérjetervek kristályos szerkezetét alkalmazó további vizsgálatok, akár effektorral, akár anélkül, tovább erősítették az eredményeket. Ezek a tesztek felkutatták azokat a tervezési elveket is, amelyek a csuklópánt működését tették, és azokat a paramétereket, amelyek az egyik állapotot a másikba billentik.
Az elvitel? A mesterséges intelligencia immár két különböző állapotú fehérjéket tud tervezni – alapvetően biológiai tranzisztorokat épít a szintetikus biológia számára. Egyelőre a rendszer csak egyedi tervezésű effektor peptideket használ vizsgálatai során, ami korlátozhatja a kutatási és klinikai potenciált. A csapat szerint azonban a stratégia kiterjedhet a természetes peptidekre is, például azokra, amelyek megkötik a vércukorszint szabályozásában részt vevő fehérjéket, szabályozzák a szövetekben lévő vizet, vagy befolyásolják az agyi aktivitást.
"Az elektronikus áramkörök tranzisztorokhoz hasonlóan a kapcsolókat külső kimenetekhez és bemenetekhez csatlakoztathatjuk, hogy érzékelőeszközöket hozzunk létre, és beépítsük őket nagyobb fehérjerendszerekbe" - mondta a csapat.
A tanulmány szerzője, Dr. Philip Leung hozzáteszi: „Ez ugyanúgy forradalmasíthatja a biotechnológiát, ahogyan a tranzisztorok átalakították az elektronikát.”
A kép forrása: Ian C Haydon / UW Institute for Protein Design
- SEO által támogatott tartalom és PR terjesztés. Erősödjön még ma.
- PlatoData.Network Vertical Generative Ai. Erősítse meg magát. Hozzáférés itt.
- PlatoAiStream. Web3 Intelligence. Felerősített tudás. Hozzáférés itt.
- PlatoESG. Autóipar / elektromos járművek, Carbon, CleanTech, Energia, Környezet, Nap, Hulladékgazdálkodás. Hozzáférés itt.
- PlatoHealth. Biotechnológiai és klinikai vizsgálatok intelligencia. Hozzáférés itt.
- ChartPrime. Emelje fel kereskedési játékát a ChartPrime segítségével. Hozzáférés itt.
- BlockOffsets. A környezetvédelmi ellentételezési tulajdon korszerűsítése. Hozzáférés itt.
- Forrás: https://singularityhub.com/2023/08/22/ai-can-now-design-proteins-that-behave-like-biological-transistors/
- :van
- :is
- :nem
- $ UP
- 2020
- 3d
- a
- AC
- Szerint
- pontosan
- törvény
- tevékenység
- hozzáadott
- hozzáadásával
- Ezen kívül
- Hozzáteszi
- Után
- ellen
- AI
- AI modellek
- algoritmus
- algoritmusok
- Minden termék
- kizárólag
- már
- Is
- Bár
- Alzheimer-kór
- amiloid
- an
- elemzés
- és a
- Másik
- alkalmazások
- VANNAK
- AS
- At
- támadás
- szerző
- el
- vissza
- pék
- alapján
- BE
- előtt
- kezdődött
- kezdődik
- beta
- között
- kötődik
- biológia
- biotechnológia
- Bit
- Blokk
- Blocks
- vér
- testületek
- mindkét
- Agy
- Agyi tevékenység
- agysejtek
- áttörés
- Törött
- épít
- Épület
- de
- by
- hívott
- jött
- TUD
- gondosan
- vízesések
- katalizál
- sejt
- Cellák
- Század
- lánc
- kihívást
- esély
- változik
- megváltozott
- változó
- ChatGPT
- ellenőrizze
- vegyszerek
- Klinikai
- zárt
- közelebb
- felhő
- teljesen
- Configuration
- ellenőrzések
- Megfelelő
- tudott
- Pár
- teremt
- létrehozása
- hitel
- dall's
- káros
- David
- Halál
- Megfejtés
- mély
- mély tanulás
- DeepMind
- kézbesítés
- attól
- Design
- tervezési elvek
- tervezett
- Tervező
- tervezés
- tervek
- meghatározó
- fejlett
- Eszközök
- különböző
- digitális
- betegség
- betegségek
- dna
- le-
- bukás
- dr
- álom
- gyógyszer
- Kábítószer-szállítás
- Kábítószer
- minden
- könnyen
- él
- effektor
- bármelyik
- Elektronikus
- Elektronika
- Végtelen
- mérnök
- lelkesedés
- Környezet
- Még
- végül is
- Minden
- evolúció
- példa
- bővülő
- magyarázható
- terjed
- külső
- rendkívüli
- GYORS
- Visszacsatolás
- utolsó
- Végül
- vezetéknév
- Rugalmasság
- A
- erők
- forma
- talált
- ból ből
- fagyasztva
- funkció
- funkcionális
- további
- Nyereség
- nemző
- Generatív AI
- irányelvek
- kellett
- fél
- történik
- Kemény
- kárt
- ártalmak
- Legyen
- Szív
- Szívroham
- segít
- nagyon
- Zsanér
- remélve
- Hogyan
- azonban
- HTTPS
- emberi
- ICE
- ötletek
- képzelt
- változhatatlan
- in
- bele
- egyre inkább
- Fertőzések
- befolyás
- információ
- kezdetben
- bemenet
- belső
- helyette
- Intézet
- kölcsönhatásba lép
- belső
- Internet
- bele
- részt
- IT
- ITS
- maga
- Munka
- utazás
- éppen
- labor
- nagy
- nagyobb
- tanulás
- szintek
- élet
- fény
- mint
- LIMIT
- határértékek
- vonal
- élő
- Hosszú
- néz
- hasonló
- MEGJELENÉS
- leeresztés
- készült
- csinál
- sok
- Lehet..
- eszközök
- mérő
- orvosi
- üzenet
- mód
- hiányzó
- keverje
- modellek
- molekuláris
- Hónap
- a legtöbb
- mozog
- többszörös
- Természetes
- Természet
- igények
- Új
- szép
- NIH
- rendszerint
- Most
- szám
- of
- felajánlott
- gyakran
- on
- ONE
- azok
- csak
- nyitva
- or
- Más
- Egyéb
- mi
- teljesítmény
- paraméterek
- alkatrészek
- darab
- Plató
- Platón adatintelligencia
- PlatoData
- játszani
- potenciális
- potenciálisan
- erős
- előre
- jósolt
- előrejelzésére
- korábban
- elvek
- profil
- ingatlanait
- kilátás
- Fehérje
- Fehérjék
- Quick
- gyorsan
- hatótávolság
- Inkább
- reagál
- Szabályoz
- szabályozó
- relatív
- felszabadító
- támaszkodnak
- maradványok
- kutatás
- Reagálni
- eredményez
- kapott
- Eredmények
- forradalmasítani
- jobb
- merev
- gyökér
- szabályok
- futás
- Mondott
- azonos
- Tudomány
- tudósok
- kaparni
- Második
- másodlagos
- Úgy tűnt
- számos
- Alak
- formák
- fészer
- váltás
- rövid
- Hamarosan
- kellene
- jelek
- hasonló
- egyszerűen
- Webhely (ek)
- Ülés
- kicsi
- hópelyhek
- Megoldások
- néhány
- kifinomult
- váltott
- sajátosság
- stabilizálni
- stabil
- Kezdve
- Állami
- Államok
- ragasztás
- Stratégia
- Húr
- szerkezeti
- struktúra
- tanult
- tanulmányok
- Tanulmány
- későbbi
- Később
- ilyen
- cukor
- kapcsoló
- szintetikus
- rendszer
- Systems
- Vesz
- tart
- Érintse
- célok
- csapat
- tesztek
- mint
- hogy
- A
- azok
- Őket
- akkor
- Ott.
- Ezek
- ők
- dolog
- Szerintem
- ezt
- azok
- idő
- típus
- szövetek
- nak nek
- együtt
- szerszámok
- át
- transzformerek
- kiváltó
- csavar
- kettő
- megértés
- Világegyetem
- egyetemi
- a washingtoni egyetem
- ismeretlen
- us
- használ
- segítségével
- érvényesített
- vírusos
- volt
- washington
- Víz
- Út..
- we
- Fegyverek
- Sző
- háló
- voltak
- ami
- míg
- miért
- val vel
- nélkül
- Munka
- művek
- még
- zephyrnet