नॉर्थवेस्टर्न यूनिवर्सिटी के शोधकर्ताओं ने एलर्जी प्रतिक्रियाओं को रोकने के लिए पहली चयनात्मक थेरेपी विकसित की है, जिसकी गंभीरता खुजली वाली पित्ती और आंखों से पानी आने से लेकर सांस लेने में परेशानी और यहां तक कि मृत्यु तक हो सकती है।
नई थेरेपी विकसित करने के लिए, शोधकर्ताओं ने नैनोकणों को एंटीबॉडी से सजाया जो एलर्जी प्रतिक्रियाओं के लिए जिम्मेदार विशिष्ट प्रतिरक्षा कोशिकाओं (जिन्हें मस्त कोशिकाएं कहा जाता है) को बंद करने में सक्षम हैं। नैनोकण में एक एलर्जेन भी होता है जो रोगी की विशिष्ट एलर्जी से मेल खाता है। उदाहरण के लिए, यदि किसी व्यक्ति को मूंगफली से एलर्जी है, तो नैनोकण में मूंगफली प्रोटीन होता है।
इस दो-चरणीय दृष्टिकोण में, एलर्जेन विशिष्ट एलर्जी के लिए जिम्मेदार सटीक मस्तूल कोशिकाओं को संलग्न करता है, और फिर एंटीबॉडी केवल उन कोशिकाओं को बंद कर देते हैं। यह अत्यधिक लक्षित दृष्टिकोण थेरेपी को संपूर्ण प्रतिरक्षा प्रणाली को दबाए बिना विशिष्ट एलर्जी को चुनिंदा रूप से रोकने में सक्षम बनाता है।
एक चूहे के अध्ययन में, थेरेपी ने ध्यान देने योग्य दुष्प्रभाव पैदा किए बिना एलर्जी प्रतिक्रियाओं को रोकने में 100% सफलता प्रदर्शित की।
शोध आज (16 जनवरी) जर्नल में प्रकाशित हुआ था प्रकृति नैनो प्रौद्योगिकी. यह मस्तूल कोशिकाओं को रोकने के लिए पहली नैनोथेरेपी है, इस प्रकार एक विशिष्ट एलर्जेन के प्रति एलर्जी प्रतिक्रिया को रोकती है।
अध्ययन का नेतृत्व करने वाले नॉर्थवेस्टर्न के इवान ए स्कॉट ने कहा, "वर्तमान में, मस्तूल कोशिकाओं को विशेष रूप से लक्षित करने के लिए कोई विधियां उपलब्ध नहीं हैं।" “हमारे पास लक्षणों का इलाज करने के लिए केवल एंटीहिस्टामाइन जैसी दवाएं हैं, और वे एलर्जी को नहीं रोकती हैं। मस्तूल कोशिकाओं के पहले से ही सक्रिय होने के बाद वे हिस्टामाइन के प्रभावों का प्रतिकार करते हैं। यदि हमारे पास विशिष्ट एलर्जी पर प्रतिक्रिया करने वाली मस्तूल कोशिकाओं को निष्क्रिय करने का कोई तरीका होता, तो हम एनाफिलेक्सिस जैसी गंभीर स्थितियों में खतरनाक प्रतिरक्षा प्रतिक्रियाओं के साथ-साथ मौसमी एलर्जी जैसी कम गंभीर प्रतिक्रियाओं को भी रोक सकते थे।
सबसे बड़ी अधूरी जरूरत एनाफिलेक्सिस है, जो जीवन के लिए खतरा हो सकती है। मौखिक इम्यूनोथेरेपी के कुछ रूप कुछ मामलों में सहायक हो सकते हैं, लेकिन वर्तमान में हमारे पास कोई एफडीए-अनुमोदित उपचार विकल्प नहीं है जो अपमानजनक भोजन या एजेंट से बचने के अलावा ऐसी प्रतिक्रियाओं को लगातार रोकता है। अन्यथा, गंभीर प्रतिक्रियाओं के इलाज के लिए एपिनेफ्रिन जैसे उपचार दिए जाते हैं -; उन्हें रोकें नहीं. क्या यह बहुत अच्छा नहीं होगा अगर खाद्य एलर्जी के लिए एक सुरक्षित और प्रभावी उपचार होता जो लगातार उस भोजन को आहार में दोबारा शामिल करना संभव बनाता जिससे आप सख्ती से परहेज करते थे?
नॉर्थवेस्टर्न के डॉ. ब्रूस बोचनर, एलर्जी विशेषज्ञ और अध्ययन के सह-लेखक
स्कॉट नॉर्थवेस्टर्न के मैककॉर्मिक स्कूल ऑफ इंजीनियरिंग में बायोमेडिकल इंजीनियरिंग के के डेविस प्रोफेसर हैं और सिम्पसन क्वेरी इंस्टीट्यूट फॉर बायोनैनोटेक्नोलॉजी और इंटरनेशनल इंस्टीट्यूट फॉर नैनोटेक्नोलॉजी के सदस्य हैं। बोचनर नॉर्थवेस्टर्न यूनिवर्सिटी फीनबर्ग स्कूल ऑफ मेडिसिन में मेडिसिन (एलर्जी और इम्यूनोलॉजी) के सैमुअल एम. फीनबर्ग एमेरिटस प्रोफेसर हैं। पेपर के पहले लेखक फैनफैन डू हैं, जो स्कॉट की प्रयोगशाला में पोस्टडॉक्टरल फेलो हैं, जिन्होंने सह-प्रथम लेखक क्लेटन रिशे, पीएच.डी. के साथ मिलकर काम किया है। बोचनर और स्कॉट, और यांग ली, पीएच.डी. दोनों द्वारा सह-प्रशिक्षित उम्मीदवार। स्कॉट लैब में उम्मीदवार।
पेचीदा लक्ष्य
मानव शरीर के लगभग सभी ऊतकों में स्थित, मस्तूल कोशिकाएं एलर्जी प्रतिक्रियाओं के लिए मुख्य रूप से जिम्मेदार होने के लिए जानी जाती हैं। लेकिन वे रक्त प्रवाह के नियमन और परजीवियों से लड़ने सहित कई अन्य महत्वपूर्ण भूमिकाएँ भी निभाते हैं। इसलिए, एलर्जी प्रतिक्रियाओं को रोकने के लिए मस्तूल कोशिकाओं को पूरी तरह से नष्ट करना अन्य उपयोगी, स्वस्थ प्रतिक्रियाओं के लिए हानिकारक हो सकता है।
बोचनर ने कहा, "हालांकि कुछ दवाएं विकास के अधीन हैं, लेकिन वर्तमान में कोई एफडीए-अनुमोदित दवाएं नहीं हैं जो मस्तूल कोशिकाओं को रोकती हैं, या खत्म करती हैं।" "यह मुख्य रूप से कठिन रहा है क्योंकि जो दवाएं मस्तूल कोशिका सक्रियण या अस्तित्व को प्रभावित कर सकती हैं वे मस्तूल कोशिकाओं के अलावा अन्य कोशिकाओं को भी लक्षित करती हैं, और इस प्रकार अन्य कोशिकाओं पर प्रभाव के कारण अवांछित दुष्प्रभाव होते हैं।"
पिछले काम में, बोचनर ने सिगलेक-6 की पहचान की, जो एक अद्वितीय अवरोधक रिसेप्टर है जो मस्तूल कोशिकाओं पर अत्यधिक और चुनिंदा रूप से पाया जाता है। यदि शोधकर्ता एंटीबॉडी के साथ उस रिसेप्टर को लक्षित कर सकते हैं, तो वे एलर्जी को रोकने के लिए मस्तूल कोशिकाओं को चुनिंदा रूप से रोक सकते हैं। लेकिन इस एंटीबॉडी का परिचय अपने आप में कम हो गया।
स्कॉट ने कहा, "प्रभाव के लिए एंटीबॉडी की पर्याप्त उच्च सांद्रता प्राप्त करना मुश्किल था।" “हमें आश्चर्य हुआ कि क्या हम नैनोकण का उपयोग करके इस सांद्रता को बढ़ा सकते हैं। यदि हम एंटीबॉडी के उच्च घनत्व को नैनोकण में पैक कर सकते हैं, तो हम इसे उपयोग के लिए व्यावहारिक बना सकते हैं।
किसी कण पर एंटीबॉडी चिपकाना
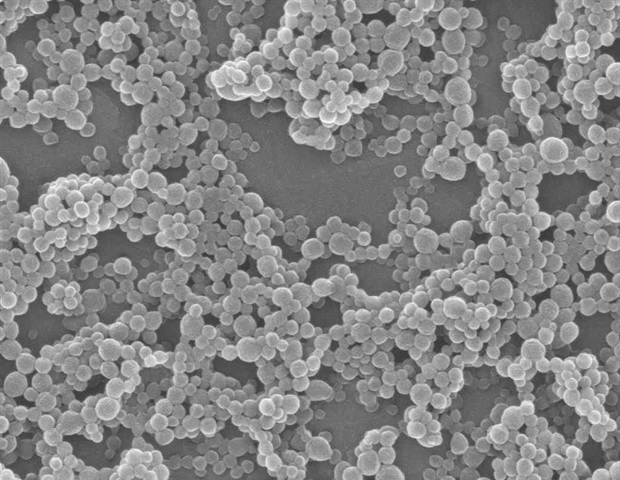
एंटीबॉडी को नैनोकण में पैक करने के लिए, स्कॉट और उनकी टीम को एक और चुनौती से पार पाना था। प्रोटीन (एंटीबॉडी की तरह) को नैनोकणों से चिपकने के लिए, उन्हें आम तौर पर एक रासायनिक बंधन बनाना होगा जो प्रोटीन को खोलता है (या विकृत करता है), जिससे इसकी जैविक गतिविधि प्रभावित होती है। इस चुनौती को दरकिनार करने के लिए, स्कॉट ने अपनी प्रयोगशाला में पहले से विकसित एक नैनोकण की ओर रुख किया।
स्थिर सतहों वाले अधिक मानक नैनोकणों के विपरीत, स्कॉट के नव विकसित नैनोकणों में गतिशील बहुलक श्रृंखलाएं शामिल हैं, जो विभिन्न सॉल्वैंट्स और प्रोटीन के संपर्क में आने पर स्वतंत्र रूप से अपनी दिशा बदल सकती हैं। जब तरल समाधानों में डाला जाता है, तो श्रृंखलाएं पानी के अणुओं के साथ अनुकूल इलेक्ट्रोस्टैटिक इंटरैक्शन प्राप्त करने के लिए खुद को उन्मुख करती हैं। लेकिन जब एक प्रोटीन नैनोकणों की सतह को छूता है, तो इंटरफ़ेस पर विशिष्ट छोटी बहुलक श्रृंखलाएं सहसंयोजक बंधन के बिना प्रोटीन को स्थिर रूप से पकड़ने के लिए अपनी दिशा बदल देती हैं। स्कॉट की टीम ने यह भी पाया कि प्रोटीन सतहों पर जल-विकर्षक पॉकेट स्थिर अंतःक्रिया के लिए महत्वपूर्ण थे।
सतहों से जुड़ते समय, प्रोटीन आमतौर पर विकृत हो जाते हैं और अपनी जैव सक्रियता खो देते हैं। स्कॉट के नैनोकणों का एक अनूठा पहलू यह है कि वे अपनी 3डी संरचना और जैविक कार्यों को बनाए रखते हुए एंजाइम और एंटीबॉडी को मजबूती से बांध सकते हैं। इसका मतलब यह है कि एंटी-सिग्लेक-6 एंटीबॉडी ने मस्तूल सेल रिसेप्टर्स के लिए अपनी मजबूत आत्मीयता बनाए रखी -; नैनोकण सतहों से जुड़े होने पर भी।
स्कॉट ने कहा, "यह एक विशिष्ट गतिशील सतह है।" “एक मानक स्थिर सतह के बजाय, यह अपनी सतह रसायन विज्ञान को बदल सकता है। यह यौगिकों की छोटी बहुलक श्रृंखलाओं से बना है, जो आवश्यकतानुसार पानी और प्रोटीन दोनों के साथ अनुकूल बातचीत को अधिकतम करने के लिए अपने अभिविन्यास को बदल सकते हैं।
जब स्कॉट की टीम ने नैनोकणों को एंटीबॉडी के साथ मिलाया, तो लगभग 100% एंटीबॉडी अपने विशिष्ट लक्ष्यों से जुड़ने की क्षमता खोए बिना नैनोकणों से सफलतापूर्वक जुड़ गए। इसके परिणामस्वरूप नैनोकण-आधारित थेरेपी में मस्तूल कोशिकाओं को लक्षित करने के लिए कई अलग-अलग एंटीबॉडी की घनी पैक और अत्यधिक नियंत्रणीय मात्रा वाली सतहों को नियोजित किया गया।
चयनात्मक बंद करें
किसी को एलर्जी होने के लिए, उनकी मस्तूल कोशिकाएं उस विशिष्ट एलर्जेन के लिए एंटीबॉडी, विशेष रूप से इम्युनोग्लोबुलिन ई (आईजीई) एंटीबॉडी को पकड़ती हैं और प्रदर्शित करती हैं। यह मस्तूल कोशिकाओं को पहचानने में सक्षम बनाता है -; और प्रतिक्रिया दें -; दोबारा संपर्क में आने पर वही एलर्जेन।
स्कॉट ने कहा, "यदि आपको मूंगफली से एलर्जी है और अतीत में मूंगफली के प्रति प्रतिक्रिया हुई है, तो आपकी प्रतिरक्षा कोशिकाओं ने मूंगफली प्रोटीन के खिलाफ आईजीई एंटीबॉडी बनाई और मस्तूल कोशिकाओं ने उन्हें एकत्र किया।" “अब, वे आपके दूसरी मूंगफली खाने का इंतज़ार कर रहे हैं। जब आप ऐसा करते हैं, तो वे मिनटों के भीतर प्रतिक्रिया दे सकते हैं, और यदि प्रतिक्रिया पर्याप्त मजबूत है, तो इसका परिणाम एनाफिलेक्सिस हो सकता है।
किसी विशेष एलर्जेन पर प्रतिक्रिया करने के लिए मस्तूल कोशिकाओं को चुनिंदा रूप से लक्षित करने के लिए, शोधकर्ताओं ने उस एलर्जेन के लिए आईजीई एंटीबॉडी ले जाने वाली केवल मस्तूल कोशिकाओं को शामिल करने के लिए अपनी थेरेपी डिजाइन की। नैनोकण मस्तूल कोशिकाओं पर IgE एंटीबॉडी के साथ जुड़ने के लिए एक प्रोटीन एलर्जेन का उपयोग करता है और फिर मस्तूल कोशिका की प्रतिक्रिया करने की क्षमता को बंद करने के लिए सिगलेक -6 रिसेप्टर को संलग्न करने के लिए एक एंटीबॉडी का उपयोग करता है। और क्योंकि केवल मस्तूल कोशिकाएं सिगलेक-6 रिसेप्टर्स प्रदर्शित करती हैं, नैनोकण अन्य प्रकार की कोशिकाओं से बंध नहीं सकता है -; एक ऐसी रणनीति जो दुष्प्रभावों को प्रभावी ढंग से सीमित करती है।
स्कॉट ने कहा, "आप अपनी इच्छानुसार किसी भी एलर्जेन का उपयोग कर सकते हैं, और आप उस एलर्जेन की प्रतिक्रिया को चुनिंदा रूप से बंद कर देंगे।" “एलर्जेन आम तौर पर मस्तूल कोशिका को सक्रिय करेगा। लेकिन साथ ही एलर्जेन बंधता है, नैनोकण पर एंटीबॉडी निरोधात्मक सिगलेक-6 रिसेप्टर को भी संलग्न करता है। इन दो विरोधाभासी संकेतों को देखते हुए, मस्तूल कोशिका निर्णय लेती है कि उसे सक्रिय नहीं होना चाहिए और उस एलर्जेन को अकेला छोड़ देना चाहिए। यह किसी विशिष्ट एलर्जेन के प्रति प्रतिक्रिया को चुनिंदा रूप से रोकता है। इस दृष्टिकोण की खूबी यह है कि इसमें सभी मस्तूल कोशिकाओं को मारने या ख़त्म करने की आवश्यकता नहीं होती है। और, सुरक्षा के दृष्टिकोण से, यदि नैनोकण गलती से गलत सेल प्रकार से जुड़ जाता है, तो वह सेल प्रतिक्रिया नहीं देगा।
चूहों में एनाफिलेक्सिस को रोकना
मानव ऊतक-व्युत्पन्न मस्तूल कोशिकाओं का उपयोग करके सेलुलर संस्कृतियों में सफलता का प्रदर्शन करने के बाद, शोधकर्ताओं ने अपनी थेरेपी को मानवकृत माउस मॉडल में स्थानांतरित कर दिया। चूँकि चूहों में मस्तूल कोशिकाओं में सिगलेक-6 रिसेप्टर नहीं होता है, बोचनर की टीम ने उनके ऊतकों में मानव मस्तूल कोशिकाओं के साथ एक माउस मॉडल विकसित किया है। शोधकर्ताओं ने चूहों को एक एलर्जेन के संपर्क में लाया और उसी समय नैनोथेरेपी दी।
किसी भी चूहे को एनाफिलेक्टिक झटका नहीं लगा और सभी बच गए।
स्कॉट ने कहा, "एलर्जी की प्रतिक्रिया पर नजर रखने का सबसे आसान तरीका शरीर के तापमान में बदलाव को ट्रैक करना है।" “हमने तापमान में कोई बदलाव नहीं देखा। कोई प्रतिक्रिया नहीं हुई. इसके अलावा, चूहे स्वस्थ रहे और उनमें एलर्जी की प्रतिक्रिया के कोई बाहरी लक्षण दिखाई नहीं दिए।'
बोचनर ने कहा, "मनुष्यों की तरह माउस मस्तूल कोशिकाओं की सतह पर सिगलेक-6 नहीं होता है, लेकिन विशेष चूहों में इन नैनोकणों का परीक्षण करके हम वास्तविक मानव अध्ययन के जितना करीब हो सकते थे, पहुंच गए हैं," बोचनर ने कहा। . "हम यह दिखाने में सक्षम थे कि इन मानवकृत चूहों को एनाफिलेक्सिस से बचाया गया था।"
इसके बाद, शोधकर्ता अन्य मस्तूल कोशिका-संबंधित बीमारियों के इलाज के लिए अपनी नैनोथेरेपी का पता लगाने की योजना बना रहे हैं, जिसमें मास्टोसाइटोसिस, मस्तूल कोशिका कैंसर का एक दुर्लभ रूप भी शामिल है। वे अन्य प्रकार की कोशिकाओं को नुकसान पहुंचाए बिना मास्टोसाइटोसिस में मस्तूल कोशिकाओं को चुनिंदा रूप से मारने के लिए नैनोकणों के अंदर दवाओं को लोड करने के तरीकों की भी जांच कर रहे हैं।
अध्ययन, "कई बायोएक्टिव प्रोटीन का नियंत्रित सोखना लक्षित मस्तूल सेल नैनोथेरेपी को सक्षम बनाता है," नेशनल इंस्टीट्यूट ऑफ बायोमेडिकल इमेजिंग एंड बायोइंजीनियरिंग (अनुदान संख्या 1R01EB030629-01A1) और नेशनल इंस्टीट्यूट ऑफ एलर्जी एंड इंफेक्शियस डिजीज (अनुदान संख्या R21AI159586) द्वारा समर्थित था।
डू, एफ., एट अल. (2024)। कई बायोएक्टिव प्रोटीन का नियंत्रित अवशोषण लक्षित मस्तूल सेल नैनोथेरेपी को सक्षम बनाता है। प्रकृति नैनो प्रौद्योगिकी. doi.org/10.1038/s41565-023-01584-z.
- एसईओ संचालित सामग्री और पीआर वितरण। आज ही प्रवर्धित हो जाओ।
- प्लेटोडेटा.नेटवर्क वर्टिकल जेनरेटिव एआई। स्वयं को शक्तिवान बनाएं। यहां पहुंचें।
- प्लेटोआईस्ट्रीम। Web3 इंटेलिजेंस। ज्ञान प्रवर्धित। यहां पहुंचें।
- प्लेटोईएसजी. कार्बन, क्लीनटेक, ऊर्जा, पर्यावरण, सौर, कचरा प्रबंधन। यहां पहुंचें।
- प्लेटोहेल्थ। बायोटेक और क्लिनिकल परीक्षण इंटेलिजेंस। यहां पहुंचें।
- स्रोत: https://www.news-medical.net/news/20240116/Breakthrough-nano-shield-blocks-selective-allergic-reactions.aspx
- :हैस
- :है
- :नहीं
- 16
- 2024
- 3d
- a
- क्षमता
- योग्य
- पाना
- सक्रिय
- सक्रियण
- गतिविधि
- वास्तविक
- को प्रभावित
- प्रभावित करने वाले
- बाद
- के खिलाफ
- एजेंट
- सब
- एलर्जी
- एलर्जी
- अकेला
- पहले ही
- भी
- हालांकि
- राशियाँ
- an
- और
- अन्य
- एंटीबॉडी
- एंटीबॉडी
- कोई
- दृष्टिकोण
- दृष्टिकोण
- हैं
- AS
- पहलू
- At
- लेखक
- लेखकों
- उपलब्ध
- से बचने
- से बचने
- BE
- सुंदरता
- क्योंकि
- बन
- किया गया
- जा रहा है
- BEST
- सबसे बड़ा
- बाँध
- बंधन
- बायोमेडिकल
- ब्लॉक
- रक्त
- परिवर्तन
- बंधन
- के छात्रों
- सफलता
- साँस लेने
- ब्रूस
- लेकिन
- by
- उपमार्ग
- बुलाया
- कर सकते हैं
- कैंसर
- उम्मीदवार
- नही सकता
- सक्षम
- कब्जा
- ले जाने के
- मामलों
- के कारण
- सेल
- कोशिकाओं
- सेलुलर
- कुछ
- चेन
- चुनौती
- परिवर्तन
- रासायनिक
- रसायन विज्ञान
- समापन
- निकट से
- शामिल
- एकाग्रता
- लगातार
- नियंत्रित
- मेल खाती है
- सका
- प्रतिक्रिया
- वर्तमान में
- हानिकारक
- खतरनाक
- डेविस
- मौत
- दिया गया
- साबित
- प्रदर्शन
- घनत्व
- बनाया गया
- विकसित करना
- विकसित
- विकास
- डीआईडी
- आहार
- विभिन्न
- मुश्किल
- रोग
- रोगों
- डिस्प्ले
- अलग
- do
- कर देता है
- डॉन
- नीचे
- dr
- औषध
- दो
- गतिशील
- e
- खाने
- प्रभाव
- प्रभावी
- प्रभावी रूप से
- प्रभाव
- को खत्म करने
- नष्ट
- रोजगार
- सक्षम बनाता है
- समाप्त
- लगाना
- संलग्न
- अभियांत्रिकी
- बढ़ाना
- पर्याप्त
- संपूर्ण
- ईथर (ईटीएच)
- और भी
- उदाहरण
- अनुभवी
- विशेषज्ञ
- का पता लगाने
- उजागर
- अनावरण
- आंखें
- अनुकूल
- Feinberg
- साथी
- मार पिटाई
- प्रथम
- फ्लिप
- प्रवाह
- भोजन
- के लिए
- प्रपत्र
- रूपों
- पाया
- से
- पूरी तरह से
- कार्यों
- मिल
- दी
- मिला
- अनुदान
- महान
- था
- है
- स्वस्थ
- सहायक
- हाई
- अत्यधिक
- उसके
- पकड़
- http
- HTTPS
- मानव
- मनुष्य
- पहचान
- if
- इमेजिंग
- प्रतिरक्षा
- इम्यून सिस्टम
- इम्मुनोलोगि
- रोग - प्रतिरक्षाचिकित्सा
- महत्वपूर्ण
- in
- सहित
- स्वतंत्र रूप से
- अंदर
- बजाय
- संस्थान
- बातचीत
- बातचीत
- इंटरफेस
- अंतरराष्ट्रीय स्तर पर
- में
- शुरू करने
- IT
- आईटी इस
- खुद
- जॉन
- पत्रिका
- जेपीजी
- केवल
- कुंजी
- हत्या
- हत्या
- जानने वाला
- प्रयोगशाला
- प्रयोगशाला
- छोड़ना
- नेतृत्व
- कम
- li
- पसंद
- सीमाएं
- तरल
- लोड हो रहा है
- हार
- बनाया गया
- मुख्यतः
- को बनाए रखने
- बनाना
- अधिकतम करने के लिए
- साधन
- मेडिकल
- दवाएं
- दवा
- सदस्य
- तरीकों
- चूहों
- मध्यम
- हो सकता है
- मिनट
- मिश्रित
- मोबाइल
- आदर्श
- मॉनिटर
- अधिक
- माउस
- ले जाया गया
- विभिन्न
- चाहिए
- नाम
- नैनो
- राष्ट्रीय
- लगभग
- आवश्यक
- आवश्यकता
- नया
- नए नए
- समाचार
- नहीं
- सामान्य रूप से
- नॉर्थवेस्टर्न यूनिवर्सिटी
- अभी
- संख्या
- of
- on
- केवल
- ऑप्शंस
- or
- मौखिक
- आदेश
- अन्य
- अन्यथा
- काबू
- पैक
- पैक
- काग़ज़
- विशेष
- अतीत
- रोगी
- व्यक्ति
- योजना
- प्लेटो
- प्लेटो डेटा इंटेलिजेंस
- प्लेटोडाटा
- प्ले
- जेब
- बहुलक
- संभव
- व्यावहारिक
- ठीक
- को रोकने के
- रोकने
- पिछला
- पहले से
- मुख्यत
- प्रोफेसर
- संरक्षित
- प्रोटीन
- प्रोटीन
- प्रकाशित
- रखना
- रेंज
- दुर्लभ
- प्रतिक्रिया
- प्रतिक्रिया
- प्रतिक्रियाओं
- रिसेप्टर
- पहचान
- संदर्भ
- विनियमन
- बने रहे
- की आवश्यकता होती है
- अनुसंधान
- शोधकर्ताओं
- प्रतिक्रिया
- प्रतिक्रिया
- प्रतिक्रियाएं
- जिम्मेदार
- परिणाम
- परिणामस्वरूप
- भूमिकाओं
- s
- सुरक्षित
- सुरक्षा
- कहा
- वही
- देखा
- स्कूल के साथ
- अभियांत्रिकी विद्यालय
- स्कॉट
- मौसमी
- चयनात्मक
- गंभीर
- कई
- गंभीर
- तीव्रता
- कम
- चाहिए
- दिखाना
- बंद
- शट डाउन
- पक्ष
- संकेत
- लक्षण
- स्थितियों
- समाधान ढूंढे
- कुछ
- कोई
- सूत्रों का कहना है
- विशेष
- विशिष्ट
- विशेष रूप से
- स्थिर
- मानक
- दृष्टिकोण
- छड़ी
- रुकें
- बंद हो जाता है
- स्ट्रेटेजी
- मजबूत
- संरचना
- पढ़ाई
- अध्ययन
- सफलता
- सफलतापूर्वक
- ऐसा
- समर्थित
- दबा
- सतह
- उत्तरजीविता
- बच गई
- स्विच
- लक्षण
- प्रणाली
- T
- लक्ष्य
- लक्षित
- लक्ष्य
- टीम
- करते हैं
- परीक्षण
- से
- कि
- RSI
- लेकिन हाल ही
- उन
- अपने
- फिर
- चिकित्सा
- वहाँ।
- इसलिये
- इन
- वे
- इसका
- उन
- भर
- इस प्रकार
- पहर
- ऊतकों
- सेवा मेरे
- आज
- छूता
- ट्रैक
- उपचार
- इलाज
- उपचार
- उपचार
- मुसीबत
- बदल गया
- दो
- टाइप
- प्रकार
- आम तौर पर
- के अंतर्गत
- अद्वितीय
- विशिष्ट
- विश्वविद्यालय
- अपूर्ण
- अवांछित
- के ऊपर
- यूआरएल
- उपयोग
- प्रयुक्त
- का उपयोग करता है
- का उपयोग
- इंतज़ार कर रही
- करना चाहते हैं
- था
- पानी
- मार्ग..
- we
- कुंआ
- थे
- कब
- कौन कौन से
- जब
- कौन
- मर्जी
- साथ में
- अंदर
- बिना
- जीत लिया
- काम
- काम किया
- होगा
- नहीं
- गलत
- इसलिए आप
- आपका
- जेफिरनेट