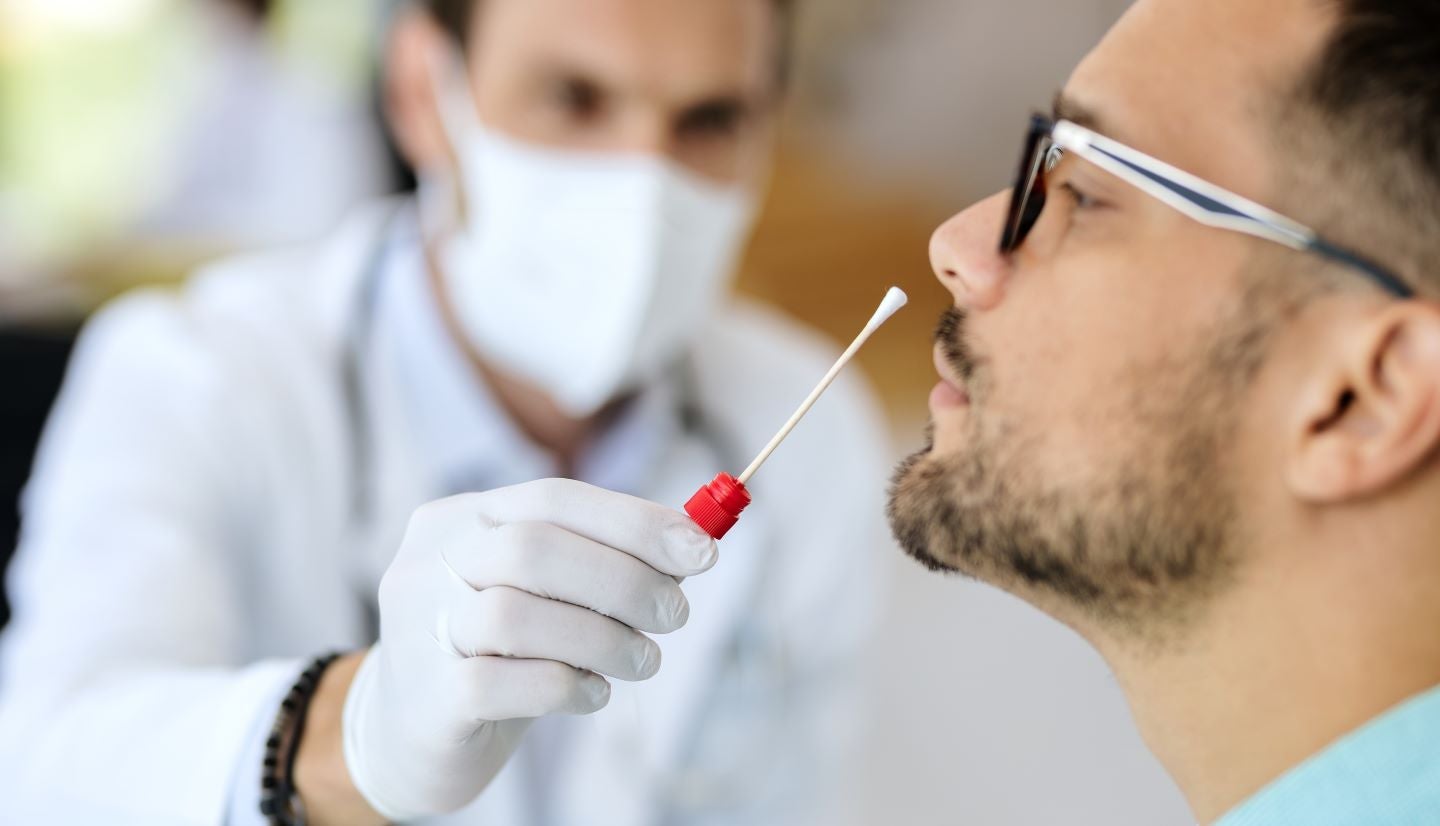
Société de diagnostic moléculaire Co-diagnostics (Co-Dx) a demandé une autorisation d'utilisation d'urgence (EUA) auprès de la Food and Drug Administration (FDA) des États-Unis pour son test Co-Dx PCR Covid-19 avec l'instrument Co-Dx PCR Pro.
La soumission de Co-Dx pour examen par la FDA comprend l’instrument PCR Pro, le test de détection Covid-19 et une application mobile, tous conçus sur mesure pour une utilisation sur le lieu de soins et à domicile.
Le kit de test fonctionne sur la technologie Co-Primers de réaction en chaîne par polymérase (PCR) en temps réel et a démontré la capacité de détecter le Covid-19 à partir d'échantillons d'écouvillonnage nasal antérieur lors d'évaluations cliniques.
De plus, il s'est avéré fournir des résultats sur le smartphone ou l'appareil mobile de l'utilisateur en près de 30 minutes.
Le portefeuille de futurs tests de la société actuellement en développement pour la nouvelle plateforme comprend la tuberculose (TB), le virus du papillome humain (VPH) et un panel respiratoire multiplex capable de détecter la grippe A/B, le Covid-19 et le virus respiratoire syncytial (VRS) de un seul échantillon.
Ces trois tests ont reçu des subventions de divers organismes de financement au cours des six derniers mois de cette année.
Accédez aux profils d’entreprises les plus complets
sur le marché, propulsé par GlobalData. Économisez des heures de recherche. Bénéficiez d’un avantage concurrentiel.

Profil de l'entreprise – gratuit
échantillon
Votre e-mail de téléchargement arrivera sous peu
Nous sommes confiants quant au
expérience unique et authentique
qualité de nos profils d’entreprise. Cependant, nous voulons que vous profitiez au maximum
avantageux
décision pour votre entreprise, nous proposons donc un échantillon gratuit que vous pouvez télécharger par
en soumettant le formulaire ci-dessous
Par GlobalData
Diverses agences de réglementation, dont la FDA, examinent actuellement la plateforme complète Co-Dx PCR comprenant PCR Home, PCR Pro, l'application mobile et le kit de test n'est pas encore disponible dans le commerce.
Le PDG de Co-Diagnostics, Dwight Egan, a déclaré : « Cette nouvelle plateforme technologique constitue une étape importante vers l’avancement de la mission de l’entreprise visant à accroître l’accessibilité des diagnostics PCR.
« En plus du développement de nouvelles technologies à partir de zéro par une équipe de classe mondiale pour décentraliser la technologie de diagnostic PCR et la rendre disponible au point d'intervention et à domicile, il fallait également que la nouvelle technologie pouvoir être commercialisé à un prix pertinent dans le monde entier.
« Les diagnostics, ainsi que les vaccins et les traitements, sont un outil essentiel pour lutter contre des maladies comme la tuberculose, qui reste un problème important en Inde et dans de nombreux autres pays, bien qu'il s'agisse d'une maladie hautement traitable.
L'entreprise se concentre sur le développement et la commercialisation de technologies de diagnostic.
Ces technologies sont exploitées par des tests qui détectent et/ou évaluent les molécules d'acide nucléique, notamment l'ADN et l'ARN.
En novembre de cette année, le l'entreprise a reçu une subvention d'une valeur de 8.97 millions de dollars de la Fondation Bill & Melinda Gates pour soutenir le développement d'un test de dépistage de la tuberculose.
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- PlatoData.Network Ai générative verticale. Autonomisez-vous. Accéder ici.
- PlatoAiStream. Intelligence Web3. Connaissance Amplifiée. Accéder ici.
- PlatonESG. Carbone, Technologie propre, Énergie, Environnement, Solaire, La gestion des déchets. Accéder ici.
- PlatoHealth. Veille biotechnologique et essais cliniques. Accéder ici.
- La source: https://www.medicaldevice-network.com/news/co-dx-fda-eua-covid-test/
- :possède
- :est
- :ne pas
- $UP
- 11
- 30
- 7
- 8
- 9
- a
- Capable
- A Propos
- accessibilité
- ajout
- administration
- de suivre
- agences
- Tous
- le long de
- aussi
- an
- et les
- appli
- Application
- SONT
- article
- Evaluer
- At
- autorisation
- disponibles
- bannière
- BE
- va
- ci-dessous
- avantageux
- Projet de loi
- la performance des entreprises
- by
- CAN
- aptitude
- capable
- CEO
- chaîne
- Infos sur les
- COM
- lutter contre la
- commercialement
- Société
- De l'entreprise
- compétitif
- complet
- comprend
- comprenant
- confiance
- d'exportation
- COVID-19
- crédit
- Tous les jours
- Nouvelles quotidiennes
- décision
- livrer
- Donner des résultats
- démontré
- Malgré
- détecter
- Détection
- développement
- Développement
- dispositif
- diagnostic
- Maladie
- adn
- download
- drogue
- Edge
- urgence climatique.
- fin
- Ether (ETH)
- évaluations
- fda
- se concentre
- nourriture
- Administration des aliments et des médicaments
- Administration des aliments et des médicaments (FDA)
- Pour
- formulaire
- Fondation
- gratuitement ici
- De
- financement
- avenir
- Gain
- Portes
- GlobalData
- subvention
- Vous avez
- aider
- très
- Accueil
- HEURES
- Cependant
- HTTPS
- humain
- ICON
- in
- inclut
- Y compris
- Améliore
- industrie
- Aperçus de l'industrie
- Grippe
- idées.
- instrument
- IT
- SES
- jpg
- kit
- conduisant
- à effet de levier
- comme
- a prendre une
- de nombreuses
- Marché
- Melinda Gates
- minutes
- Mission
- Breeze Mobile
- Application Mobile
- appareil mobile
- mois
- (en fait, presque toutes)
- nasale
- presque
- Nouveauté
- Nouvelle plateforme
- Les nouvelles technologies
- nouvelles
- Newsletter
- Novembre
- of
- code
- on
- exploite
- or
- Institution
- Autre
- nos
- Notre Entreprise
- plus de
- panneau
- passé
- PCR
- plateforme
- technologie de plate-forme
- Platon
- Intelligence des données Platon
- PlatonDonnées
- Point
- portefeuille
- alimenté
- actuellement
- prix
- Pro
- Problème
- Profil
- Profils
- qualité
- réaction
- en temps réel
- reçu
- régulateurs
- pertinent
- reste
- conditions
- un article
- Résultats
- Avis
- examen
- ARN
- VRS
- Saïd
- Épargnez
- Cherche
- Paramétres
- montré
- shutterstock
- significative
- unique
- SIX
- Six mois
- smartphone
- So
- recherché
- Commencer
- étapes
- Soumission
- Support
- SVG
- équipe
- Les technologies
- Technologie
- tester
- tests
- qui
- La
- thérapeutique
- this
- cette année
- trois
- à
- outil
- vers
- expérience unique et authentique
- us
- Nourriture américaine
- utilisé
- Utilisateur
- les vaccins
- divers
- virus
- vital
- souhaitez
- we
- qui
- sera
- comprenant
- Classe mondiale
- partout dans le monde
- vaut
- an
- encore
- you
- Votre
- zéphyrnet