Syöpäpotilaiden hoitaminen spatiaalisesti moduloiduilla säteilysäteillä voi tuhota kasvaimia samalla kun minimoi vauriot läheisille elimille ja terveille kudoksille. Tämä on protoniminisädehoidon (pMBRT) idea. Tämä on uusi hoitotekniikka, joka käyttää submillimetrin kokoisia säteilysäteitä terapeuttisen annoksen antamiseen.
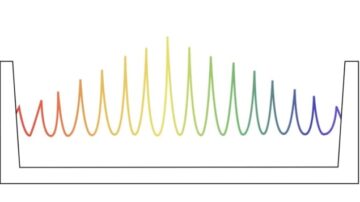
Minisäteet sisältävät vuorotellen suuriannoksisia huippuja ja pieniannoksisia laaksoja, mikä on vähemmän haitallista terveelle kudokselle matalissa syvyyksissä. Suuremmilla syvyyksillä nämä säteet levenevät vähitellen luoden homogeenisen annosjakauman tavoitetilavuuden sisällä. Pienillä eläimillä tehdyt tutkimukset ovat osoittaneet, että pMBRT voi dramaattisesti vähentää normaalia kudostoksisuutta, kanssa vastaava tai parempi tuumorikontrolliverrattuna tavanomaiseen protonihoitoon.
"Protoniminisädehoito on jo osoittanut huomattavan nousun terapeuttisessa indeksissä prekliinisissä tutkimuksissa", sanoo Ramon Ortiz alkaen Institut Curie. "Nämä lupaavat tulokset rohkaisevat tämän tekniikan muuttamista kliiniseen alueeseen." Tätä tarkoitusta varten Ortiz (nykyisin UC San Franciscossa) ja kollegat Institut Curie -instituutista arvioivat pMBRT:n etuja syövän etäpesäkkeiden hoidossa ja raportoivat havainnoistaan Lääketieteellinen fysiikka.
Simuloidaan pMBRT-skenaarioita
Metastaattinen sairaus aiheuttaa jopa 90 % syöpään liittyvistä kuolemista. Metastaasseja hoidetaan yleensä stereotaktisella sädehoitotekniikalla (SRT), mutta paikalliseen hallintaan tarvittavaa annosta rajoittaa usein myrkyllisyyden riski läheiselle normaalille kudokselle. Esimerkiksi aivometastaasien osalta säteilyn aiheuttamaa aivonekroosia on raportoitu puolella SRT:llä hoidetuista potilaista.
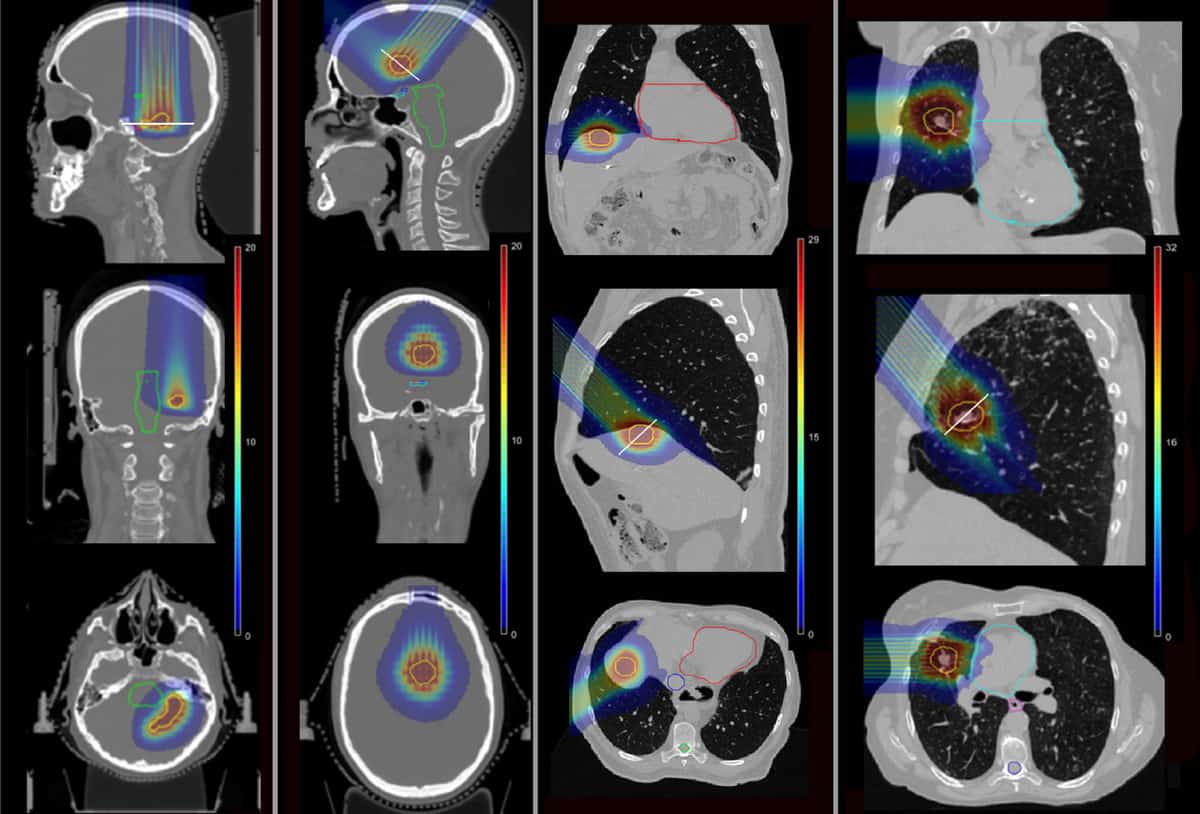
Selvittääkseen, voiko pMBRT vähentää tällaisia komplikaatioita, ryhmä käytti Monte Carlo -simulaatioita laskeakseen annosjakaumat neljälle potilaalle, jotka saivat aiemmin SRT:tä Institut Curie -instituutissa. Potilaita oli hoidettu metastaattisten leesioiden vuoksi aivojen ohimolohkossa, otsalohkossa, maksassa ja keuhkoissa.
Tutkijat simuloivat yhden fraktion pMBRT-suunnitelmia käyttämällä yhtä tai kahta hoitokenttää saman biologisen ekvivalenttiannoksen (BED) antamiseksi kasvainkohteeseen kuin SRT:lle määrättiin. He mallinsivat messinkistä minisädekollimaattoria, joka sisälsi 400 μm × 5.6 cm:n rakoja eri keskipisteen välisissä eroissa luodakseen sekä kapea- että leveämmät minisäteet. Sitten he laskivat annosjakaumat neljälle potilastapaukselle, pMBRT:lle, SRT:lle ja tavanomaiselle protonihoidolle.
Kapeavälisissä pMBRT-suunnitelmissa, jotka luovat tasaisen annosjakauman kohdetilavuudessa, kasvaimen peitto oli samanlainen tai hieman parempi kuin SRT-suunnitelmissa. Suunnitelmissa, joissa käytettiin laajemman välimatkan päässä sijaitsevia pMBRT-säteitä, jotka tuottavat lähes tasaisen annosjakauman kohteeseen, oli pienempi kasvainkattavuus.
Tärkeää on, että pMBRT pienensi merkittävästi kriittisten rakenteiden annosta SRT:hen verrattuna. Ensimmäisessä aivotapauksessa pMBRT alensi keskimääräistä BED-arvoa riskielimiin (OAR) 44 % (oikea akustinen hermo) ja 100 % (vasen akustinen hermo). Toisessa aivohoidossa pMBRT säästi täysin OAR:t, mukaan lukien näkökanavan, aivorungon ja kiasman.
Maksan tapauksessa keskimääräinen BED maksaan ja kylkiluihin pieneni 25 % ja 75 %, samalla kun vältyttiin yläonttolaskimon säteilyltä. Ja keuhkotapauksessa OAR-annosta pienennettiin 11 % (kylkiluut) 100 % (keuhkovaltimo ja keuhkoputket). Keskimääräinen BED OAR:iin oli enimmäkseen samanlainen pMBRT:n ja tavanomaisen protonihoidon välillä.
Tutkijat tutkivat myös pMBRT:n mahdollisia haittavaikutuksia normaaleihin kudoksiin. Esimerkiksi kahdelle aivometastaasitapaukselle he laskivat terveelle aivokudokselle toimitetun annoksen. He harkitsivat annosrajoja standardille fraktioidulle säteilylle, jossa normalisoitu kokonaisannos 2 Gy-fraktiolla (NTD2.0) 72 Gy johtaa 5 %:n todennäköisyyteen radionekroosiin viiden vuoden sisällä.
Kaikissa pMBRT-suunnitelmissa suurin laakso NTD2.0 terveisiin aivoihin (61 Gy(RBE) ohimolohkon tapauksessa ja 47 Gy(RBE) otsalohkon tapauksessa) jäivät tämän annostoleranssikynnyksen alapuolelle, toisin kuin tavanomaisessa protoniterapiassa. Potilailla, joilla oli keuhkojen ja maksan etäpesäkkeitä, keskimääräiset annokset keuhko- ja maksakudoksiin pMBRT-suunnitelmissa olivat myös selvästi alle suurimman siedettävän keskiannoksen.
Kliiniset hyödyt
Tässä tutkimuksessa tarkastellut pMBRT-hoidot toimitettiin käyttämällä vain yhtä tai kahta minisädejärjestelmää. Vähemmän kenttien käyttö kuin SRT-hoidoissa (kolme tai neljä kaaria) vaatii vähemmän potilaan uudelleensijoittamista, lyhentäen fraktiohoitoaikaa sekä pienentämään pienille annoksille altistetun normaalikudoksen määrää. Lisäksi pMBRT:n antaminen yhdessä hoitofraktiossa lyhentää huomattavasti kokonaishoitoaikaa verrattuna SRT-suunnitelmiin, joissa käytettiin kolmesta viiteen fraktiota.

Minisädehoito: fotoneista varautuneisiin hiukkasiin
Tutkijat huomauttavat, että tässä työssä arvioidut pMBRT-suunnitelmat voitaisiin toimittaa kliinisesti käyttämällä Orsay Proton Therapy Centerissä prekliinisissä tutkimuksissa jo toteutettua järjestelyä siten, että kohteen ja elimen liikettä hoidon aikana kontrolloidaan kuten SRT- ja protoniterapiassa.
Ortiz kertoo Fysiikan maailma että Institut Curie keskustelee nyt vaiheen I/II kliinisten tutkimusten mahdollisuudesta. "Nämä arvioisivat hermotoksisuutta ja kasvainten hallintaa toistuvan glioblastooma multiformen hoidossa protoniminisäteillä", hän selittää. "Tämän tutkimuksen tarkoituksena on edistää näiden kliinisten tutkimusten valmistelua."
- SEO-pohjainen sisällön ja PR-jakelu. Vahvista jo tänään.
- Platoblockchain. Web3 Metaverse Intelligence. Tietoa laajennettu. Pääsy tästä.
- Lähde: https://physicsworld.com/a/proton-minibeams-could-improve-treatment-of-cancer-metastases/
- 10
- a
- Tilit
- Lisäksi
- haitallinen
- tavoitteet
- Kaikki
- jo
- ja
- eläimet
- Ryhmä
- välttämällä
- takana
- alle
- Hyödyt
- Paremmin
- välillä
- Aivot
- messinki
- Syöpä
- tapaus
- tapauksissa
- keskus
- peritään
- Kliininen
- kliinisiä tutkimuksia
- työtovereiden
- Pylväät
- yleisesti
- verrattuna
- täysin
- Laskea
- harkittu
- kontrasti
- edistävät
- ohjaus
- hallinnassa
- tavanomainen
- voisi
- kattavuus
- luoda
- kriittinen
- Kuolemat
- toimittaa
- toimitettu
- tuottaa
- syvyydet
- tuhota
- Määrittää
- keskustella
- Sairaus
- jakelu
- Jakaumat
- verkkotunnuksen
- dramaattisesti
- aikana
- vaikutukset
- syntymässä
- kannustaa
- Vastaava
- arvioida
- arvioitu
- esimerkki
- selittää
- avoin
- Fields
- Etunimi
- jae
- Francisco
- alkaen
- Saada
- vähitellen
- suurempi
- Puoli
- haitallinen
- terve
- HTTPS
- ajatus
- kuva
- täytäntöön
- parantaa
- in
- Muilla
- Mukaan lukien
- indeksi
- tiedot
- Tutkimukset
- kysymys
- vain yksi
- Liidit
- rajallinen
- rajat
- Maksa
- paikallinen
- Matala
- max-width
- maksimi
- minimointia
- liike
- luonto
- normaali
- ONE
- avata
- Muut
- hahmoteltu
- potilas
- potilaat
- Kuvio
- vaihe
- Fotonit
- suunnittelu
- suunnitelmat
- Platon
- Platonin tietotieto
- PlatonData
- Kohta
- mahdollisuus
- mahdollinen
- aiemmin
- todennäköisyys
- lupaava
- Säteily
- Sädehoito
- Hinnat
- sai
- vähentää
- Vähentynyt
- vähentää
- vähentämällä
- pysyi
- huomattava
- raportoitu
- tarvitaan
- Vaatii
- Tutkijat
- vastaavasti
- tulokset
- Riski
- sama
- San
- San Francisco
- sanoo
- Toinen
- matala
- esitetty
- merkittävästi
- samankaltainen
- pieni
- standardi
- opinnot
- tutkimus
- niin
- esimies
- Kohde
- joukkue-
- tekniikat
- kertoo
- -
- heidän
- Terapeuttinen
- hoito
- kolmella
- kynnys
- thumbnail
- aika
- kudokset
- että
- toleranssi
- Yhteensä
- Kääntäminen
- käsittelemällä
- hoito
- tutkimuksissa
- totta
- käyttää
- Laakso
- eri
- tilavuus
- volyymit
- onko
- joka
- vaikka
- KUKA
- sisällä
- Referenssit
- olisi
- vuotta
- zephyrnet