Materiaalin valmistelu ja karakterisointi
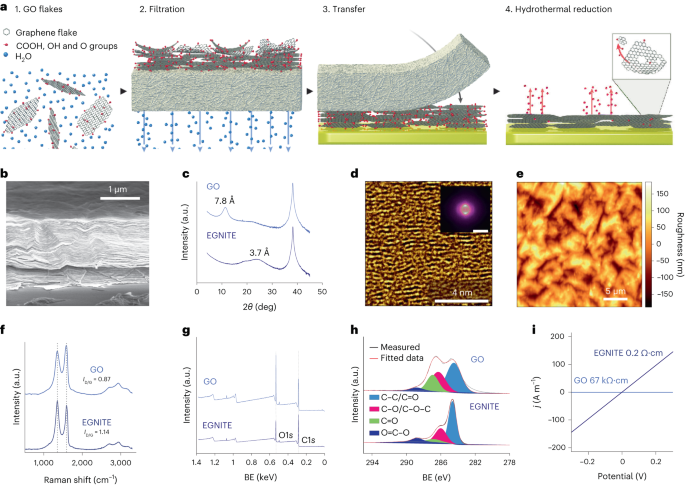
GO:n vesiliuos laimennettiin deionisoituun veteen, jolloin saatiin 0.15 mg/ml-1 liuoksella ja tyhjösuodatetaan nitroselluloosakalvon läpi, jonka huokoset ovat 0.025 µm, muodostaen ohuen GO-kalvon. Ohutkalvo siirrettiin sitten kohdesubstraattiin käyttämällä märkäsiirtoa deionisoidussa vedessä ja edelleen lämpöhehkutusta 100 °C:ssa 2 minuutin ajan. GO-kalvo-substraattipino pelkistettiin hydrotermisesti 134 °C:ssa tavallisessa autoklaavissa 3 tunnin ajan EGNITE:n muodostamiseksi. Perussubstraatti kaikissa EGNITEN karakterisointitutkimuksissa oli neliö (1 × 1 cm2) Si/SiO2 (400 μm/1 μm).
XPS
XPS-mittaukset suoritettiin Phoibos 150 -analysaattorilla (SPECS) erittäin suurissa tyhjiöolosuhteissa (peruspaine, 5 × 10).-10 mbar) monokromaattisella Al Ka -röntgenlähteellä (1,486.74 50 eV). Yleiskuvaspektrit hankittiin päästöenergialla 1 eV ja askelkokolla 20 eV ja korkearesoluutioiset spektrit saatiin päästöenergialla 0.05 eV ja askelkoolla 0.58 eV. Kokonaisresoluutio näissä viimeisissä olosuhteissa on 3 eV, joka on määritetty mittaamalla koko leveys Ag XNUMX:n maksimipuolella.d5/2 piikki sputtered hopeaa. XPS-analyysi osoittaa voimakkaan laskun C–O-piikin hydrotermisen käsittelyn jälkeen (joka liittyy epoksidiryhmiin), mutta pientä C–OH:n, C=O:n ja C(O)OH:n osuutta hydroksyylien, karbonyylien ja karboksyylien vuoksi. jäävät pienennyksen jälkeen. O1:n dekonvoluutios huippu vahvistaa tällaisen käytöksen. Suurin panos C1:eens signaali hydrotermisen pelkistyksen jälkeen tulee kuitenkin sp2 hybridisoidut C-C-orbitaalit34,57.
Röntgendiffraktio
Röntgendiffraktiomittaukset (θ-2θ skannaus) suoritettiin Materials Research Diffractometer -laitteella (Malvern PANalytical). Tässä diffraktometrissä on vaakasuuntainen ω-2θ goniometrin (320 mm säde) neljän ympyrän geometriassa ja työskenteli keraamisella röntgenputkella, jossa oli Cu Ka -anodi (λ = 1.540598 Å). Ilmaisin on Pixcel, joka on Medipix2-tekniikkaan perustuva nopea röntgenilmaisin.
Raman-spektroskopia
Raman-spektroskopiamittaukset suoritettiin käyttämällä Witec-spektrografia, joka oli varustettu 488 nm:n laservirityslinjalla. Mittauksia varten Raman-spektrit hankittiin käyttämällä 50x objektiivia ja 600 uraa per nm hila; laserteho pidettiin alle 1.5 mW näytteen kuumenemisen välttämiseksi.
TEM
EGNITE-näytteen poikkileikkaustutkimusta varten valmistettiin fokusoitu ionisuihkulamelli Helios NanoLab DualBeam -laitteella (LMA-INA). Rakenneanalyysit suoritettiin TEM:n avulla käyttäen Tecnai F20 -mikroskooppia, joka toimi 200 kV jännitteellä, mukaan lukien HRTEM- ja korkeakulmaiset rengasmaiset pimeän kentän STEM-tekniikat. STEM-EELS-koe suoritettiin Tecnai F20 -mikroskoopilla, joka toimi 200 KeV:n jännitteellä, 5 mm aukolla, 30 mm kameran pituudella, konvergenssikulmalla 12.7 mrad ja keräyskulmalla 87.6 mrad. Koska käytimme 0.5 eV pikseliä kohden ja 250 eV lähtöenergiana ydinhäviön hankinnassa, emme saaneet Si K-reunaa odotettua 1,839 2,122 eV:lla, Pt M-reunaa 2,206 100 eV:lla ja Au M-reunaa XNUMX XNUMX eV. Suhteellinen C-O-atomikoostumus on saatu keskittämällä huomiomme pelkistettyyn GO-kerrokseen ja olettaen, että analysoidut reunat (C ja O meidän tapauksessamme) ovat XNUMX %. Tämä oletus pätee meidän tapauksessamme, kuten asiakirjassa osoitetaan Lisätiedot kartat. Energiaeron poikkileikkaus laskettiin Hartree–Slater-mallilla ja tausta teho-low-mallilla.
Sähkönjohtavuus
Sähkönjohtavuusmittaukset suoritettiin Keithley 2400 -lähdemittarilla kaksipistekonfiguraatiossa. Mitatut näytteet koostuivat EGNITE-kalvoista, joiden koko oli 1 × 1 cm2 SiO:n päällä2 substraatti.
Tietojen analysointi
Röntgendiffraktio-, Raman- ja XPS-tiedot analysoitiin käyttämällä Python 3.7 -paketteja (Numpy, Pandas, Scipy, Xrdtools, Lmfit, Rampy, Peakutils, Matplotlib). Tasojen välinen etäisyys laskettiin röntgendiffraktiomittauksista Snellin lain mukaisesti. Kun tiedot siirrettiin spatiaaliseen alueeseen, huippujen enimmäismäärä sovitettiin. Vastaava etäisyys antoi tasojen välisen etäisyyden keskiarvon. Poikkeamat näistä keskiarvoista laskettiin tilatason huippujen Lorentzian sovitusten puolen maksimileveydestä. XPS- ja Raman-spektroskopian mittaukset analysoitiin sovittamalla piikkien konvoluutio oletettuihin paikkoihin vastaaville piirteille. GO:n ja EGNITE:n johtavuusarvot saatiin sovittamalla I-V sähkönjohtavuusmittauksissa mitatut käyrät Ohmin lain mukaan. Tiedot ovat n = 1 jokaiselle mittaukselle.
Joustava sarjan valmistus
Laitteiden valmistus on esitetty lisäkuvassa. 4. Laitteet valmistettiin 4 tuuman Si/SiO:lla2 (400 μm/1 μm) kiekot. Ensin 10 µm paksu kerros PI:tä (PI-2611, HD MicroSystems) kehruupäällystettiin kiekon päälle ja paistettiin typpeä sisältävässä ilmakehässä 350 °C:ssa 30 minuuttia. Metalliset jäljet kuvioitiin käyttämällä optista litografiaa kuvan käänteisfotoresististä (AZ5214, Microchemicals). Elektronisuihkuhaihdutusta käytettiin 20 nm titaanin ja 200 nm:n kullan kerrostamiseen ja suoritettiin nosto. Käytimme noin 1 μm paksua EGNITE-kalvoa kompromissina sähkökemiallisen suorituskyvyn ja ryhmän joustavuuden välillä. GO-kalvon siirtämisen jälkeen alumiini haihdutettiin sähkösuihkulla ja tulevien mikroelektrodien päällä olevat alueet määriteltiin käyttämällä negatiivista fotoresistiä (nLOF 2070, Microchemicals) ja nostettiin pois. Seuraavaksi GO-kalvo syövytettiin kaikkialle paitsi tulevia mikroelektrodeja käyttäen happireaktiivista ionietsausta (RIE) 5 minuutin ajan 500 watin teholla ja suojaavat alumiinipylväät syövytettiin laimennetulla fosfori- ja typpihapon liuoksella. Sitten 3 um paksu kerros PI-2611:tä kerrostettiin kiekolle ja paistettiin kuten aiemmin on kuvattu. Mikroelektrodin PI-2611-aukot määritettiin sitten käyttämällä positiivista paksua fotoresistiä (AZ9260, Microchemicals), joka toimi maskina myöhemmälle happi-RIE:lle. Myöhemmin laitteet kuvioitiin PI-kerrokselle käyttäen jälleen AZ9260 fotoresistiä ja RIE:tä. Fotoresistikerros poistettiin sitten asetonissa ja kiekko puhdistettiin isopropyylialkoholissa ja kuivattiin. Lopuksi laitteet kuorittiin irti kiekosta ja ne olivat valmiita asetettaviksi sterilointipusseihin hydrotermiseksi käsittelyksi 134 °C:ssa tavallisessa autoklaavissa 3 tunnin ajan.
Mikroelektrodin sähkökemiallinen karakterisointi
Mikroelektrodien sähkökemiallinen karakterisointi suoritettiin Metrohm Autolab PGSTAT128N -potentiostaatilla 1 x PBS:ssä (Sigma-Aldrich, P4417), joka sisälsi 10 mM fosfaattipuskuria, 137 mM NaCl:a ja 2.7 mM a7.4-eletrocl-konfiguraatiota. Ag/AgCl-elektrodia (FlexRef, WPI) käytettiin vertailuna ja platinalankaa (Alfa Aesar, 45093) käytettiin vastaelektrodina.
Ennen suorituskyvyn arviointia elektrodit pulssittiin 10,000 1 varaustasapainotetulla pulssilla (15 ms, 100 µA). Elektrodien altistaminen jatkuvalle pulssiprotokollalle eteni 0.9 syklisellä voltammetriasyklillä (−0.8 - +50 V) XNUMX mV s:lla-1, 20 toistoa 5,000 pulssia (1 ms) ja avoimen piirin potentiaalin uudelleenmääritys.
Tietojen analysointi
Sähkökemialliset karakterisointitiedot analysoitiin käyttämällä Python 3.7 -paketteja (Numpy, Pandas, Scipy, Pyeis, Lmfit, Matplotlib). Impedanssispektroskopiatiedot sovitettiin vastaavaan sähkömalliin, joka koostui resistanssista (R) sarjassa vakiovaiheelementin (CPE) kanssa. Sieltä CPE-arvo arvioitiin kapasitanssiksi ja jaettiin mikroelektrodin geometrisella alueella vastaavan arvon saamiseksi EGNITEN rajapintakapasitanssille. Mikroelektrodin varauksen varastointikapasitanssi (CSC) laskettiin syklisistä voltammetriamittauksista integroimalla mitatun virran katodinen ja anodinen järjestelmä ja normalisoimalla skannausnopeudella. Katodisen ja anodisen varauksen tallennuskapasitanssi (cCSC ja aCSC) EGNITEN 100 mV-skannausnopeudella ovat 45.9 ± 2.4 ja 34.6 ± 2.8mC cm-2, vastaavasti (n = 3). Kuten muiden materiaalien kohdalla kerrottiin58, saadut CSC:t riippuvat skannausnopeudesta (lisäkuva 1). 5). Hapen pelkistysreaktioiden läsnäolon arvioimiseksi mittasimme CV-aaltomuodon typellä puhdistetussa elektrolyytissä59 eikä havainnut merkittäviä eroja aaltomuodossa (lisäkuva 1). 6). Tuloksemme eivät kuitenkaan täysin ota huomioon hapen pelkistysreaktioiden vaikutusta EGNITEN varauksen injektiokapasiteettiin, ja tämän asian tutkimiseksi on tehtävä lisätyötä. Mikroelektrodin varausinjektiokapasiteetti (CIC) määritettiin määrittämällä virran pulssiamplitudi, joka sai aikaan jännite-eron (ohmisen pudotuksen poistamisen jälkeen), joka vastasi elektrodin sähkökemiallista vesiikkunaa (-0.9 V katodiselle ja +0.8 V anodiselle vs. Ag/AgCl ) (Lisäkuva. 17)60.
Tilastollinen analyysi
Tiedot ovat keskiarvoa ± s.d., n = 18 EIS:lle ja n = 3 kronopotentiometreille. Katodisen kapasitiivisen jännitteen poikkeaman kartan tiedot ovat katodisen kapasitiivisen jännitteen poikkeamien keskiarvo yhdelle tapahtumalle kullekin pulssimuodolle. n = 3 elektrodia.
Mekaanisen vakauden arviointi
Ultraääni sonikointi
EGNITE-elektrodiryhmät asetettiin vedellä täytettyyn dekantterilasiin ultraäänivesihauteessa (Elmasonic P 180H). Sonikointia käytettiin 37 kHz:llä 15 min ajan 200 W:n teholla, minkä jälkeen sonikoitiin vielä 15 min 37 kHz:llä tehon ollessa 300 W. Elektrodeista otettiin kuvia ennen ja jälkeen sonikoinnin.
Taivutustesti
Taivutuskokoonpano (kuva. 2k) koostui kolmesta lieriömäisestä tangosta; keskimmäinen (halkaisija, 700 µm) laskettiin alas, jolloin taivutuskulmat olivat 131°. Taivutustestissä käytettiin kolmea taipuisaa mikroelektrodiryhmää. Jokainen ryhmä sisälsi 18 mikroelektrodia, joiden halkaisija oli 50 µm. Kaksi ryhmää mitattiin 10 ja 20 jakson jälkeen, kun taas yksi laite mitattiin vain 10 syklin ajan, koska se vaurioitui käsittelyn aikana mittauksen jälkeen. Taivutustestisykli koostui 10 s:n pituisesta kuormituksesta plus 10 s ilman kuormitusta. Laitteet karakterisoitiin sähkökemiallisesti (EIS ja CV) ennen ja jälkeen 10 ja 20 taivutussykliä.
Epikortinen hermotallennus
Epikortinen implantaatio
Kaikki kokeelliset toimenpiteet suoritettiin Euroopan yhteisön neuvoston ja Ranskan koe-eläinten hoitoa ja käyttöä koskevan lainsäädännön suositusten mukaisesti. Pöytäkirjat hyväksyi Grenoblen eettinen komitea (ComEth) ja valtuutti Ranskan ministeriö (numero 04815.02). Sprague-Dawley-rotat (uros, 4 kuukauden ikäinen, paino ~600 g) nukutettiin lihakseen ketamiinilla (50 mg/kg (ruumiinpaino)) ja ksylatsiinilla (10 mg/kg (ruumiinpaino)) ja kiinnitettiin sitten stereotaksiseen pidikkeeseen. Ohimennen kallon poistaminen paljasti kuulokuoren. Dura mater säilytettiin aivokuoren vaurioitumisen välttämiseksi. Vertexiin porattiin reikä referenssielektrodin työntämistä varten ja toinen reikä, 7 mm eteenpäin ensimmäisestä, porattiin maadoituselektrodin työntämistä varten. Elektrodit olivat 0.5 mm paksuja nastoja, joita käytettiin integroitujen piirien pistorasioihin. Ne asetettiin sähköiseen kosketukseen kovakalvon kanssa ja kiinnitettiin kalloon hammassementillä. Asensimme sitten pintamikroelektrodinauhan kuulokuoreen kuvan XNUMX mukaisesti. 3b. Laskimokuviot tunnistavat kuulokuoren Kriegin rotan aivokartan alueella 41. Kortikaaliset signaalit vahvistettiin samanaikaisesti 1,000 vahvistuksella ja digitoitiin 33 kHz:n näytteenottotaajuudella. Kaiutin 20 cm:n etäisyydellä rotan korvan edessä paljastuneen aivokuoren vastakkaisella puolella antoi akustisia ärsykkeitä. Annettuja ärsykkeitä seurattiin 0.25 tuuman mikrofonilla (Brüel & Kjaer, 4939), joka sijoitettiin lähelle korvaa ja esitettiin äänenpainetasolla (dB SPL re 20 μPa). Tutkimme vertex-positiivisia (negatiivisia ylöspäin) keskiviivereaktioita, jotka herättävät vuorottelevat napsautukset 80 dB SPL:llä ja äänipurskeet 70 dB SPL:llä taajuuksilla 5 - 40 kHz, nousu- ja laskuaika 5 ms ja kesto 200 ms.
Tietojen analysointi
Elektrofysiologiset tiedot analysoitiin käyttämällä Python 3.7 -paketteja (Numpy, Pandas, Scipy, Neo, Elephant, Sklearn Matplotlib) ja mukautettua kirjastoa PhyREC (https://github.com/aguimera/PhyREC). R.m.s. arvot laskettiin 20 ms:n liukuvalla ikkunalla yli 200 Hz:n taajuuksilla. Spektrogrammit laskettiin 70 Hz ja 1.1 kHz väliselle alueelle. PSD laskettiin 60 sekuntia jatkuvista tallennuksista. Tietylle elektrodiryhmälle laskettiin kaksi PSD:tä: in vivo (IV) ja post mortem (PM). SNR ilmaistaan dB:inä (20 × ln(rm.s.(IV)/r.m.s.(PM))) ja interpoloidaan 20 pisteelle, jotka ovat logaritmisesti 10 Hz:n ja 1 kHz:n välillä.
Tilastollinen analyysi
Epikortiset hermotiedot esitetään kuvassa. 3 mitataan yksittäisestä eläimestä. Kuvassa 3c, esitetään tiedot 64 elektrodista. Kuvassa 3d, esitetään tiedot kahdesta valitusta elektrodista. Kuvassa 3fPSD ja SNR lasketaan 64 EGNITE-elektrodista ja esitetään keskiarvoina ± s.d. Täydentävässä kuvassa. 12c, d mediaanitiedot on esitetty 192 EGNITE-elektrodista alkaen n = 3 koetta ja 60 platinaelektrodia n = 1 koe.
Aivokuorensisäinen hermoston tallennus
Intrakortikaalinen implantaatio
Eläimet nukutettiin ketamiini/ksylatsiini-seoksella (75:1, 0.35 ml/28 g i.p.) ja tämä tila ylläpidettiin inhalaatiomaskilla, joka antoi 1.5 % isofluraania. Kalloon asetettiin useita mikroruuveja implantin stabiloimiseksi, ja pikkuaivojen päällä olevaa ruuveja käytettiin yleispohjana. Koetin istutettiin prefrontaaliseen aivokuoreen (koordinaatit: AP, 1.5 mm; ML, ±0.5 mm; DV, -1.7 mm bregmasta). Implantaatio suoritettiin päällystämällä koetin maltoosilla (katso alla oleva protokolla) tilapäisen anturin jäykkyyden aikaansaamiseksi ja koettimen asettamisen helpottamiseksi. Anturi tiivistettiin hammassementillä. Anturin liittämiseen sähköfysiologiseen järjestelmään käytettiin TDT-ZifClip-liittimiä pienellä kaapelilla. Leikkauksen jälkeen hiirelle tehtiin 1 viikon toipumisjakso, joka sai analgesia (buprenorfiini) ja anti-inflammatorisia (meloksikaami)hoitoja. Neuraalinen aktiivisuus tallennettiin monikanavaisella Open Ephys -järjestelmällä näytteenottotaajuudella 30 kHz Intan RHD2132 -vahvistimella. Kuulotehtäväkokeet suoritettiin äänieristetyssä laatikossa, jossa kaksi kaiutinta käyttäen protokollia, jotka perustuivat aiemmin kuvattuun työhön.61. Ääniärsyke koostui 15 ms:n pituisesta valkoisen kohinan napsautuksesta, joka toistettiin 100 kertaa (sykliä), joista kukin erotti 5 s (interstimulus-väli). Tehtävän aikana eläin pääsi liikkumaan vapaasti.
Maltoosin jäykisteprotokolla
Maltoosin vesiliuos kuumennetaan lasittumispisteeseen (Tg), välillä 130 - 160°C, käyttämällä keittolevyä tai mikroaaltouunia. Kun maltoosi on viskoosia, anturin takapuoli saatetaan kosketukseen vain maltoosin kanssa. Kun maltoosi jäähtyy, se jäykistää ja jäykistää mittapäätä.
Tietojen analysointi
Jokaisen elektrodin hermosignaalit suodatettiin offline-tilassa SUA:n ja LFP:n erottamiseksi. SUA arvioitiin suodattamalla signaali välillä 450 ja 6,000 4 Hz, ja yksittäisten hermosolujen piikit lajiteltiin käyttämällä pääkomponenttianalyysiä Offline Sorter v.1:llä (Plexon). LFP:iden saamiseksi signaalit näytteistettiin alas 50 kHz:iin, detrendoitiin ja lovisuodatettiin kohinaviivaartefaktien (1 Hz ja sen harmoniset) poistamiseksi räätälöidyillä Pythonin skripteillä. AEP SNR laskettiin huipun N20 amplitudin ja s.d. XNUMX ms:n ajanjaksolta ennen ärsykettä.
Tilastollinen analyysi
Kuvassa näkyvät tiedot. 3h, i ovat keskiarvo ± s.d., n = 30 kokeiden keskiarvona. Samalta elektrodilta tallennetut tiedot esitetään päivinä 30, 60 ja 90. Esitetään tiedot yhdestä eläimestä.
Krooninen epikortikaalinen bioyhteensopivuus
Laitteiden kirurginen implantointi
Tähän tutkimukseen käytettiin yhteensä 27 aikuista urospuolista Sprague-Dawley-rottaa (Charles River). Eläimiä pidettiin ympäristön lämpötilassa 21 ±2 C ja kosteudessa 40-50 % 12 h valo/12 h pimeässä syklissä. Rotat pidettiin ryhmissä ja niille annettiin vapaa pääsy ravintoon ja veteen koko koejakson ajan. Koemenettelyt suoritettiin Animal Welfare Actin (1998) mukaisesti Yhdistyneen kuningaskunnan sisäministeriön ja paikallisen eläinten hyvinvoinnin eettisen arviointielimen (AWERB) hyväksynnällä. Eläimet nukutettiin isofluraanilla (2–3 %) leikkauksen ajan ja anestesian syvyyttä seurattiin varpaiden puristusrefleksitestillä. Eläimet asetettiin stereotaksiseen kehykseen (Kopf, 900LS), joka sijoitettiin lämpöpeiton yläpuolelle kehon lämpötilan ylläpitämiseksi. kraniotomiareikä (~5 mm ×4 mm) tehtiin 1 mm etäisyydelle keskilinjasta käyttämällä hammasporaa, jossa oli 0.9 mm poranterä, kovakalvo poistettiin ja epikortikaalinen laite asetettiin aivojen aivokuoren pinnalle. Kraniotomiareikä tiivistettiin Kwik-silillä, sen jälkeen kiinnitettiin hammassementti ja iho ommeltiin kiinni. Suolaliuosta (1 ml/kg (painokilo)) ja buprenorfiinia (0.03 mg/kg (painokilo)) annettiin ihonalaisena ruiskeena menetetyn nesteen korvaamiseksi ja leikkauksen jälkeisen kivun vähentämiseksi, ja anestesia lopetettiin.
Kudosten keruu ja käsittely
Eläimet lopetettiin 2, 6 tai 12 viikon kuluttua implantaatiosta suoritettavan analyysin tyypin mukaan sopivalla menetelmällä.
Histologia ja immunohistokemia
2, 6 tai 12 viikkoa implantaation jälkeen rotat lopetettiin sydämen perfuusion avulla heparinisoidulla (10 U ml)-1, Sigma-Aldrich) PBS, jonka jälkeen 4 % paraformaldehydiä (PFA, Sigma-Aldrich) PBS:ssä. Aivot jälkikiinnitettiin 4-prosenttisessa PFA:ssa 24 tunnin ajan, sitten siirrettiin 30-prosenttiseen sakkaroosiin PBS:ssä vähintään 48 tunniksi ennen jäädyttämistä isopentaanissa. Aivoja säilytettiin sitten -80 °C:ssa, kunnes ne kryosektoitiin 25 µm:ssä. Kudos värjättiin sitten ionisoitua kalsiumia sitovaa adapterimolekyyliä 1 (Iba-1) varten mikrogliaaktivaation tason määrittämiseksi. Lyhyesti sanottuna kudosleikkeet blokattiin 5 % vuohen seerumilla PBS:ssä, jossa oli 0.1 % Triton-X:ää 1 tunnin ajan ennen kuin inkuboitiin yön yli 4°C:ssa primaarisen anti-Iba-1-vasta-aineen kanssa (1:1,000 019, 19741-594; Wako). Leikkeet värjättiin sitten sekundaarisella vasta-aineella, anti-kani Alexa Fluor 1 (400:11012, A-1; Thermo Fisher) 4,6 tunnin ajan huoneenlämpötilassa. Diat kiinnitettiin peitinlaseilla käyttämällä Prolong Goldin haalistumista estävää asennusmateriaalia, jossa oli 2-diamidino-3-fenyyli-indolia (Thermo Fisher). Anturi peitti 3.7 ×XNUMX mm alueen2 aivojen kortikaalisella pinnalla; värjäykseen valitut kudosleikkeet peittivät tämän alueen pituudeltaan 3.2 mm. Objektilasit kuvattiin käyttämällä 3DHistech Pannoramic-250 mikroskoopilla diaskanneria 20× ja kuvat analysoitiin CaseViewer v.2.4:llä (3DHistech). Mikroglia-aktivaation arvioimiseksi peitettiin 3.2 mm:n alue ja yksi kuva analysoitiin joka 100 µm. Kuvat otettiin 8.5-kertaisella suurennuksella, joissa kuvattiin yksityiskohtaisesti epikortikaalisen koetinkohdan osa, 3 mm aivojen keskiviivasta, ja se käsitti alueen suoraan koetinkohdan alla.
Kuvankäsittely
Mikroskooppitiedot käsiteltiin kuvalla käyttäen algoritmia mikroglian fenotyypin karakterisointiin (lisäkuva 1). 13). Mikroglia-aktivaatio analysoitiin käyttämällä mukautettua CellProfileria* (Broad Institute, v.3.1.9 alkaen https://cellprofiler.org/) putki. Ensin EnhanceOrSuppressFeatures-moduulia käytettiin parantamaan filamenttisia rakenteita, kuten neuriitteja, käyttämällä putken parannusmenetelmää. Parannetuista kuvista solut segmentoitiin käyttämällä IdentifyPrimaryObjects-moduulia. Solujen alustavat mittaukset viittaavat siihen, että sopiva kohteen halkaisijaalue oli 3–40 pikseliä. Tämän halkaisijaalueen ulkopuolella olevat tai kuvan reunaa koskettavat esineet hylättiin. Solut segmentoitiin käyttämällä kaksiluokkaista Otsu-adaptiivista kynnysstrategiaa, jonka mukautuva ikkunakoko oli 50 pikseliä. IdentifyPrimaryObjects-moduulin tunnistamat objektit syötettiin MeasureObjectSizeShape-moduuliin solujen luokitteluun tarvittavien ominaisuuksien laskemiseksi. ClassifyObjects-moduulissa luokittelujen perustana olevaksi kategoriaksi määritettiin AreaShape, ja vastaavaksi mittaukseksi valittiin Laajuus. Solut luokiteltiin "aktivoitu" tai "ei-aktivoitu" niiden laajuus-ominaisuuden perusteella, joka on solun ja sen rajauslaatikon miehittämän alueen suhde. Tätä luokittelutapaa rationalisoi se tosiasia, että aktivoiduilla mikroglioilla on suuria solukappaleita eikä prosesseja, ja siten ne vievät paljon suuremman osan rajoituslaatikoistaan kuin aktivoimattomat vastineensa. Lopuksi CalculateMath- ja ExportToSpreadsheet-moduuleita käytettiin haluttujen tilastojen laskemiseen ja tulostamiseen.
Tilastollinen analyysi
Tietojoukot ovat n = 3 kullekin laitetyypille (vain PI-implantti (PI); PI paljaalla mikrokullalla (kulta); ja PI, jossa on mikrovalmistettua kultaa ja EGNITE (EGNITE) kaikkina aikoina), paitsi 6 viikon kultaa, joka on n = 2 ELISA-tiedoille. Vastakkaiset pallonpuoliskot yhdistettiin kullakin aikapisteellä antamiseksi n = 9 2 ja 12 viikkoa implantaation jälkeen ja n = 8 6 viikkoa implantaation jälkeen. Tietojen analyysi tehtiin GraphPad Prism v.8 -ohjelmistolla. Tilastollinen analyysi suoritettiin käyttämällä kaksisuuntaista varianssianalyysiä (ANOVA) Tukeyn monivertailutestillä tarvittaessa; P < 0.05 katsottiin merkittäväksi.
ELISA
Implantaatiojakson jälkeen eläimet lopetettiin kohdunkaulan dislokaatiolla. Aivokudosta uutettiin sekä oikeasta että vasemmasta aivopuoliskosta, pakastettiin nestetypessä ja säilytettiin -80 °C:ssa jatkokäyttöön asti. Kudos hajotettiin käyttämällä NP-40-lyysipuskuria (150 mM NaCl, 50 mM Tris-Cl, 1 % Nonidet P40-korvike, Fluka, pH säädetty arvoon 7.4), joka sisälsi proteaasia ja fosfataasin estäjää (Halt Protease, Fishtailhi, Phosphatasermo jota seurasi kudoksen mekaaninen hajottaminen (TissueLyser LT, Qiagen). Näytteitä sentrifugoitiin sitten 10 minuuttia nopeudella 5,000 4 rpm, ja supernatanttia säilytettiin 740401 °C:ssa jatkokäyttöön asti. LEGENDplex Rat Inflammation Panel (luettelonumero 1, BioLegend), helmipohjainen multipleksinen ELISA-sarja, ajettiin seuraavien sytokiinien kvantifioimiseksi; IL-1α, IL-6β, IL-10, IL-12, IL-70p17, IL-18A, IL-33, IL-1, CXCL2 (KC), CCL1 (MCP-15), granulosyytti-makrofagipesäkkeitä stimuloiva tekijä, interferoni-y ja tuumorinekroositekijä. Kitti ajettiin valmistajan ohjeiden mukaan, proteiinia ladattiin kiinteällä tilavuudella XNUMX µl. Supernatantin kanssa inkuboinnin jälkeen helmet ajettiin BD FACSVerse -virtaussytometrillä ja tiedot analysoitiin käyttämällä LEGENDplex-dataanalyysiohjelmistoa.
Hermostimulaatio
Intrafaskulaarinen implantaatio
Kaikki eläinkokeet hyväksyttiin Universitat Autònoma de Barcelonan eettisessä komiteassa Euroopan yhteisöjen neuvoston direktiivin 2010/63/EU mukaisesti. Eläimiä pidettiin 22 ± 2 °C:ssa 12 h valo/12 h pimeässä syklissä, jolloin ruokaa ja vettä oli vapaasti saatavilla. Nukutettujen Sprague-Dawley-naarasrottien iskiashermo (250-300 g, ~18 viikkoa vanha) altistettiin kirurgisesti ja TIME-elektrodit istutettiin poikittain iskiashermon poikki suoralla neulalla, joka oli kiinnitetty 10-0-silmukkalangaan.46. Prosessia seurattiin dissektiomikroskoopilla, jotta varmistettiin aktiivisten kohtien oikea sijainti hermokaskeleiden sisällä (kuva 1). 4b). Kokeiden aikana eläimen ruumiinlämpöä ylläpidettiin lämmitystyynyllä.
Hermostimulaatio suoritettiin käyttämällä kaksivaiheisia virtapulsseja, joiden kiinteä kesto oli 100 µs vaihetta kohden ja nostamalla amplitudia 0:sta 150 µA:iin 1 tai 3 µA portaissa 3 Hz 33 sekunnin ajan (Stimulaattori N:stä DS4:ään, eri digitaaliEGtimer DS13). mikroelektrodit. Samanaikaisesti CMAP:t tallennettiin GM-, TA- ja PL-lihaksista käyttämällä pieniä neulaelektrodeja (0.4 mm pitkä, 03 mm halkaisija, ruostumattomasta teräksestä valmistetut neulaelektrodit A-14-XNUMXBEP, Bionic), jotka oli sijoitettu kuhunkin lihakseen.62. Aktiivinen elektrodi asetettiin lihaksen vatsaan ja referenssi jänteen tasolle. Elektromyografiatallenteet vahvistettiin (×100 GM:lle ja TA:lle, × 1,000 511 PL:lle; P3AC-vahvistimet, Grassille), kaistanpäästösuodatettiin (3 Hz - 16 kHz) ja digitoitiin PowerLab-tallennusjärjestelmällä (PowerLab20SP atkHXNUMX).
Tietojen analysointi
Kunkin CMAP:n amplitudi mitattiin perustasosta negatiiviseen maksimihuippuun. Jännitehuippumittaukset normalisoitiin kokeessa kullekin lihakselle saatuun maksimi-CMAP-amplitudiin. Selektiivisyysindeksi (SI) laskettiin kullekin aktiiviselle kohdalle normalisoidun CMAP-amplitudin välisenä suhteena yhdelle lihakselle, CMAP.ija normalisoitujen CMAP-amplitudien summa kolmessa lihaksessa kaavan SI mukaisestii = nWCPAi/∑nWCPAj, pienimmällä stimulaatiovirran amplitudilla, joka sai aikaan minimaalisen toiminnallisesti merkityksellisen lihasvasteen (määritelty vähintään 5 %:n CMAP-amplitudiksi yhdelle lihakselle suhteessa kyseisen lihaksen maksimi-CMAP-amplitudiin, joka oli aiemmin määritetty). Sitten aktiiviset kohdat, joilla oli korkein SI jokaiselle kolmelle lihakselle, valittiin kunkin lihaksen SI:ksi tietyssä kokeessa.
Krooninen intraneuraalinen bioyhteensopivuus
Noudatetaan aiemmin raportoitua menettelyä50,63, nukutettujen Sprague-Dawley-naarasrottien iskiashermo (250-300 g, ~18 viikon ikäinen) altistettiin ja laitteet in vivo -bioyhteensopivuuden varmistamiseksi EGNITEN kanssa ja ilman sitä istutettiin pitkittäin iskiashermon sääriluun haaraan (n = 6–8 ryhmää kohti). Lyhyesti sanottuna hermo lävistetään kolmiosasta suoralla neulalla, joka on kiinnitetty 10-0-silmukkalankaan (STC-6, Ethicon); lanka vetää taivutetun elektrodinauhan nuolen muotoista kärkeä. Kärki leikataan langan poistamiseksi, ja kummankin varren kärjet on hieman taivutettu, jotta laite ei vedä ulos. Pitkittäinen implantti valittiin, koska se mahdollistaa paremman vieraan kappaleen vasteen tutkimisen hermon sisällä50.
Hermojen ja eläinten toiminnan arviointi
Eläimet arvioitiin istutuksen jälkeisen seurannan aikana hermojen johtumis-, algesimetria- ja kävelyreittitestien avulla.62. Johtotestejä varten istutettujen ja vastakkaisten käpälöiden iskiashermoa stimuloitiin neulaelektrodilla iskiaslovossa ja PL-lihaksen CMAP rekisteröitiin kuten yllä. CMAP:n latenssi ja amplitudi mitattiin. Algesimetriakoetta varten rotat asetettiin lankaverkkoalustalle ja mekaaninen ei-haitallinen ärsyke käytettiin metallikärjellä, joka oli liitetty elektroniseen Von Frey-algesimetriin (Bioseb). Implantoitujen käpälöiden nosiseptiivinen kynnys (voima grammoina, jolla eläimet veivät käpälän pois) mitattiin verrattuna vastakkaissuuntaisiin tassuihin. Kävelyratakoetta varten takatassujen plantaarinen pinta maalattiin mustalla musteella ja jokainen rotta jätettiin kävelemään käytävää pitkin. Jalanjäljet kerättiin ja iskiasfunktionaalinen indeksi laskettiin62.
histologia
2 tai 8 viikon kuluttua eläimet perfusoitiin PFA:lla (4 %), ja iskiashermot kerättiin, jälkifiksoitiin, kylmäsäilytettiin ja käsiteltiin histologista analyysiä varten. FBR:n arviointia varten iskiashermot leikattiin 15 μm:n paksuisiksi poikittaisleikkeiksi kryostaatilla (Leica CM190). Näytteet värjättiin primäärisillä vasta-aineilla myelinoituneita aksoneja varten (anti-RT97 leimaamaan Neurofilamentti 200K, 1:200; Developmental Studies Hybridoma Bank) ja makrofageilla (anti-Iba-1, 1:500; Wako). Sitten leikkeitä inkuboitiin 1 h huoneenlämmössä sekundaaristen vasta-aineiden kanssa aasin anti-hiiri Alexa Fluor 488 ja aasin anti-kani Alexa Fluor 555 (1:200, Invitrogen). Valittiin edustavat leikkeet säärihermon implantin keskiosasta, kuvat otettiin epifluoresenssimikroskoopilla (Eclipse Ni, Nikon), joka oli kiinnitetty digitaalikameraan (DS-Ri2, Nikon) ja kuva-analyysi suoritettiin ImageJ-ohjelmistolla (National Institutes). terveys). Iba-1-positiivisten solujen määrä koko säärihermon alueella määritettiin ja kudoskapselin paksuus mitattiin implantin kummankin puolen keskimääräisenä etäisyydenä lähimpiin aksoniin.
Tilastollinen analyysi
Tietojen tilastolliseen analyysiin käytimme yksi- tai kaksisuuntaista ANOVA:ta, jota seurasi Bonferroni post hoc -testi ryhmien tai aikojen välisten erojen selvittämiseksi. Graafiseen esitykseen ja analysointiin käytettiin GraphPad Prism -ohjelmistoa. Tilastollinen merkitsevyys otettiin huomioon milloin P <0.05.
Raportointiyhteenveto
Lisätietoja tutkimussuunnittelusta on saatavana Nature Portfolio Reporting Summary linkitetty tähän artikkeliin.
- SEO-pohjainen sisällön ja PR-jakelu. Vahvista jo tänään.
- PlatoData.Network Vertical Generatiivinen Ai. Vahvista itseäsi. Pääsy tästä.
- PlatoAiStream. Web3 Intelligence. Tietoa laajennettu. Pääsy tästä.
- PlatoESG. hiili, CleanTech, energia, ympäristö, Aurinko, Jätehuolto. Pääsy tästä.
- PlatonHealth. Biotekniikan ja kliinisten kokeiden älykkyys. Pääsy tästä.
- Lähde: https://www.nature.com/articles/s41565-023-01570-5
- :on
- :On
- :ei
- :missä
- ][s
- $ YLÖS
- 000
- 1
- 10
- 100
- 12
- 13
- 130
- 15%
- 150
- 160
- 19
- 1998
- 20
- 200
- 2010
- 2011
- 2014
- 2016
- 2018
- 2020
- 2022
- 22
- 24
- 25
- 250
- 26
- 27
- 28
- 30
- 300
- 320
- 33
- 35%
- 350
- 40
- 400
- 41
- 43
- 46
- 50
- 500
- 54
- 58
- 60
- 600
- 7
- 70
- 700
- 75
- 8
- 80
- 87
- 9
- 90
- a
- pystyy
- edellä
- pääsy
- mukaisesti
- Mukaan
- akustinen
- hankkia
- hankittu
- hankinta
- poikki
- Toimia
- aktivoitu
- Aktivointi
- aktiivinen
- toiminta
- mukautuva
- lisä-
- osoite
- Oikaistu
- Aikuinen
- Jälkeen
- AG
- uudelleen
- AL
- Alkoholi
- Alexa
- algoritmi
- Kaikki
- mahdollistaa
- pitkin
- am
- Ympäröivä
- määrä
- Amplified
- an
- analyysit
- analyysi
- Ankkuri
- ja
- eläin
- eläimet
- vasta-aineita
- vasta-aine
- erilleen
- Hakemus
- sovellettu
- Hakeminen
- lähestymistapa
- sopiva
- hyväksyminen
- hyväksytty
- OVAT
- ALUE
- alueet
- ARM
- noin
- Ryhmä
- artikkeli
- AS
- arvioida
- arviointi
- liittyvä
- olettamus
- At
- Tunnelma
- atomi-
- huomio
- valtuutettu
- saatavissa
- välttää
- pois
- tausta
- Pankki
- Barcelona
- pohja
- perustua
- Lähtötilanne
- BD
- BE
- Palkki
- koska
- ollut
- ennen
- käyttäytyminen
- alle
- Paremmin
- välillä
- sitova
- biolääketieteen
- Bitti
- Musta
- tukossa
- elimet
- elin
- sekä
- Laatikko
- laatikot
- Aivot
- äly
- Sivuliike
- lyhyesti
- laaja
- toi
- puskuri
- mutta
- by
- kaapeli
- laskea
- laskettu
- kamera
- kapasitiivinen
- Koko
- joka
- kuljettaa
- tapaus
- Kategoria
- ccl2
- solu
- Solut
- sementti
- keskeinen
- haasteet
- tunnettu siitä,
- lataus
- Kaarle
- kemiallinen
- valittu
- luokittelu
- luokiteltu
- napsauttaa
- suljettu
- cocktail
- kokoelma
- Pylväät
- yhdistetty
- tulee
- valiokunta
- yhteisöjen
- yhteisö
- Valmistunut
- koostumus
- olosuhteet
- tehty
- johtokyky
- Konfigurointi
- kytkeä
- kytketty
- harkittu
- Koostuu
- vakio
- ottaa yhteyttä
- sisälsi
- jatkuva
- osuus
- Lähentyminen
- korjata
- vastaava
- käytävä
- aivokuori
- neuvosto
- kollegansa
- kurssi
- katettu
- kriittinen
- Ylittää
- kylmäsäilytetty
- Nykyinen
- asiakassuhde
- Leikkaus
- sykli
- jaksoa
- sytokiinien
- vahingollista
- tumma
- tiedot
- tietojen analysointi
- päivää
- de
- vähentää
- katsotaan
- määritelty
- ja
- toimitettu
- riippua
- tallettaa
- talletettu
- syvyys
- on kuvattu
- Malli
- haluttu
- yksityiskohtainen
- Määrittää
- määritetty
- määritetään
- kehitys-
- laite
- Laitteet
- DID
- Ruokavalio
- ero
- erot
- eri
- digitaalinen
- Digitalisoinnin
- laimennettu
- ohjata
- suoraan
- sijoiltaanmeno
- Häiriö
- etäisyys
- jaettu
- do
- verkkotunnuksen
- tehty
- alas
- Pudota
- kaksi
- kesto
- aikana
- E&T
- kukin
- reuna
- sähköinen
- Elektroninen
- elementti
- elefantti
- korkea
- kattaa
- energia
- parantaa
- tehostettu
- lisälaite
- varmistaa
- varustettu
- Vastaava
- vakiintunut
- arvioidaan
- Eetteri (ETH)
- eettinen
- EUR
- Eurooppalainen
- EV
- arvioitu
- arviointi
- tapahtuma
- Joka
- kaikkialla
- osoituksena
- tutkia
- poikkeus
- odotettu
- kokeilu
- kokeellinen
- kokeiluja
- avoin
- Valotus
- ilmaistuna
- laajuus
- uute
- helpottamaan
- tosiasia
- tekijä
- Pudota
- paljon
- FAST
- Ominaisuudet
- naaras-
- Viikuna
- Kuva
- täynnä
- Elokuva
- elokuvat
- suodatus
- Vihdoin
- Etunimi
- asennus
- kiinteä
- Joustavuus
- joustava
- virtaus
- keskityttiin
- tarkennus
- seurannut
- jälkeen
- ruoka
- varten
- voima
- ulkomainen
- muoto
- kaava
- FRAME
- Ilmainen
- vapaasti
- Pakastaminen
- Ranskan
- alkaen
- etuosa
- jäädytetty
- koko
- täysin
- toiminnallinen
- toiminnallisesti
- edelleen
- tulevaisuutta
- Saada
- antoi
- general
- geometria
- Antaa
- tietty
- lasi-
- GM
- Go
- Kulta
- Grafeeni
- ruoho
- Maa
- Ryhmä
- Ryhmän
- suuntaviivat
- HAD
- Puoli
- Käsittely
- Olla
- terveys
- auttaa
- pallonpuoliskon
- korkea resoluutio
- suurin
- haltija
- Reikä
- Koti
- Kotitoimisto
- Vaakasuora
- KUUMA
- Kuitenkin
- HTTPS
- huang
- i
- tunnistettu
- tunnistaa
- IEEE
- kuva
- kuva-analyysi
- kuvien
- Vaikutus
- in
- Mukaan lukien
- lisää
- inkuboitu
- INKUBIOINTI
- indeksi
- henkilökohtainen
- tulehdus
- tiedot
- panos
- sisällä
- Instituutti
- ohjeet
- integroitu
- Integrointi
- tarkoitettu
- liitäntä
- rajapinnat
- tulee
- tutkia
- IT
- SEN
- säilytetään
- pakki
- Kokki
- Merkki
- laboratorio
- suuri
- suurempi
- laser
- Sukunimi
- Viive
- myöhemmin
- Laki
- kerros
- vähiten
- vasemmalle
- lainsäädäntö
- Pituus
- Taso
- Kirjasto
- pitää
- rajoitukset
- linja
- LINK
- liittyvät
- Neste
- kuormitus
- paikallinen
- sijaitsevat
- sijainnit
- Pitkät
- pitkän aikavälin
- menetetty
- alensi
- makrofagit
- tehty
- tärkein
- ylläpitää
- tehdä
- kartta
- Kartat
- naamio
- Hyväksytty
- materiaali
- tarvikkeet
- matplotlib
- maksimi
- mc
- tarkoittaa
- välineet
- mitattu
- mittaus
- mitat
- mittaus
- mekaaninen
- Media
- metalli-
- menetelmä
- microglia
- mikrofoni
- Mikroskooppi
- Mikroskopia
- Keskimmäinen
- minuuttia
- minimi
- minimi
- ministeriö
- seos
- ML
- malli
- mallit
- moduuli
- Moduulit
- molekyyli
- seurataan
- kk
- hiiri
- liikkua
- siirretty
- MS
- monikanavainen
- lihas
- nanoteknologian
- kansallinen
- National Institutes of Health
- luonto
- Lähellä
- välttämätön
- kuolio
- tarpeet
- negatiivinen
- NEO
- netto
- verkko
- hermo-
- neurofilamentti
- neuronien
- seuraava
- Nro
- Melu
- numero
- numpy
- objekti
- tavoite
- esineet
- tarkkailla
- saada
- saatu
- of
- pois
- Office
- offline
- Vanha
- on
- kerran
- ONE
- vain
- avata
- aukot
- toimi
- or
- Muut
- meidän
- ulos
- ulostulo
- ulkopuolella
- yli
- yleinen
- yön aikana
- yleiskatsaus
- Happi
- paketit
- tyyny
- Kipu
- pandas
- paneeli
- osa
- kulkea
- kuviot
- PAWS
- PBS
- Peak
- varten
- suorituskyky
- suoritettu
- aika
- perifeerinen
- vaihe
- fenotyyppi
- mänty
- putki
- pixel
- sijoitettu
- Planes
- foorumi
- platina
- Platon
- Platonin tietotieto
- PlatonData
- plus
- pm
- Kohta
- pistettä
- salkku
- sijainti
- positiivinen
- Kirje
- mahdollinen
- teho
- alustava
- valmistelu
- valmis
- läsnäolo
- esitetty
- säilytetty
- paine
- aiemmin
- ensisijainen
- Aikaisempi
- anturi
- menettelyt
- prosessi
- jalostettu
- Prosessit
- tuottavat
- Tuotteemme
- asianmukaisesti
- ominaisuudet
- omaisuus
- osa
- suojella
- Proteiini
- protokolla
- protokollat
- toimittaa
- tarjoamalla
- Vetää
- pulssi
- Python
- R
- alue
- alainen
- RAT
- hinta
- suhde
- RE
- reaktio
- reaktiot
- valmis
- vastaanottava
- suosituksia
- kirjataan
- äänitys
- elpyminen
- vähentää
- Vähentynyt
- vähentäminen
- viite
- uudistuminen
- järjestelmien
- alue
- suhteellinen
- merkityksellinen
- jäädä
- poistaa
- poistettu
- poistamalla
- toistuva
- korvata
- raportoitu
- Raportointi
- edustus
- edustaja
- tutkimus
- vastus
- päätöslauselma
- kunnioittaminen
- vastaavasti
- vastaus
- vasteet
- tulokset
- Muutos
- arviot
- nauha
- Rikas
- oikein
- Nousta
- Joki
- Huone
- ajaa
- s
- sama
- skannata
- skriptejä
- Toinen
- toissijainen
- Osa
- osiot
- turvallinen
- nähdä
- valittu
- Sarjat
- Seerumi
- Setit
- useat
- Shape
- esitetty
- Näytä
- puoli
- signaali
- signaalit
- merkitys
- merkittävä
- Hopea
- samanaikaisesti
- single
- paikka
- Sivustot
- Koko
- iho
- SLIDE
- Diat
- liukuva
- pieni
- napsahtaa
- Tuotteemme
- ratkaisu
- kuulostaa
- lähde
- tila-
- Kaiutin
- kaiuttimet
- määritelty
- silmälasit
- Spektroskopia
- piikkarit
- Kierre
- neliö
- Pysyvyys
- vakauttaa
- pino
- Ruostumaton teräs
- standardi
- standardoitu
- Aloita
- Osavaltio
- tilastollinen
- tilasto
- Höyry
- teräs
- Varsi
- Vaihe
- Askeleet
- ärsyke
- Levytila
- tallennettu
- suoraan
- Strategia
- Kuori
- vahva
- rakenteellinen
- rakenteet
- opinnot
- tutkimus
- ihonalainen
- myöhempi
- merkittävä
- niin
- summa
- pinta
- Leikkaus
- järjestelmä
- T
- ottaa
- otettava
- Kohde
- Tehtävä
- tekniikat
- Elektroniikka
- tilapäinen
- testi
- testit
- kuin
- että
- -
- Alue
- Tulevaisuus
- UK
- heidän
- sitten
- Siellä.
- lämpö-
- ne
- tätä
- ne
- kolmella
- kynnys
- Kautta
- kauttaaltaan
- Näin
- aika
- kertaa
- kärki
- vinkit
- kudos
- Titaani
- että
- TONE
- ylin
- Yhteensä
- liikuttava
- kohti
- raita
- junat
- trans
- siirtää
- siirretty
- Siirtäminen
- siirtyminen
- käsitelty
- hoito
- hoidot
- tutkimuksissa
- oppitunti
- kaksi
- tyyppi
- Uk
- ultraääni
- varten
- ymmärtäminen
- koki
- asti
- käyttää
- käytetty
- käyttämällä
- tyhjiö
- pätevä
- arvo
- arvot
- Vastaan
- kautta
- vivo
- Jännite
- tilavuus
- of
- W
- kävellä
- kävely
- oli
- vesi
- we
- viikko
- viikkoa
- punnitus
- paino
- Hyvinvointi
- olivat
- kun
- joka
- vaikka
- valkoinen
- koko
- ikkuna
- Johdin
- with
- vetäytyminen
- ilman
- Referenssit
- työskenteli
- työskentely
- X
- x-ray
- zephyrnet