Kaikkia reagensseja käytettiin sellaisenaan, ellei toisin mainita. Kaikki kemikaalit ostettiin Sigma Aldrichilta lukuun ottamatta laskentahelmiä (CountBright Absolute Counting Beads, Invitrogen). ζ- Potentiaali mitattiin Zetasizer NanoZS90:llä (Malvern Instruments). SEM tutki hiukkasten kokoa ja morfologiaa JEOL JSM 7800F Prime -mikroskoopilla, jossa oli integroitu EDS alkuaineanalyysin aikaansaamiseksi. Partikkelikoko määritettiin mittaamalla 50 itsenäistä hiukkasta. Radioinstant ohutkerroskromatografia (ITLC) kehitettiin Agilent Technologies lasimikrokuitukromatografiapaperille, joka oli kyllästetty piihapolla ja analysoitiin Lablogic Flow-count TLC-skannerin ja BioScan B-FC-3200 valomonistinputki (PMT) -detektorin avulla Laura-ohjelmistolla. ITLC-liikkuva faasi koostui 0.175 M sitruunahaposta ja 0.325 M trinatriumsitraatista vedessä, ellei toisin mainita. Radioaktiiviset näytteet mitattiin käyttämällä Capintec CRC-25R:ää (Capintec) tai LKB Wallac 1282 Compugamma CS:ää (PerkinElmer), joista tiedot kerättiin EdenTerm-ohjelmistolla. Virtaussytometriakokeet suoritettiin BD FACSMelody -solulajittelijalla käyttäen BD FACSChorus -ohjelmistoa. PET/CT-kuvat otettiin käyttämällä NanoPET/CT-skanneria (Mediso), rekonstruoitiin Nucline v.0.21 -ohjelmistolla ja kuvat analysoitiin VivoQuant-ohjelmistolla (versio 3.5, InviCRO). Listmode-tiedot saatiin Medison kehittämällä erityisellä MATLAB-ohjelmistotyökalulla. Autoradiografia suoritettiin GE Amersham Typhoon -laitteella.
Alle mikrometrin kokoisten piidioksidihiukkasten synteesi
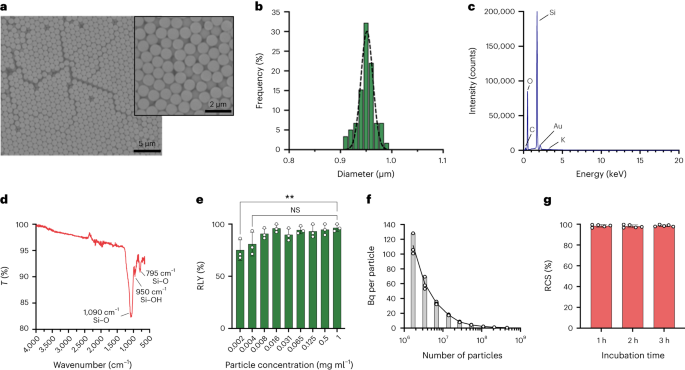
Hiukkaset syntetisoitiin Stöber-menetelmällä. Tämä menetelmä perustuu piialkoksidien hydrolyysiin ja peräkkäiseen kondensaatioon monodisperssien, pallomaisten piidioksidihiukkasten tuottamiseksi.27. Piin lähteenä käytettiin tetraetyyliortosilikaattia (TEOS), emäskatalyyttinä ammoniakkia ja elektrolyyttinä kaliumkloridia. TEOS-liuosta etanolissa lisättiin jatkuvasti liuokseen, joka sisälsi katalyytin ja elektrolyytin. Reagenssin aloitusmäärän tai lisäysnopeuden muuttaminen saa aikaan eroja hiukkaskoossa, kuten aiemmin on raportoitu28. Tässä valmistettiin kaksi liuosta ennen hiukkasten synteesiä: liuos 1, joka sisälsi 19.0 mmol TEOS:a 33.3 ml:ssa EtOH:a ja liuos 2, joka sisälsi 0.23 mmol KCl:a 9 ml:ssa ammoniakkia, 65 ml EtOH:a ja 6.75 ml.2O. Synteesiä varten liuos 2 laitettiin 250 ml:n pyöreäpohjaiseen pulloon, jota kuumennettiin 50 °C:seen sekoittaen nopeudella 300 rpm 15 minuutin ajan. Sitten liuos 1 lisättiin tipoittain liuokseen 2 (syöttönopeus 0.2 ml min-1). Liuoksen 1 lisäämisen jälkeen saadut partikkelit puhdistettiin sentrifugoimalla 18,300 XNUMX °C:ssag 3 minuuttia ja pestiin EtOH:lla viisi kertaa. Lopuksi SiO2 mikropartikkelit kuivattiin tyhjössä.
Alle mikrometrin kokoisten hiukkasten oksastus silaani-PEG:llä5k
20 mg ml-1 silaani-PEG-liuos5k (Sigma Aldrich) 98-prosenttisessa EtOH:ssa lisättiin smSiP-liuoksen päälle 5 mg ml-1 EtOH:ssa 98 % ja 2.8 % ammoniakkia. Seosta sekoitettiin yön yli huoneenlämpötilassa ja hiukkaset otettiin talteen sentrifugoimalla 18,300 XNUMX °C:ssa.g 3 min. Lopuksi hiukkaset pestiin kolme kertaa tislatulla vedellä ja kuivattiin tyhjössä yön yli. Pesuliuokset pakastekuivattiin yön yli ja kiinnittymättömän silaani-PEG-määrä5k painotettu reaktion saannon laskemista varten. 0.05 mg ml-1 smSiP-PEG-liuos5k tislatussa vedessä käytettiin muihin radioleimausreaktioihin.
[68Ga]GaCl3
Gallium-68 eluoitui [68Ga]GaCl3 Eckertiltä ja Ziegleriltä 68Ge /68Ga-generaattori ultrapuhtaassa HCl:ssä (4 ml, 0.1 M), joka on valmistettu hyvän valmistuskäytännön vaatimusten mukaisesti (ABX).
Pitoisuus [68Ga]GaCl3 eluointi kationinvaihdolla
Eluution konsentraatio suoritettiin käyttämällä lisäkuvassa 1 kuvattua järjestelyä. 1. Ensinnäkin 4 ml [68Ga]GaCl3 eluointi ladattiin Strata-X-C 33u -patruunalle (Phenomenex) ja eluaatti heitettiin pois. Sitten patruuna pestiin 5 ml:lla asetoni/0.1 M HCl-liuosta (80:20) ja eluaatti heitettiin pois. Lopuksi keskittynyt [68Ga]GaCl3 kerättiin lisäämällä 700 µl asetoni/0.05 M HCl-liuosta (98:2), kuivattiin N:n alla.2 ja suspendoitiin uudelleen 50 µl:aan 0.5 M HEPES-puskuria (pH 4.9). Radio-TLC suoritettiin eri vaiheissa laadunvalvontaa varten. Protokolla kestää noin 20 minuuttia, jolloin saanto on 86.2 ± 8.5 %.
Piidioksidihiukkasten radioleimaus eri pitoisuuksilla 68Ga
Piidioksidihiukkaset suspendoitiin uudelleen eri pitoisuuksina (1 - 0.002 mg ml-1) 0.5 M HEPES-puskurissa (pH 4.9). Sitten 50 µl liuosta lisättiin reaktioputkeen ennen väkevän [68Ga]GaCl3 eluointi 50 µl:ssa 0.5 M HEPES-puskuria (pH 4.9). Reaktiot suoritettiin 90 °C:ssa 30 minuuttia, ja radiokemiallisen saannon laskemiseksi suoritettiin radio-TLC.
Hiukkaskonsentraation mittaus virtaussytometrialla
Partikkelipitoisuudet laskettiin virtaussytometrialla käyttämällä laskentahelmiä (CountBright Absolute Counting Beads, Invitrogen) noudattaen valmistajan ohjeita. Piidioksidihiukkaset suspendoitiin uudelleen 0.05 mg:aan-1, sonikoitiin 10 min ja johdettiin 10 µm:n rajakokosuodattimen läpi (KX Syringe Filter, Nylon, 25 mm, 10 µm). CountBright Absolute Counting Beads lämmitettiin huoneenlämpötilaan ja vorteksoitiin 30 sekuntia. Sitten 50 µl helmiä lisättiin 300 µl:aan piidioksidihiukkasia ja seosta vorteksoitiin 30 minuuttia homogeenisen liuoksen saamiseksi. Näyte ajettiin virtaussytometrillä ja eteenpäinsironta (FSC) kynnys asetettiin sisältämään helmet ja partikkelit lineaarisella FSC versus lineaarisen puolen sirontakäyrällä. Myöhemmin fluoresenssidetektorin jännite säädettiin laskentahelmiä varten ja suoritettiin avainnusstrategia piidioksidihiukkasten ja laskentahelmipopulaatioiden eristämiseksi. Lopuksi hiukkasille ja absoluuttisille laskentahelmille piirrettiin portit ja 1,000 XNUMX helmitapahtumaa kirjattiin jokaiselle näytteelle. Tätä strategiaa käyttämällä laskettiin liuoksessa olevien hiukkasten määrä käyttämällä seuraavaa yhtälöä:
$$begin{array}{l}displaystyle{mathrm{Absolute}},{mathrm{count}},left(frac{mathrm{Particles}}{{{upmu l}}}right)=displaystylefrac{({mathrm{ Hiukkaset}},{mathrm{count}},times,{mathrm{Counting}},{mathrm{helmet}},{mathrm{volume}})}{({mathrm{Counting}},{mathrm{helmet}} ( {{mathrm{Beads}}}{{{upmu l}}}oikea)end{array}$$
500 smSiP:n radioleimaus
Viisisataa smSiP:tä lisättiin 50 µl:aan väkevää [68Ga]GaCl3 eluointi 0.5 M HEPES-puskurissa pH 4.9. Sitten lisättiin 5.6 µl polysorbaatti 80:tä ja seosta kuumennettiin 90 °C:ssa 30 minuuttia nopeudella 900 rpm lämpösekoittimessa. Myöhemmin suunniteltiin lopullinen monivaiheinen puhdistusprotokolla reagoimattoman/kolloidisen aineen poistamiseksi 68Ga. 10 mikrolitraa 5 mM EDTA:ta lisättiin ja seosta inkuboitiin 3 min huoneenlämpötilassa. Sitten hiukkasia sentrifugoitiin 18,300 minuuttia XNUMX XNUMX °C:ssag, suspendoitiin uudelleen 500 µl:aan PBS:ää, joka sisälsi 1 mM EDTA:ta + 0.1 % polysorbaatti 80:tä, ja vorteksoitiin varovasti 10 s. Partikkelit sentrifugoitiin uudelleen, pestiin liuoksella, jossa oli 0.1 mM EDTA + 0.1 % polysorbaatti 80 PBS:ssä ja vorteksoitiin varovasti 10 s. Lopuksi hiukkaset sentrifugoitiin ja pestiin vielä viisi kertaa PBS:llä + 0.1 % polysorbaatti 80:llä ja suspendoitiin uudelleen 500 µl:aan PBS:ää. Radioleimausreaktiota seurattiin radio-TLC:llä peräkkäisten reaktiovaiheiden aikana kolloidien läsnäolon (jotka voidaan sekoittaa hiukkasiin, jos niitä ei poisteta kunnolla), hiukkasten radioleimauksen ja lopputuotteen puhtauden arvioimiseksi. RLY laskettiin vertaamalla hiukkasten ja supernatanttien radioaktiivisuuden määrää pesuvaiheiden jälkeen.
fraktiointi
Fraktiointistrategiassa tilavuudet 0.5 µl - 20 µl 68Ga-smSiP teoreettisella pitoisuudella 1 hiukkanen µl-1 lisättiin eri näyteputkiin 1 µl:n vaiheissa (0.5, 1, 2, 3…) ja PBS:ää lisättiin lopullisen tilavuuden saattamiseksi 50 µl:aan. Sitten 37.5 µl ensimmäisestä putkesta pipetoitiin toiseen näyteputkeen, 25 µl toisesta putkesta kolmanteen putkeen ja lopuksi 12.5 µl kolmatta putkea neljänteen putkeen. Tämä strategia tarjoaa neljä putkea näytettä kohti lopullisen tilavuuden ollessa 12.5 µl putkea kohti. Radioaktiivisuus kussakin putkessa mitattiin gammalaskimella ja arvot laskettiin kBq:nä käyttäen kalibrointikäyrää lisävertailua ja -analyysiä varten. Näytteitä, jotka sisälsivät suurimman osan radioaktiivisuudesta vain yhdessä putkessa, sonikoitiin 30 sekuntia huoneenlämpötilassa ja niille suoritettiin toinen fraktiointivaihe. Sitten näytteitä, joissa kaikki radioaktiivisuus löydettiin yhdestä putkesta (aktiivisuus oli merkityksetön kolmessa muussa putkessa), käytettiin lisäin vivo/ex vivo -kokeissa.
PET/CT-fantomikuvaus
Phantom-kuvauskoe suoritettiin yhdellä 68Ga-smSiP. Kanyylia käytettiin partikkelin viemiseksi näyteputkeen sen arvioimiseksi, voisiko yksittäinen hiukkanen jäädä loukkuun kanyyliletkuun annon aikana. Lyhyesti sanottuna phantom-putki asetettiin nanoPET/CT-skanneriin kanyylin kärjen pään ollessa kiinnitettynä putkeen. PET:n hankinnan aloittamisen jälkeen 100 µl:aan PBS:ää uudelleen suspendoitu partikkeli annettiin insuliiniruiskulla, joka oli kiinnitetty kanyylin alkuun. Sitten kanyyli pestiin 50 µl:lla PBS:ää, jotta varmistettiin partikkelin kulkeutuminen haamuputkeen. PET-hankinta suoritettiin 2 tunnin ajan, mitä seurasi tavallinen CT-skannaus.
In vivo PET/CT-kuvaus
Eläinkuvaustutkimukset tarkasteltiin eettisesti ja suoritettiin Animals (Scientific Procedures) Act 1986 (ASPA) -säädösten mukaisesti, jotka koskevat Yhdistyneen kuningaskunnan sisäministeriön eläinkokeita. In vivo -kuvaus suoritettiin terveillä 8 viikon ikäisillä BALB/c-hiirillä. Eläimet nukutettiin isofluraanilla (2–3 % hapessa), kanyloitiin ja asetettiin skanneripesälle nukutukseen. Sänky lämmitettiin 37 °C:seen sisäisellä ilmavirralla eläimen pitämiseksi normaalissa ruumiinlämpötilassa, ja hengitystiheyttä seurattiin ja pidettiin 60–80 hengitystiheydessä.-1 koko skannauksen ajan. Eläimen lämpötilan hallinta on tärkeää, koska odottamaton lämpötilan lasku voi johtaa hiukkasen nopeuden alenemiseen veressä. Yksi 68Ga-smSiP (n = 4) tai 68Ga-smSiP-PEG5k hiukkanen (n = 2) annettiin kanyylin kautta 100 µl:ssa PBS:ää, mitä seurasi pesu 50 µl:lla PBS:ää PET:n hankinnan aloittamisen jälkeen (1:5-yhteensattumatila; 5 ns:n yhteensattuma-aikaikkuna). PET:tä tallennettiin 2 tuntia, ja sitten suoritettiin puoliympyrän muotoinen CT-skannaus. Eläimen ruumiinlämpöä ja hengitystiheyttä tarkkailtiin koko prosessin ajan. Dynaamiset PET/CT-kuvat rekonstruoitiin käyttämällä Tera-Tomo 3D -rekonstruktiota (400–600 keV energiaikkuna, 1:5 yhteensattumatila, 20 iteraatiota ja 1 osajoukko) vokselikoolla 0.4 × 0.4 × 0.4 mm3 ja korjattu vaimennusta, sirontaa ja hajoamista varten. Kaikkien PET/PEPT-hankintojen luettelotilan tiedot löytyvät 68Ga-smSiP osoitteessa viite. 29 ja 68Ga-smSiP-PEG5k osoitteessa ref. 30.
Reaaliaikainen seuranta
Ensin tiedot vietiin skannerista listmode-muodossa (eli muodossa, jossa oli aikaleima ja kideindeksi havaituille sattumafotoneille). Geometrinen muunnos käytettiin muuntamaan kideindeksit sijaintiin mm-yksiköissä. Birminghamin menetelmä laskee iteratiivisesti MDP:n kaikkien LoR-arvojen osajoukosta. Se tekee tämän hylkäämällä LoR:t, jotka ovat kauempana kuin asetettu etäisyys MDP:stä, koska ne johtuvat todennäköisesti vääristä LoR-arvoista, esimerkiksi LoR-arvoista, jotka voivat olla peräisin hajonnasta. MDP:tä jalostetaan jokaisen iteroinnin yhteydessä; iteraatioiden määrän määrittää tehokkaasti f-kerroin ja liittyy LoR-arvojen kokonaismäärään, jota käytetään arvioimaan hiukkasten lopullinen sijainti kyseisessä osajoukossa (esim. f-kerroin 0.5 tarkoittaa, että iteraatiosilmukka päättyy, kun 50 % alajoukon LoR-arvoista on jäljellä). Osajoukossa käytettyjen LoR:ien määrää voidaan vähentää parantamaan ajallista näytteenottoa (alajoukot ovat ajan peräkkäisiä ilman päällekkäisyyksiä) sijainnin epävarmuuden lisäämisen kustannuksella (algoritmin lisätiedot löytyvät julkaisusta Parker et al.5) Birminghamin menetelmää käytettiin PET-skannerin luettelotilan tietojen analysointiin. Mukautuvaa näytekokoa käytettiin hiirten hiukkasten jäljittämiseen. Otoskoko asetettiin riittävän ajallisen näytteenoton tasapainoon ja minimoimalla paikannusvirheet. Skannausten alkuvaiheessa (<100 s skannauksen alusta) käytettiin näytteen kokoa 200–60 LoR:tä. f = 0.1, jolloin saadaan noin 1–5 s välein. Skannausajoilla > 60 s näytekoot vaihtelivat välillä 1,000 2,000 ja 30 60, mikä tuotti XNUMX s ja XNUMX s välillä in vivo -kokeen mukaan. MDP:n laskemiseen käytettyjen lukujen määrä (lopullisessa iteraatiossa) saadaan kertomalla otoskoko f-tekijäarvo. Nämä parametrit perustuivat aikaisempaan kokemukseen ja perustuivat aikaisempiin julkaisuihin1.
Nopeus saatiin kuten (sqrt{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) jossa ({v}_{m}^{2}) on nopeus x, y ja z suuntiin.
Ex vivo elinten otto
Kulutusta eri elimiin arvioitiin gammalaskennalla. In vivo PET/CT-kuvauksen jälkeen eläimet tapettiin kaulasijoilla ja elimet leikattiin pois ja punnittiin radioaktiivisuuden laskemiseksi gammalaskimessa (LKB Wallac 1282 Compugamma CS). Tiedot ilmaistiin prosentteina injektoidusta annoksesta (annos elimessä / injektoitu kokonaisannos) kudosgrammaa kohden (%ID g-1).
Autoradiografia
Radioaktiivisuus keuhkoissa jäljitettiin säteilyilmaisimella (EP15-koetin, Morgan) ja keuhkot leikattiin pieniksi paloiksi skalpellilla, kunnes saatiin pieni osa kudosta radioaktiivisen signaalin kanssa. Kudos pikapakastettiin -80 °C isopropanolissa. Välittömästi pakastamisen jälkeen kudos upotettiin optimaalisen leikkauslämpötilan väliaineeseen ja leikattiin kryostaatissa 20 µm:n viipaleiksi. Jokaista viipaletta tutkittiin detektorilla, kunnes radioaktiivinen viipale löydettiin. Edellinen (taustan alla), radioaktiivinen ja seuraava (taustan alapuolella) viipale asetettiin Superfrost-mikroskooppilevylle (Epredia). Loput jäljellä olevasta kudoksesta oli myös taustan alapuolella. Mikroskoopin objektilasi, jossa oli kolme osaa, peitettiin tartuntakalvolla ja vastakkain GE-autoradiografialevyä yön yli. Levy analysoitiin käyttämällä GE Amersham Typhoonia 25 µm:n resoluutiolla ja PMT-asetuksena 4,000 1. Autoradiografiakuva asetettiin kudoksen kuvan päälle, mikä osoitti yhden radioaktiivisen pisteen radioaktiivisessa viipaleessa. Kvantifiointia varten valmistettiin standardeja erilaisissa tunnetuissa aktiviteeteissa, ja jokainen täplitettiin 5 µl kvintetina paperilla. Täpliä inkuboitiin samassa varastoloisteaineseulassa, BAS-IP MS (Multipurpose Standard) GE:ltä kuin yksittäiset hiukkaset kvantitoitiin. Kuva on hankittu Amersham Typhoon 2.0:llä Control Softwaren versiolla 100 fosforitilassa pikselikoon 4,000 µm ja herkkyydellä 10.0. Kuvat kvantifioitiin ImageQantTL v261-XNUMX -ohjelmistolla käyttämällä geelin kvantifiointityökalua. Täplät korjattiin valitsemalla pysyväksi taustaksi alue välittömästi ennen tai jälkeen täplän. Tuloksena olevaa täplän tilavuutta käytettiin hiukkasen Bq:n laskemiseen kalibrointikäyrän perusteella.
Tilastot ja uusittavuus
Kvantitatiivista analyysiä varten analysoitiin vähintään kolme biologista kopiota, lukuun ottamatta in vivo -tietoja 68Ga-smSiP-PEG5k (n = 2). Tiedot analysoitiin tavallisella yksisuuntaisella varianssianalyysillä (ANOVA) Dunnettin monivertailutestillä ja Studentin testillä. t-testata. A P arvoa <0.05 pidettiin tilastollisesti merkitsevänä.
- SEO-pohjainen sisällön ja PR-jakelu. Vahvista jo tänään.
- PlatoData.Network Vertical Generatiivinen Ai. Vahvista itseäsi. Pääsy tästä.
- PlatoAiStream. Web3 Intelligence. Tietoa laajennettu. Pääsy tästä.
- PlatoESG. hiili, CleanTech, energia, ympäristö, Aurinko, Jätehuolto. Pääsy tästä.
- PlatonHealth. Biotekniikan ja kliinisten kokeiden älykkyys. Pääsy tästä.
- Lähde: https://www.nature.com/articles/s41565-023-01589-8
- :On
- :ei
- :missä
- ][s
- 000
- 1
- 10
- 100
- 12
- 15%
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- absoluuttinen
- mukaisesti
- Saavuttaa
- hankittu
- hankinta
- yritysostot
- Toimia
- toiminta
- toiminta
- mukautuva
- lisä-
- lisää
- Lisäksi
- Oikaistu
- annettuna
- hallinto
- ennakot
- Jälkeen
- jälkeenpäin
- uudelleen
- AIR
- AL
- algoritmi
- Kaikki
- Myös
- Ammoniakki
- määrä
- an
- analysoida
- analyysi
- Ankkuri
- ja
- eläin
- eläimet
- sovellettu
- suunnilleen
- OVAT
- nousta
- AS
- At
- b
- tausta
- Balance
- pohja
- perustua
- perusta
- BD
- BE
- ennen
- Alku
- alle
- välillä
- Birmingham
- veri
- elin
- lyhyesti
- tuoda
- puskuri
- by
- laskea
- laskettu
- laskee
- laskeminen
- CAN
- kuljettaa
- Katalysaattori
- solu
- kemikaalit
- valita
- napsauttaa
- yhteensattuma
- vertailu
- vertailuja
- kokoonpanossa
- Keskitetty
- keskittyminen
- tehty
- sekava
- peräkkäinen
- harkittu
- vakio
- jatkuvasti
- ohjaus
- hallinnassa
- muuntaa
- korjattu
- Hinta
- voisi
- Laskuri
- laskenta
- katettu
- Kristalli
- cs
- käyrä
- Leikkaus
- leikkaus
- tiedot
- toimittaa
- toimitettu
- toimitus
- Riippuen
- on kuvattu
- suunniteltu
- yksityiskohdat
- havaittu
- määritetty
- kehitetty
- erot
- eri
- ohjeet
- sijoiltaanmeno
- etäisyys
- ei
- annos
- laadittu
- Pudota
- aikana
- dynaaminen
- e
- E&T
- kukin
- Varhainen
- tehokkaasti
- elektrolyytti
- upotettu
- päästö
- Työllisiä
- loppu
- energia
- Tekniikka
- varmistaa
- laitteet
- virheet
- arvio
- Eetteri (ETH)
- arvioida
- arvioitu
- Tapahtumat
- esimerkki
- Paitsi
- lukuun ottamatta
- experience
- kokeilu
- kokeiluja
- ilmaistuna
- väärä
- Viikuna
- Elokuva
- suodattaa
- lopullinen
- Vihdoin
- Etunimi
- viisi
- virtaus
- seurannut
- jälkeen
- varten
- muoto
- Eteenpäin
- löytyi
- neljä
- Neljäs
- Pakastaminen
- alkaen
- jäädytetty
- FSC
- edelleen
- Gates
- ge
- generaattori
- lasi-
- hyvä
- hallitseva
- Gramma
- Kasvu
- terve
- tätä
- Koti
- Kotitoimisto
- HTTPS
- if
- kuva
- kuvien
- Imaging
- heti
- tärkeä
- parantaa
- in
- sisältää
- lisää
- inkuboitu
- itsenäinen
- indeksi
- Indeksit
- tietoa
- välitön
- ohjeet
- väline
- välineet
- integroitu
- liitäntä
- sisäinen
- tulee
- IT
- iteraatio
- toistojen
- Pitää
- tunnettu
- Kx
- johtaa
- Todennäköisesti
- LINK
- Keuhkot
- ylläpitäminen
- valmistettu
- valmistus
- materiaali
- Saattaa..
- välineet
- mitattu
- mittaus
- keskikokoinen
- menetelmä
- menetelmät
- hiiret
- mikroni
- Mikroskooppi
- minuuttia
- minimointia
- minimi
- mikseri
- seos
- ML
- Puhelinnumero
- tila
- seurataan
- lisää
- Morgan
- eniten
- MS
- moninkertainen
- kertomalla
- nanoteknologian
- luonto
- seuraava
- Nro
- normaali
- numero
- saada
- saatu
- of
- Office
- on
- ONE
- vain
- vastakkainen
- optimaalinen
- or
- tavallinen
- Muut
- muuten
- ulos
- yli
- yön aikana
- Happi
- Paperi
- parametrit
- hiukkanen
- Hyväksytty
- PBS
- varten
- osuus
- suoritettu
- lemmikki
- aave
- vaihe
- Fotonit
- kuva
- pixel
- sijoitettu
- Platon
- Platonin tietotieto
- PlatonData
- populaatiot
- osa
- sijainti
- paikannus
- positroni
- harjoitusta.
- valmis
- läsnäolo
- edellinen
- aiemmin
- tärkein
- Aikaisempi
- anturi
- menettelyt
- prosessi
- tuottaa
- Tuotteet
- asianmukaisesti
- protokolla
- toimittaa
- tarjoaa
- tarjoamalla
- osti
- laatu
- määrällisesti
- määrällinen
- määrä
- R
- Säteily
- radio
- alue
- hinta
- reaktio
- reaktiot
- reaaliaikainen
- sai
- äskettäinen
- kirjataan
- elpyminen
- Vähentynyt
- vähentäminen
- viite
- puhdistettu
- alue
- määräykset
- koskee
- jäädä
- jäljellä oleva
- poistaa
- poistettu
- rinnakkaista
- vaatimukset
- päätöslauselma
- REST
- Saatu ja
- arviot
- tarkistetaan
- Huone
- ajaa
- s
- sama
- skannata
- skannaus
- skannaa
- SCI
- tieteellinen
- Näytön
- Toinen
- sekuntia
- osiot
- SEM
- Herkkyys
- setti
- asetus
- setup
- näyttää
- Sigma
- signaali
- merkittävä
- Pii
- single
- Koko
- koot
- Viipale
- SLIDE
- pieni
- napsahtaa
- Tuotteemme
- ratkaisu
- Ratkaisumme
- lähde
- erityinen
- Kaupallinen
- spots
- vaiheissa
- standardi
- standardit
- Alkaa
- Aloita
- totesi
- tilastollisesti
- Vaihe
- Askeleet
- Levytila
- Strategia
- virta
- tutkittu
- opinnot
- Opiskelu
- riittävä
- toimittaa
- tutkituista
- synteesi
- vie
- tekniikka
- Technologies
- testi
- kuin
- että
- -
- sitten
- teoreettinen
- lämpö-
- Nämä
- kolmas
- tätä
- kolmella
- kynnys
- Kautta
- kauttaaltaan
- aika
- kertaa
- aikaleima
- kärki
- kudos
- että
- työkalu
- Toolbox
- Yhteensä
- raita
- Seuranta
- Muutos
- loukussa
- kaksi
- Uk
- Epävarmuus
- varten
- Odottamaton
- yksiköt
- asti
- käytetty
- käyttämällä
- tyhjiö
- arvo
- arvot
- Nopeus
- versio
- Vastaan
- vivo
- Jännite
- tilavuus
- volyymit
- vokselin
- W
- oli
- pesu
- vesi
- olivat
- kun
- onko
- joka
- vaikka
- koko
- tulee
- ikkuna
- with
- sisällä
- tuotto
- tuotti
- tuottaen
- zephyrnet
- Postinumero