همه معرف ها همانطور که دریافت شده استفاده شدند مگر اینکه خلاف آن ذکر شده باشد. تمام مواد شیمیایی از سیگما آلدریچ به جز مهره های شمارش (CountBright Absolute Counting Beads، Invitrogen) خریداری شد. ζ-پتانسیل با استفاده از Zetasizer NanoZS90 (Malvern Instruments) اندازه گیری شد. اندازه و مورفولوژی ذرات توسط SEM در میکروسکوپ JEOL JSM 7800F Prime با EDS یکپارچه برای ارائه آنالیز عنصری مورد مطالعه قرار گرفت. اندازه ذرات با اندازه گیری 50 ذره مستقل تعیین شد. کروماتوگرافی لایه نازک رادیویی فوری (ITLC) بر روی کاغذ کروماتوگرافی میکروفیبر شیشه ای Agilent Technologies آغشته به اسید سیلیسیک توسعه داده شد و با استفاده از یک اسکنر TLC شمارش جریان Lablogic و یک آشکارساز لوله مولتی پلایر نوری BioScan B-FC-3200 (PMT) با استفاده از نرم افزار Laura تجزیه و تحلیل شد. فاز متحرک ITLC از 0.175 مولار اسید سیتریک و 0.325 مولار تری سدیم سیترات در آب تشکیل شده بود مگر اینکه خلاف آن ذکر شده باشد. نمونههای رادیواکتیو با استفاده از Capintec CRC-25R (Capintec) یا LKB Wallac 1282 Compugamma CS (PerkinElmer) اندازهگیری شدند که دادهها با استفاده از نرمافزار EdenTerm جمعآوری شد. آزمایشهای فلوسیتومتری در یک مرتبکننده سلولی BD FACSMelody با استفاده از نرمافزار BD FACSChorus انجام شد. تصاویر PET/CT با استفاده از اسکنر NanoPET/CT (Mediso) به دست آمد، با استفاده از نرم افزار Nucline v.0.21 بازسازی شد و تصاویر با استفاده از نرم افزار VivoQuant (نسخه 3.5، InviCRO) تجزیه و تحلیل شدند. داده های Listmode توسط یک ابزار نرم افزاری خاص MATLAB که توسط Mediso توسعه یافته به دست آمد. اتورادیوگرافی با دستگاه GE Amersham Typhoon انجام شد.
سنتز ذرات سیلیس با اندازه زیر میکرومتر
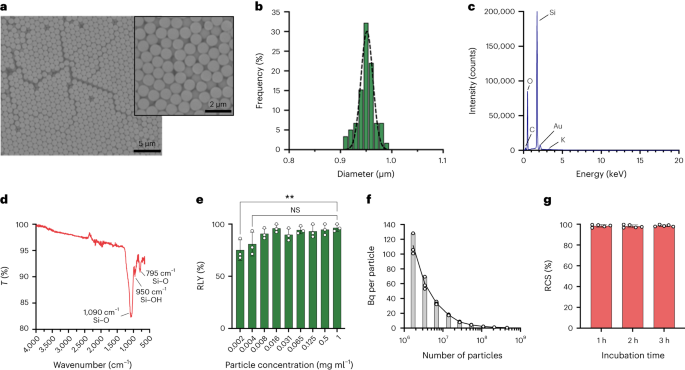
ذرات با استفاده از روش استوبر سنتز شدند. این روش مبتنی بر هیدرولیز و تراکم متوالی آلکوکسیدهای سیلیکون برای تولید ذرات سیلیس کروی و تک پراکنده است.27. تترااتیل ارتوسیلیکات (TEOS) به عنوان منبع سیلیکون، آمونیاک به عنوان کاتالیزور پایه و کلرید پتاسیم به عنوان الکترولیت استفاده شد. محلولی از TEOS در اتانول به طور مداوم به محلول حاوی کاتالیزور و الکترولیت اضافه شد. اصلاح مقدار شروع معرف یا نرخ افزودن، تفاوت هایی را در اندازه ذرات ایجاد می کند همانطور که قبلا گزارش شده است.28. در اینجا، دو محلول قبل از سنتز ذرات تهیه شد: محلول 1 حاوی 19.0 میلی مول TEOS در 33.3 میلی لیتر EtOH و محلول 2 حاوی 0.23 میلی مول KCl در 9 میلی لیتر آمونیاک، 65 میلی لیتر EtOH و 6.75 میلی لیتر HH.2O. برای سنتز، محلول 2 در یک فلاسک 250 میلی لیتری ته گرد قرار داده شد که در دمای 50 درجه سانتیگراد تحت هم زدن با دور 300 به مدت 15 دقیقه گرم شده بود. سپس محلول 1 به صورت قطره ای به محلول 2 اضافه شد (میزان عرضه 0.2 میلی لیتر دقیقه-1). پس از افزودن محلول 1، ذرات به دست آمده با سانتریفیوژ در 18,300 خالص شدند.g به مدت 3 دقیقه و پنج بار با EtOH شسته شد. در نهایت، SiO2 ریز ذرات تحت خلاء خشک شدند.
پیوند ذرات زیر میکرومتر با سیلان-PEG5k
20 میلی گرم میلی لیتر-1 محلول سیلان-PEG5k (Sigma Aldrich) در EtOH 98٪ به محلول smSiP در 5 میلی گرم میلی لیتر اضافه شد.-1 در EtOH 98٪ و 2.8٪ آمونیاک. مخلوط یک شبه در دمای اتاق هم زده شد و ذرات با سانتریفیوژ در 18,300 بازیابی شدند.g به مدت 3 دقیقه در نهایت، ذرات سه بار با آب مقطر شسته و یک شبه در خلاء خشک شدند. محلول های شستشو یک شبه یخ خشک شدند و مقدار سیلان-PEG متصل نشده بود.5k وزن برای محاسبه بازده واکنش. 0.05 میلی گرم میلی لیتر-1 راه حل smSiP-PEG5k در آب مقطر برای واکنش های نشاندار رادیویی بیشتر استفاده شد.
[68Ga] GaCl3
گالیوم-68 به صورت [68Ga] GaCl3 از یک Eckert و Ziegler 68GE/68ژنراتور Ga در HCl فوق خالص (4 میلی لیتر، 0.1 M) که مطابق با الزامات عمل تولید خوب (ABX) ساخته شده است.
غلظت [68Ga] GaCl3 شستشو با تبادل کاتیونی
غلظت شستشو با استفاده از تنظیمات شرح داده شده در شکل تکمیلی انجام شد. 1. ابتدا 4 میلی لیتر از [68Ga] GaCl3 شستشو بر روی یک کارتریج Strata-XC 33u (Phenomenex) بارگذاری شد و مایع شستشو دور انداخته شد. سپس کارتریج با 5 میلی لیتر محلول استون/0.1 مولار هیدروکلراید (80:20) شسته شد و مایع شستشو دور ریخته شد. در نهایت، غلیظ [68Ga] GaCl3 با افزودن 700 میکرولیتر محلول استون / 0.05 مولار HCl (98:2) جمع آوری شد و در زیر یک نیتروژن خشک شد.2 جریان و در 50 میکرولیتر از بافر HEPES 0.5 مولار، (pH 4.9) مجدداً معلق شد. Radio-TLC در مراحل مختلف برای کنترل کیفیت انجام شد. پروتکل تقریباً 20 دقیقه طول می کشد و بازده بازیابی 86.2 ± 8.5٪ را ارائه می دهد.
برچسب گذاری رادیویی ذرات سیلیس در غلظت های مختلف با 68Ga
ذرات سیلیس در غلظتهای مختلف (از 1 تا 0.002/XNUMX میلیگرم میلیلیتر) مجدداً معلق شدند.-1) در بافر HEPES 0.5 M (pH 4.9). سپس 50 میکرولیتر از محلول قبل از افزودن غلیظ به لوله واکنش اضافه شد.68Ga] GaCl3 شستشو در 50 میکرولیتر از بافر HEPES 0.5 مولار (pH 4.9). واکنش ها در دمای 90 درجه سانتی گراد به مدت 30 دقیقه انجام شد و رادیو-TLC برای محاسبه بازده رادیوشیمیایی انجام شد.
اندازه گیری غلظت ذرات با فلوسایتومتری
غلظت ذرات توسط فلوسیتومتری با استفاده از دانههای شمارش (CountBright Absolute Counting Beads، Invitrogen) طبق دستورالعملهای سازنده محاسبه شد. ذرات سیلیس در 0.05 میلی گرم میلی لیتر مجدداً معلق شدند-1به مدت 10 دقیقه تحت فراصوت قرار داده و از یک فیلتر اندازه قطع شده 10 میکرومتری (فیلتر سرنگ KX، نایلون، 25 میلی متر، 10 میکرومتر) عبور داده شد. مهره های شمارش مطلق CountBright تا دمای اتاق گرم شده و به مدت 30 ثانیه گرداب شدند. سپس 50 میکرولیتر دانه به 300 میکرولیتر ذرات سیلیس اضافه شد و مخلوط به مدت 30 دقیقه گرداب شد تا محلولی همگن به دست آید. نمونه بر روی فلوسیتومتر اجرا شد و آستانه پراکندگی رو به جلو (FSC) تنظیم شد تا دانهها و ذرات روی نمودار پراکندگی خطی-FSC در مقابل خطی را در بر گیرد. پس از آن، ولتاژ آشکارساز فلورسانس برای دانههای شمارش تنظیم شد و یک استراتژی دروازهای برای جداسازی ذرات سیلیس و جمعیت دانههای شمارش انجام شد. در نهایت دروازههای روی ذرات و مهرههای شمارش مطلق ترسیم شد و برای هر نمونه 1,000 رویداد مهره ثبت شد. با استفاده از این استراتژی، تعداد ذرات در محلول با استفاده از معادله زیر محاسبه شد:
$$begin{array}{l}displaystyle{mathrm{Absolute}},{mathrm{count}},left(frac{mathrm{Particles}}{{{upmu l}}}right)=displaystylefrac{({mathrm{ ذرات}}،{mathrm{شمار}}، زمان،{mathrm{Counting}}،{mathrm{Beads}}،{mathrm{volume}}}}}({mathrm{Counting}}،{mathrm{Beads}} ,{mathrm{count}},times,{mathrm{Particles}},{mathrm{volume}}} بارها,{mathrm{Counting}},{mathrm{beads}},{mathrm{concentration}}چپ(frac {{mathrm{Beads}}}{{{upmu l}}}راست)پایان{آرایه}$$
برچسب گذاری رادیویی 500 smSiP
پانصد smSiP به 50 میکرولیتر غلیظ اضافه شد [68Ga] GaCl3 شستشو در 0.5 M بافر HEPES pH 4.9. سپس 5.6/80 میکرولیتر پلی سوربات 90 اضافه شد و مخلوط در دمای 30 درجه سانتیگراد به مدت 900 دقیقه با سرعت XNUMX دور در دقیقه در مخلوط کن حرارتی حرارت داده شد. پس از آن، یک پروتکل نهایی تصفیه چند مرحله ای برای حذف واکنش نداده/کلوئیدی طراحی شد. 68Ga. پنجاه میکرولیتر EDTA 10 میلی مولار اضافه شد و مخلوط به مدت 5 دقیقه در دمای اتاق انکوبه شد. سپس ذرات به مدت 3 دقیقه در 18,300 سانتریفیوژ شدندgدر 500 میکرولیتر PBS حاوی 1 میلیمولار EDTA + 0.1 درصد پلیسوربات 80 مجدداً معلق شد و به آرامی به مدت 10 ثانیه گرداب شد. ذرات دوباره سانتریفیوژ شدند، با محلول 0.1 میلی مولار EDTA + 0.1٪ پلی سوربات 80 در PBS شسته شدند و به آرامی به مدت 10 ثانیه گرداب شدند. در نهایت، ذرات سانتریفیوژ شده و پنج بار دیگر با PBS + 0.1% پلیسوربات 80 شسته و در 500 میکرولیتر PBS معلق شدند. واکنش نشانگذاری رادیویی در طی مراحل واکنش متوالی برای ارزیابی وجود کلوئیدها (که در صورت عدم حذف صحیح با ذرات اشتباه گرفته میشوند)، برچسبگذاری رادیویی ذرات و خلوص محصول نهایی توسط رادیو-TLC نظارت شد. RLY با مقایسه بین میزان رادیواکتیویته در ذرات و مواد رویی پس از مراحل شستشو محاسبه شد.
کسری
برای استراتژی شکنش، حجم از 0.5 میکرولیتر تا 20 میکرولیتر از 68Ga-smSiP در غلظت نظری 1 میکرولیتر ذره-1 در مراحل 1 میکرولیتری (0.5، 1، 2، 3...) به لوله های نمونه مختلف اضافه شدند و PBS اضافه شد تا حجم نهایی به 50 میکرولیتر برسد. سپس 37.5 میکرولیتر از لوله اول به لوله نمونه دوم، 25 میکرولیتر از لوله دوم به لوله سوم و در نهایت 12.5 میکرولیتر از لوله سوم به لوله چهارم تزریق شد. این استراتژی چهار لوله در هر نمونه با حجم نهایی 12.5 میکرولیتر در هر لوله را فراهم می کند. رادیواکتیویته در هر لوله در یک شمارنده گاما اندازه گیری شد و مقادیر بر حسب kBq با استفاده از منحنی کالیبراسیون برای مقایسه و تجزیه و تحلیل بیشتر محاسبه شد. نمونههای حاوی بیشتر رادیواکتیویته تنها در یک لوله به مدت 30 ثانیه در دمای اتاق تحت فراصوت قرار گرفتند و در معرض مرحله دوم شکنش قرار گرفتند. سپس، نمونههایی که در آنها تمام رادیواکتیویته در یک لوله (با فعالیت ناچیز در سه لوله دیگر) یافت شد، برای آزمایشهای in vivo/ex vivo بیشتر استفاده شد.
تصویربرداری فانتوم PET/CT
یک آزمایش تصویربرداری فانتوم با یکی انجام شد 68Ga-smSiP. از یک کانول برای رساندن ذره به لوله نمونه استفاده شد تا ارزیابی شود که آیا یک ذره می تواند در لوله کانول در حین تجویز به دام افتاده باشد یا خیر. به طور خلاصه، لوله فانتوم در اسکنر nanoPET/CT با انتهای نوک کانولا متصل به لوله قرار داده شد. پس از شروع اکتساب PET، ذره معلق مجدد در 100 میکرولیتر PBS با یک سرنگ انسولین متصل به ابتدای کانولا تحویل داده شد. سپس کانول با 50 میکرولیتر PBS شسته شد تا از انتقال ذرات به داخل لوله فانتوم اطمینان حاصل شود. اکتساب PET به مدت 2 ساعت و سپس سی تی اسکن استاندارد انجام شد.
تصویربرداری in vivo PET/CT
مطالعات تصویربرداری از حیوانات به لحاظ اخلاقی بررسی و مطابق با قوانین مربوط به حیوانات (رویههای علمی) قانون 1986 (ASPA) اداره کشور انگلستان که بر آزمایشهای حیوانی حاکم است، انجام شد. تصویربرداری درون تنی در موشهای سالم BALB/c 8 هفتهای انجام شد. حیوانات با ایزوفلوران (2 تا 3 درصد در اکسیژن) بیهوش شدند، کانوله شدند و تحت بیهوشی روی تخت اسکنر قرار گرفتند. بستر تا 37 درجه سانتیگراد با جریان هوای داخلی گرم شد تا حیوان در دمای طبیعی بدن نگه داشته شود و میزان تنفس کنترل شد و در 60 تا 80 تنفس در دقیقه حفظ شد.-1 در طول اسکن حفظ کنترل دمای حیوان مهم است، زیرا کاهش غیرمنتظره دما می تواند منجر به کاهش سرعت ذره در خون شود. یکی 68Ga-smSiP (n = 4) یا 68Ga-smSiP–PEG5k ذره (n = 2) از طریق کانولا در 100 میکرولیتر PBS، و به دنبال آن شستشو با 50 میکرولیتر PBS پس از شروع اکتساب PET (حالت تصادفی 1:5؛ پنجره زمانی همزمانی 5 ns) انجام شد. PET به مدت 2 ساعت ثبت شد و سپس سی تی اسکن نیم دایره ای انجام شد. دمای بدن و تعداد تنفس حیوان در طول کل فرآیند کنترل شد. تصاویر پویا PET/CT با استفاده از بازسازی 3 بعدی Tera-Tomo (پنجره انرژی 400-600 کو، حالت تصادفی 1:5، 20 تکرار و 1 زیر مجموعه) در اندازه وکسل 0.4 × 0.4 × 0.4 میلی متر بازسازی شدند.3 و برای تضعیف، پراکندگی و پوسیدگی اصلاح شد. دادههای حالت فهرست برای همه اکتسابهای PET/PEPT را میتوان برای یافت 68Ga-smSiP در مرجع. 29 و برای 68Ga-smSiP–PEG5k در رفر. 30.
ردیابی زمان واقعی
ابتدا، داده ها از اسکنر در قالب لیست حالت (یعنی قالبی با مهر زمان و شاخص کریستالی برای فوتون های تصادفی شناسایی شده) صادر شد. یک تبدیل هندسی برای تبدیل از شاخص های کریستالی به موقعیت در واحدهای میلی متری اعمال شد. روش بیرمنگام به طور مکرر MDP را از زیر مجموعه ای از همه LoR ها محاسبه می کند. این کار را با دور انداختن LoRهایی که از فاصله تعیین شده از MDP دورتر هستند، انجام می دهد، زیرا احتمالاً از LoRهای نادرست به وجود می آیند، برای مثال، LoRهایی که ممکن است از پراکندگی سرچشمه بگیرند. MDP با هر تکرار اصلاح می شود. تعداد تکرارها به طور موثر توسط f-factor و مربوط به تعداد کل LoRهایی است که برای تخمین موقعیت ذره نهایی در آن زیر مجموعه استفاده می شود (به عنوان مثال، یک f-ضریب 0.5 به این معنی است که حلقه تکرار زمانی خاتمه می یابد که 50٪ از LoR ها در زیر مجموعه باقی بماند. تعداد LoR های مورد استفاده در یک زیرمجموعه را می توان برای بهبود نمونه گیری زمانی کاهش داد (زیر مجموعه ها به صورت متوالی و بدون همپوشانی هستند) به قیمت افزایش عدم قطعیت در موقعیت (جزئیات بیشتر الگوریتم را می توان در پارکر و همکاران یافت).5) روش بیرمنگام برای تجزیه و تحلیل داده های حالت لیست از اسکنر PET استفاده شد. اندازه نمونه تطبیقی برای ردیابی ذره در موش استفاده شد. اندازه نمونه برای دستیابی به تعادل نمونه گیری زمانی کافی و در عین حال به حداقل رساندن خطاهای موقعیت یابی تنظیم شد. حجم نمونه بین 100 تا 200 LoRs در مراحل اولیه اسکن ها (کمتر از 60 ثانیه از شروع اسکن)، با f = 0.1، با فواصل تقریباً 1-5 ثانیه. در زمانهای اسکن > 60 ثانیه، اندازههای نمونه بین 1,000 تا 2,000 متغیر بود که بسته به آزمایش in vivo فواصل زمانی بین 30 تا 60 ثانیه را به همراه داشت. تعداد شمارش های مورد استفاده برای محاسبه MDP (در تکرار نهایی) را می توان با ضرب حجم نمونه در عدد بدست آورد. f- ارزش عاملی این پارامترها بر اساس تجربه قبلی بوده و توسط انتشارات قبلی اطلاع رسانی شده است1.
سرعت به عنوان به دست آمد (sqrt{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) جایی که ({v}_{m}^{2}) سرعت در است x, y و z جهت ها.
جذب اندام خارج از بدن
جذب در اندام های مختلف با شمارش گاما ارزیابی شد. پس از تصویربرداری in vivo PET/CT، حیوانات با دررفتگی دهانه رحم کشته شدند و اندامها بریده شدند و برای شمارش رادیواکتیویته در یک شمارنده گاما وزن شدند (LKB Wallac 1282 Compugamma CS). داده ها به صورت درصد دوز تزریقی (دوز در اندام / دوز کل تزریق شده) در هر گرم بافت بیان شد (% ID g-1).
اتورادیوگرافی
رادیواکتیویته در ریهها با یک آشکارساز تشعشع (کاوشگر EP15، مورگان) ردیابی شد و ریهها با چاقوی جراحی به بخشهای کوچکی بریده شدند تا اینکه بخش کوچکی از بافت با سیگنال رادیواکتیو به دست آمد. بافت در دمای 80- درجه سانتیگراد ایزوپروپانول منجمد شد. بلافاصله پس از انجماد، بافت در محیط دمای بهینه برش قرار داده شد و در برش های 20 میکرومتری در کرایوستات برش داده شد. هر برش با آشکارساز بررسی شد تا زمانی که قطعه رادیواکتیو پیدا شد. برش قبلی (زیر پس زمینه)، رادیواکتیو و بعدی (زیر پس زمینه) بر روی لام میکروسکوپ Superfrost (Epredia) قرار گرفتند. بقیه بافت باقیمانده نیز زیر پس زمینه بود. لام میکروسکوپ با سه بخش با یک فیلم چسبنده پوشانده شد و یک شبه با صفحه اتورادیوگرافی GE مخالفت کرد. صفحه با استفاده از GE Amersham Typhoon با وضوح 25 میکرومتر و تنظیم PMT 4,000 مورد تجزیه و تحلیل قرار گرفت. تصویر اتورادیوگرافی بر روی تصویر بافت قرار داده شد و یک نقطه از رادیواکتیویته را در برش رادیواکتیو نشان داد. برای تعیین کمیت، استانداردهایی در فعالیتهای مختلف شناخته شده تهیه شد و هر یک به صورت پنجتایی 1 میکرولیتری در کاغذ مشاهده شد. لکه ها در همان صفحه نمایش فسفر ذخیره سازی، BAS-IP MS (استاندارد چند منظوره) از جنرال الکتریک به عنوان ذرات منفرد انکوبه شدند. این تصویر با Amersham Typhoon 5 با نرم افزار کنترل نسخه 2.0 در حالت فسفر با اندازه پیکسل 100 میکرومتر و حساسیت 4,000 به دست آمده است. تصاویر با نرم افزار ImageQantTL v10.0-261 با استفاده از جعبه ابزار کمیت ژل اندازه گیری شدند. لکه ها با انتخاب یک منطقه بلافاصله قبل یا بعد از لکه به عنوان پس زمینه ثابت اصلاح شدند. حجم حاصل از نقطه برای محاسبه Bq در ذره بر اساس منحنی کالیبراسیون استفاده شد.
آمار و تکرارپذیری
برای تجزیه و تحلیل کمی، حداقل سه تکرار بیولوژیکی به استثنای دادههای in vivo تجزیه و تحلیل شد. 68Ga-smSiP–PEG5k (n = 2). داده ها با استفاده از آنالیز واریانس یک طرفه معمولی (ANOVA) با آزمون مقایسات چندگانه دانت و استودیو مورد تجزیه و تحلیل قرار گرفت. t-تست. آ P مقدار <0.05 از نظر آماری معنی دار در نظر گرفته شد.
- محتوای مبتنی بر SEO و توزیع روابط عمومی. امروز تقویت شوید.
- PlatoData.Network Vertical Generative Ai. به خودت قدرت بده دسترسی به اینجا.
- PlatoAiStream. هوش وب 3 دانش تقویت شده دسترسی به اینجا.
- PlatoESG. کربن ، CleanTech، انرژی، محیط، خورشیدی، مدیریت پسماند دسترسی به اینجا.
- PlatoHealth. هوش بیوتکنولوژی و آزمایشات بالینی. دسترسی به اینجا.
- منبع: https://www.nature.com/articles/s41565-023-01589-8
- :است
- :نه
- :جایی که
- ][پ
- 000
- 1
- 10
- 100
- 12
- ٪۱۰۰
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- مطلق
- مطابقت
- رسیدن
- به دست آورد
- اکتساب
- جمع آوری
- عمل
- فعالیت ها
- فعالیت
- انطباقی
- اضافه
- اضافه کردن
- اضافه
- تنظیم شده
- اداره
- حکومت
- پیشرفت
- پس از
- بعد از آن
- از نو
- AIR
- AL
- الگوریتم
- معرفی
- همچنین
- آمونیاک
- مقدار
- an
- تحلیل
- تحلیل
- لنگر
- و
- حیوان
- حیوانات
- اعمال می شود
- تقریبا
- هستند
- بوجود می آیند
- AS
- At
- b
- زمینه
- برج میزان
- پایه
- مستقر
- اساس
- BD
- BE
- قبل از
- شروع
- در زیر
- میان
- بیرمنگام
- خون
- بدن
- بطور خلاصه
- به ارمغان بیاورد
- بافر
- by
- محاسبه
- محاسبه
- محاسبه می کند
- محاسبه
- CAN
- انجام
- کاتالیست
- سلول
- مواد شیمیایی
- انتخاب
- کلیک
- تصادف
- مقایسه
- مقایسه
- مرکب
- متمرکز
- غلظت
- انجام
- اشتباه
- متوالی
- در نظر گرفته
- ثابت
- به طور مداوم
- کنترل
- کنترل
- تبدیل
- اصلاح شده
- هزینه
- میتوانست
- مقابله با
- با احتساب
- پوشش داده شده
- کریستال
- cs
- منحنی
- برش
- برش
- داده ها
- ارائه
- تحویل داده
- تحویل
- بستگی دارد
- شرح داده شده
- طراحی
- جزئیات
- شناسایی شده
- مشخص
- توسعه
- تفاوت
- مختلف
- جهت ها
- جابجایی
- فاصله
- میکند
- مقدار
- کشیده شده
- قطره
- در طی
- پویا
- e
- E&T
- هر
- در اوایل
- به طور موثر
- الکترولیت
- جاسازی شده
- نشر
- به کار گرفته شده
- پایان
- انرژی
- مهندسی
- اطمینان حاصل شود
- تجهیزات
- خطاهای
- تخمین زدن
- اتر (ETH)
- ارزیابی
- ارزیابی
- حوادث
- مثال
- جز
- به استثنای
- تجربه
- تجربه
- آزمایش
- بیان
- غلط
- انجیر
- فیلم
- فیلتر
- نهایی
- سرانجام
- نام خانوادگی
- پنج
- جریان
- به دنبال
- پیروی
- برای
- قالب
- به جلو
- یافت
- چهار
- چهارم
- انجماد
- از جانب
- منجمد
- FSC
- بیشتر
- گیتس
- ge
- ژنراتور
- شیشه
- خوب
- حکومت داری
- گرم
- رشد
- سالم
- اینجا کلیک نمایید
- صفحه اصلی
- دفتر خانه
- HTTPS
- if
- تصویر
- تصاویر
- تصویربرداری
- بلافاصله
- مهم
- بهبود
- in
- شامل
- افزایش
- جوجه کشی شده است
- مستقل
- شاخص
- Indices
- اطلاع
- فوری
- دستورالعمل
- سند
- ابزار
- یکپارچه
- رابط
- داخلی
- به
- IT
- تکرار
- تکرار
- نگاه داشتن
- شناخته شده
- Kx
- رهبری
- احتمالا
- ارتباط دادن
- شش
- نگهداری
- ساخته
- تولید
- ماده
- ممکن است..
- به معنی
- اندازه گیری
- اندازه گیری
- متوسط
- روش
- روش
- موشها
- میکرون
- میکروسکپ
- دقیقه
- به حداقل رساندن
- حد اقل
- مخلوط کن
- مخلوط
- ML
- موبایل
- حالت
- نظارت
- بیش
- مورگان
- اکثر
- MS
- چندگانه
- ضرب شدن
- فناوری نانو
- طبیعت
- بعد
- نه
- طبیعی
- عدد
- گرفتن
- به دست آمده
- of
- دفتر
- on
- ONE
- فقط
- مخالف
- بهینه
- or
- عادی
- دیگر
- در غیر این صورت
- خارج
- روی
- شبانه
- اکسیژن
- مقاله
- پارامترهای
- ذره
- گذشت
- PBS
- برای
- درصد
- انجام
- حیوان خانگی
- شبح
- فاز
- فوتون ها
- تصویر
- پیکسل
- قرار داده شده
- افلاطون
- هوش داده افلاطون
- PlatoData
- جمعیت
- بخشی
- موقعیت
- تثبیت موقعیت
- پوزیترون
- تمرین
- آماده شده
- حضور
- قبلی
- قبلا
- نخستین
- قبلا
- کاوشگر
- روش
- روند
- تولید کردن
- محصول
- به درستی
- پروتکل
- ارائه
- فراهم می کند
- ارائه
- خریداری شده
- کیفیت
- کمی سازی
- کمی
- مقدار
- R
- تابش
- رادیو
- محدوده
- نرخ
- واکنش
- واکنش
- زمان واقعی
- اخذ شده
- اخیر
- ثبت
- بهبود
- کاهش
- کاهش
- مرجع
- پالوده
- منطقه
- مقررات
- مربوط می شود
- ماندن
- باقی مانده
- برداشتن
- حذف شده
- تکرار
- مورد نیاز
- وضوح
- REST
- نتیجه
- این فایل نقد می نویسید:
- بررسی
- اتاق
- دویدن
- s
- همان
- اسکن
- پویش
- اسکن
- SCI
- علمی
- پرده
- دوم
- ثانیه
- بخش
- SEM
- حساسیت
- تنظیم
- محیط
- برپایی
- نمایش
- سیگما
- سیگنال
- قابل توجه
- سیلیکون
- تنها
- اندازه
- اندازه
- تکه
- نمایش
- کوچک
- ضربه محکم و ناگهانی
- نرم افزار
- راه حل
- مزایا
- منبع
- خاص
- Spot
- نقاط
- مراحل
- استاندارد
- استانداردهای
- شروع
- راه افتادن
- اظهار داشت:
- از نظر آماری
- گام
- مراحل
- ذخیره سازی
- استراتژی
- جریان
- مورد مطالعه قرار
- مطالعات
- در حال مطالعه
- کافی
- عرضه
- بررسی
- سنتز
- طول می کشد
- تکنیک
- فن آوری
- آزمون
- نسبت به
- که
- La
- سپس
- نظری
- حرارتی
- اینها
- سوم
- این
- سه
- آستانه
- از طریق
- سراسر
- زمان
- بار
- برچسب زمان
- نوک
- بافت
- به
- ابزار
- جعبه ابزار
- جمع
- مسیر
- پیگردی
- دگرگونی
- به دام افتاده
- دو
- Uk
- تردید
- زیر
- غیر منتظره
- واحد
- تا
- استفاده
- با استفاده از
- خلاء
- ارزش
- ارزشها
- VeloCity
- نسخه
- در مقابل
- داخل بدن
- ولتاژ
- حجم
- جلد
- وکسل
- W
- بود
- شستن
- آب
- بود
- چه زمانی
- چه
- که
- در حین
- تمام
- اراده
- پنجره
- با
- در داخل
- بازده
- به همراه داشت
- متورق
- زفیرنت
- زیپ