سونوگرافی متمرکز با فرکانس پایین غیر تهاجمی (FUS)، که همراه با میکروحبابهای تزریقی داخل وریدی ارائه میشود، میتواند به طور موقت سد خونی مغزی (BBB) را باز کند و داروهایی را که با بیماری آلزایمر مبارزه میکنند، وارد مغز کرده و به اهداف درمانی خود برسند. ثابت شده است که ترکیب یک داروی کاهش دهنده پلاک آمیلوئید-بتا و به دنبال آن FUS نسبت به درمان دارویی به تنهایی در کاهش رسوب پلاک در مغز ایمن و موثرتر است. در حالی که بیماری آلزایمر را درمان نمی کند، کاهش پلاک می تواند تاثیر شناختی بیماری را کاهش دهد و پیشرفت آن را کند کند.
یافته های اولیه از یک کارآزمایی بالینی کوچک برای اولین بار در انسان، انجام شده در موسسه علوم اعصاب راکفلر WVU و گزارش شده در مجله پزشکی نیوانگلند (NEJM) این امید را برانگیزد که این درمان ترکیبی ممکن است روزی به استاندارد مراقبت تبدیل شود. در حقیقت، 60 دقیقه، یک مجله خبری تلویزیونی محبوب CBS، یک مطلب طولانی را پخش کرد نمایه تحقیق پیشگام از جراح مغز و اعصاب علی رضایی اوایل این ماه، که شامل مصاحبه با یکی از سه شرکت کننده در این کارآزمایی بالینی آلزایمر بود.
رضایی و همکارانش از دستگاه سونوگرافی متمرکز استفاده میکنند Exablate مدل 4000 نوع 2) برای ایجاد اختلال در BBB در بیماران، در عرض دو ساعت پس از انفوزیون داخل وریدی آدوکانوماب. Aducanumab و lecanemab (که در کارآزمایی نیز مورد آزمایش قرار خواهند گرفت) درمانهای آنتیبادی مونوکلونال توسط سازمان غذا و داروی ایالات متحده (FDA) پاکسازی شدهاند که میتوانند پلاکهای آمیلوئید بتا را کاهش دهند. با این حال، BBB مانع از ورود بیشتر این آنتی بادی ها به مغز می شود.
کارآزمایی بالینی اثبات مفهوم شامل سه شرکت کننده مبتلا به بیماری آلزایمر خفیف بود. هدف ارزیابی ایمنی و امکان سنجی ترکیب آدوکانوماب با FUS برای باز کردن BBB و افزایش انتقال دارو و حذف آمیلوئید بود.
برای روش FUS، به بیماران یک کلاه ایمنی نیمکره ای حاوی 1024 منبع اولتراسوند قابل کنترل مستقل تعبیه شد. این منابع امواج اولتراسوند را تحت هدایت MRI بلادرنگ به سمت اهداف منتشر می کنند. در طول سونیکاسیون، سوسپانسیونی از حبابهای پرفلوئوروپروپان محصور در فسفولیپید به صورت داخل وریدی تزریق میشود. این تیم از سیگنالهای پراکنده از این حبابهای کوچک برای تعیین سطوح توان صوتی مناسب استفاده کرد که با خیال راحت BBB را باز میکند.
پس از تکمیل روش FUS، محققان از MRI با وزن T1 با تقویت کنتراست گادولینیوم برای تعیین باز شدن BBB در مکانهای مورد نظر استفاده کردند که 24 و 48 ساعت بعد تکرار شد تا تأیید شود که BBB بسته شده است. آنها همچنین MRI پیگیری را 30 روز و یک سال پس از اتمام درمان ترکیبی انجام دادند.

شرکت کنندگان شش درمان ماهانه آدوکانوماب داخل وریدی با افزایش دوز (از 1 میلی گرم بر کیلوگرم وزن بدن تا 6 میلی گرم بر کیلوگرم) و به دنبال آن FUS دریافت کردند. محققان توضیح میدهند که در این مرحله از کارآزمایی بالینی، آنها کاربرد FUS را به یک نیمکره مغز، در مناطقی از لوب فرونتال، لوب تمپورال یا هیپوکامپ با سطوح بالای پلاک آمیلوئید بتا محدود کردند. نواحی مغز مربوطه در نیمکره طرف مقابل که در معرض FUS قرار نگرفته بودند به عنوان کنترل عمل کردند. در طول مرحله پیگیری، بیماران انفوزیون ماهیانه 10 میلی گرم بر کیلوگرم آدوکانوماب بدون FUS دریافت کردند.
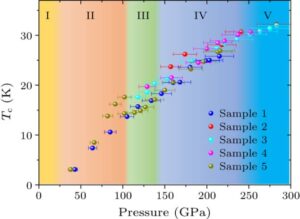
این تیم برای تعیین کمیت سطح آمیلوئید بتا، این کار را انجام داد 18اسکن F-florbetaben PET در ابتدا، در هفته های 11، 19 و 26 در طول درمان، و در هفته های XNUMX و یک ساله در مرحله پیگیری انجام می شود. رضایی گزارش می دهد که برای هر سه بیمار، 18اسکنهای PET F-florbetabin نشان داد که پس از 26 هفته، پلاکهای آمیلوئید بتا به طور متوسط 32 درصد (اندازهگیری شده از طریق نسبت ارزش جذب استاندارد) در مناطق مغزی که BBB باز شده بود، در مقایسه با مناطق مربوطه در نیمکره درماننشده کاهش یافت. .
کاهش در مقدار سنتیلوئید، مقیاسی که برای استاندارد کردن اندازهگیریهای بار آمیلوئید مبتنی بر PET استفاده میشود، برای سه شرکتکننده به ترتیب 48، 49 و 63 درصد بود. رضایی خاطرنشان می کند که کارآزمایی بالینی میزان نفوذ آنتی بادی مونوکلونال را تعیین نکرد زیرا برای این منظور طراحی نشده بود.
بیماران در حال حاضر برای مرحله دوم کارآزمایی بالینی که از lecanemab به عنوان درمان آنتی بادی مونوکلونال استفاده می کند، استخدام می شوند. رضایی توضیح می دهد: "ما توسط FDA محدود شده ایم تا 40 سی سی از مغز را درمان کنیم." FUS فقط یک بار در ماه به مدت شش ماه، قابل مقایسه با روش های آدوکانوماب، با دهانه 1 BBB بیمار تا 10 سی سی تجویز می شود. سپس بیماران زیر BBB به ترتیب تا 20 و 40 سی سی خواهند داشت.

سونوگرافی متمرکز با هدایت MR، آنتی بادی درمانی را مستقیماً به مغز ارائه می دهد
در 60 دقیقه دن میلر، بیمار 61 ساله، که همسرش برای اولین بار چهار سال قبل متوجه تغییرات رفتاری شد، گفت که مشاهده آخرین تصاویر MR مغز او که کاهش پلاک را نشان میدهد، «سوررئال» بود. او هنوز هم گاهی رفتارهای غیرعادی از خود نشان می دهد، اما هیچ پیشرفت قابل مشاهده دیگری وجود ندارد. میلر و همسرش به آینده امیدوار هستند.
در مشایعت NEJM سرمقالهیکی دیگر از پیشگامان در استفاده بالینی FUS، Kullervo Hynynen مؤسسه تحقیقاتی Sunnybrook در تورنتو، خاطرنشان می کند که «گسترش درمان به حجم قابل توجه بالینی در هر دو طرف مغز برای ارزیابی اثربخشی آن در کاهش پیشرفت بیماری بسیار مهم است. مطالعات بیشتری برای ایجاد ایمنی و اثربخشی طولانیمدت مورد نیاز است و دستگاههای درمانی مقرونبهصرفه که به راهنماییهای MRI آنلاین وابسته نیستند، باید برای دسترسی گستردهتر توسعه داده شوند.»
اما هاینن مانند میلر خوشبین است.
- محتوای مبتنی بر SEO و توزیع روابط عمومی. امروز تقویت شوید.
- PlatoData.Network Vertical Generative Ai. به خودت قدرت بده دسترسی به اینجا.
- PlatoAiStream. هوش وب 3 دانش تقویت شده دسترسی به اینجا.
- PlatoESG. کربن ، CleanTech، انرژی، محیط، خورشیدی، مدیریت پسماند دسترسی به اینجا.
- PlatoHealth. هوش بیوتکنولوژی و آزمایشات بالینی. دسترسی به اینجا.
- منبع: https://physicsworld.com/a/focused-ultrasound-plus-plaque-reducing-drugs-could-slow-alzheimers-progression/
- : دارد
- :است
- :نه
- :جایی که
- $UP
- 1
- 10
- 11
- 19
- 20
- 24
- 26
- 30
- 90
- a
- دسترسی
- صوتی
- اضافی
- اداره
- حکومت
- پس از
- معرفی
- تنها
- همچنین
- آلزایمر
- آلزایمر
- آمیلوئید
- an
- و
- دیگر
- آنتی بادی
- پادتن
- کاربرد
- مناسب
- هستند
- محدوده
- AS
- ارزیابی
- At
- میانگین
- سد
- خط مقدم
- BE
- زیرا
- شدن
- بوده
- رفتار
- بودن
- بدن
- هر دو
- هر دو طرف
- مغز
- گسترده تر
- بار
- اما
- by
- CAN
- اهميت دادن
- مرکز
- تبادل
- کلیک
- بالینی
- از نظر بالینی
- بسته
- شناختی
- همکاران
- مبارزه با
- ترکیب
- ترکیب شده
- ترکیب
- قابل مقایسه
- مقایسه
- اتمام
- تکرار
- کنتراست
- کنترل
- گروه شاهد
- متناظر
- مقرون به صرفه
- میتوانست
- بسیار سخت
- پخت
- روز
- تحویل داده
- ارائه
- تحویل
- سپرده
- طراحی
- مشخص کردن
- توسعه
- دستگاه
- دستگاه ها
- DID
- جهت دار
- مستقیما
- مرض
- مختل کردن
- مقدار
- دارو
- تحویل مواد مخدر
- مواد مخدر
- در طی
- پیش از آن
- موثر
- اثر
- قادر ساختن
- انگلستان
- بالا بردن
- تقویت
- وارد
- وارد شدن
- تشدید
- ایجاد
- ارزیابی
- نمایشگاه ها
- توضیح دهید
- توضیح می دهد
- قرار گرفتن در معرض
- واقعیت
- FDA
- امکان پذیری
- نهایی
- یافته ها
- نام خانوادگی
- متمرکز شده است
- به دنبال
- پیروی
- غذا
- غذا و داروی آمریکا (FDA)
- برای
- چهار
- از جانب
- بیشتر
- آینده
- راهنمایی
- بود
- آیا
- he
- سلامتی
- زیاد
- خود را
- امید
- امیدوار
- ساعت ها
- اما
- HTTPS
- تصویر
- تصاویر
- تأثیر
- in
- مشمول
- به طور مستقل
- اطلاعات
- دم کرده
- تزریق
- موسسه
- مصاحبه
- به
- داخل وریدی
- داخل وریدی
- موضوع
- IT
- ITS
- روزنامه
- JPG
- بعد
- سطح
- پسندیدن
- محدود شده
- مکان
- دراز مدت
- مجله
- حداکثر عرض
- ممکن است..
- اندازه گیری
- اندازه گیری
- روش
- ملایم
- اسیابان
- مدل
- ماه
- ماهیانه
- ماه
- بیش
- اکثر
- mr
- MRI
- باید
- ضروری
- علوم اعصاب
- اخبار
- نه
- یادداشت
- اکنون
- هدف
- گاه به گاه
- of
- on
- یک بار
- ONE
- آنلاین
- فقط
- باز کن
- باز
- افتتاح
- خوش بین
- or
- شرکت کنندگان
- بیمار
- pacientes
- نفوذ
- انجام
- حیوان خانگی
- فاز
- فیزیک
- دنیای فیزیک
- پیشگام
- پیشگام
- برنامه
- برنامه ریزی
- افلاطون
- هوش داده افلاطون
- PlatoData
- به علاوه
- محبوب
- قدرت
- قبلا
- روش
- پیشرفت
- اثبات كردن
- هدف
- نسبت
- رسیدن به
- زمان واقعی
- اخذ شده
- كاهش دادن
- کاهش
- کاهش
- کاهش
- مناطق
- برداشت
- مکرر
- گزارش
- گزارش ها
- تحقیق
- محققان
- به ترتیب
- منحصر
- s
- امن
- با خیال راحت
- ایمنی
- سعید
- مقیاس
- اسکن
- پراکنده
- علوم
- دوم
- خدمت کرده است
- نشان داد
- نمایش
- نشان داده شده
- طرف
- سیگنال
- قابل توجه
- شش
- شش ماه
- کند
- کند شدن
- کوچک
- روزی
- منابع
- استاندارد
- استاندارد
- راه افتادن
- هنوز
- تحریک
- مطالعات
- تعلیق
- هدف قرار
- اهداف
- تیم
- تلویزیون
- آزمایش
- نسبت به
- که
- La
- آینده
- غرب
- شان
- سپس
- درمانی
- درمان
- درمان
- آنجا.
- اینها
- آنها
- این
- سه
- کوچک
- به
- تورنتو
- درمان
- رفتار
- درمان
- محاکمه
- درست
- دو
- نوع
- سونوگرافی
- زیر
- تحت عمل قرار می گیرد
- دانشگاه
- غیر معمول
- جذب
- us
- غذای آمریکا
- استفاده کنید
- استفاده
- با استفاده از
- ارزش
- از طريق
- تماشا
- ویرجینیا
- قابل رویت
- جلد
- بود
- امواج
- هفته
- وزن
- بود
- غرب
- ویرجینیای غربی
- که
- در حین
- که
- زن
- اراده
- با
- در داخل
- بدون
- جهان
- سال
- سال
- زفیرنت