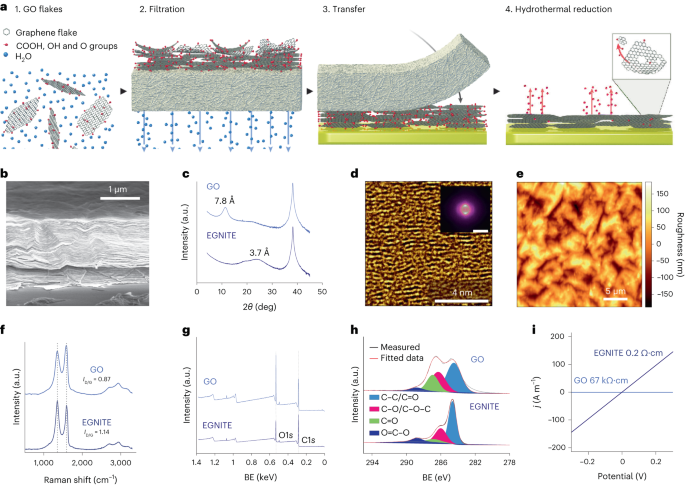
Materjali ettevalmistamine ja iseloomustus
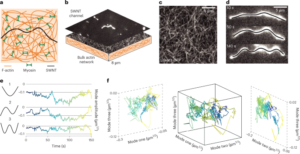
GO vesilahus lahjendati deioniseeritud vees, et saada 0.15 mg/ml-1 lahus ja vaakumfiltreeriti läbi nitrotselluloosmembraani, mille poorid on 0.025, 100 µm, moodustades õhukese GO kile. Seejärel kanti õhuke kile sihtsubstraadile, kasutades märgülekannet deioniseeritud vees ja täiendavat termilist lõõmutamist temperatuuril 2 ° C 134 minutit. GO kile-substraadi virna redutseeriti hüdrotermiliselt temperatuuril 3 C standardses autoklaavis 1 tundi, et moodustada EGNITE. Kõigi EGNITE'i iseloomustusuuringute alussubstraat oli ruut (1 × XNUMX cm2) Si/SiO2 (400 μm/1 μm).
XPS
XPS mõõtmised viidi läbi Phoibos 150 analüsaatoriga (SPECS) ülikõrge vaakumi tingimustes (baasrõhk, 5 × 10).-10 mbar) monokromaatilise Al Ka röntgenikiirguse allikaga (1,486.74 eV). Ülevaatespektrid saadi läbipääsuenergiaga 50 eV ja sammusuurusega 1 eV ning kõrge eraldusvõimega spektrid saadi läbipääsuenergiaga 20 eV ja sammusuurusega 0.05 eV. Üldine eraldusvõime nendes viimastes tingimustes on 0.58 eV, mis on määratud täislaiuse mõõtmisel Ag 3 maksimumi poolel.d5/2 piiki pritsitud hõbedat. XPS analüüs näitab tugevat langust pärast C-O piigi hüdrotermilist töötlemist (seotud epoksiidrühmadega), kuid väikest C-OH, C=O ja C(O)OH panust hüdroksüülide, karbonüülide ja karboksüülide tõttu. jäävad pärast vähendamist. O1 dekonvolutsioons tipp kinnitab sellist käitumist. Peamine panus C1-sses signaal pärast hüdrotermilist redutseerimist aga pärineb sp2 hübridiseeritud C-C orbitaalid34,57.
Röntgendifraktsioon
Röntgendifraktsiooni mõõtmised (θ-2θ skaneerimine) viidi läbi Materials Researchi difraktomeetriga (Malvern PANalytical). Sellel difraktomeetril on horisontaalne ω-2θ goniomeeter (raadiusega 320 mm) nelja ringi geomeetrias ja töötas keraamilise röntgentoruga Cu Ka anoodiga (λ = 1.540598 Å). Kasutatud detektor on Pixcel, mis on Medipix2 tehnoloogial põhinev kiire röntgendetektor.
Ramani spektroskoopia
Ramani spektroskoopia mõõtmised viidi läbi Witeci spektrograafiga, mis oli varustatud 488 nm laserergastusjoonega. Mõõtmiste jaoks saadi Ramani spektrid 50× objektiivi ja 600 soone nm võre abil; proovi kuumutamise vältimiseks hoiti laseri võimsust alla 1.5 mW.
TEM
EGNITE proovi ristlõike uurimiseks valmistati Helios NanoLab DualBeam (LMA-INA) abil fokuseeritud ioonkiire lamell. Struktuurianalüüsid viidi läbi TEM-i abil, kasutades Tecnai F20 mikroskoopi, mis töötas 200 kV juures, sealhulgas HRTEM-i ja suure nurgaga rõngakujulise tumeda välja STEM-tehnikaid. STEM-EELS katse viidi läbi Tecnai F20 mikroskoobis, mis töötas 200 KeV juures, 5 mm avaga, 30 mm kaamera pikkusega, lähenemisnurgaga 12.7 mrad ja kogumisnurgaga 87.6 mrad. Kuna kasutasime tuumakao hankimisel lähteenergiana 0.5 eV piksli kohta ja 250 eV, ei saavutanud me eeldatavat Si K-serva 1,839 eV juures, Pt M-serva 2,122 eV juures ja Au M-serva 2,206 eV. Suhteline C – O aatomi koostis on saadud, keskendudes meie tähelepanu vähendatud GO-kihile ja eeldades, et analüüsitud servad (meie puhul C ja O) on 100%. See eeldus kehtib meie puhul, nagu on tõendatud dokumendis Täiendav teave kaardid. Energiadiferentsiaalristlõige arvutati Hartree-Slateri mudeli abil ja taust madala võimsusega mudeli abil.
Elektrijuhtivus
Elektrijuhtivuse mõõtmised viidi läbi Keithley 2400 allikamõõturiga kahepunktilises konfiguratsioonis. Mõõdetud proovid koosnesid EGNITE kiledest suurusega 1 × 1 cm2 SiO peal2 substraat.
Andmete analüüs
Röntgendifraktsiooni, Ramani ja XPS andmeid analüüsiti Python 3.7 pakettide abil (Numpy, Pandas, Scipy, Xrdtools, Lmfit, Rampy, Peakutils, Matplotlib). Tasapindade vaheline kaugus arvutati röntgendifraktsiooni mõõtmiste põhjal vastavalt Snelli seadusele. Kui andmed viidi ruumilisse domeeni, sobitati maksimumid. Vastav kaugus andis tasanditevahelise kauguse keskmise väärtuse. Kõrvalekalded nendest keskmistest väärtustest arvutati ruumilise domeeni tippude Lorentzi liitmike täislaiuse poole maksimumi järgi. XPS- ja Ramani spektroskoopia mõõtmisi analüüsiti, sobitades vastavate tunnuste eeldatavatele asukohtadele piikide konvolutsiooni. GO ja EGNITE juhtivuse väärtused saadi sobitades I-V elektrijuhtivuse mõõtmisel mõõdetud kõverad Ohmi seaduse järgi. Andmed on n = 1 iga mõõtmise kohta.
Paindlik massiivi valmistamine
Seadmete valmistamine on näidatud täiendaval joonisel fig. 4. Seadmed valmistati 4-tollise Si / SiO-ga2 (400 μm/1 μm) vahvlid. Esiteks kaeti vahvlile 10 µm paksune PI (PI-2611, HD MicroSystems) kiht ja küpsetati lämmastikurikkas atmosfääris temperatuuril 350 °C 30 minutit. Metalljäljed kujundati kujutise ümberpööramise fotoresisti (AZ5214, Microchemicals) optilise litograafia abil. 20 nm titaani ja 200 nm kulla sadestamiseks kasutati elektronkiire aurustamist ning teostati äratõstmine. Elektrokeemilise jõudluse ja massiivi paindlikkuse vahelise kompromissina kasutasime umbes 1 μm paksust EGNITE-kilet. Pärast GO-kile ülekandmist aurustati alumiinium e-kiirega ja tulevaste mikroelektroodide peal olevad alad määrati negatiivse fotoresisti (nLOF 2070, Microchemicals) abil ja tõsteti ära. Järgmisena söövitati GO-kile kõikjal peale tulevaste mikroelektroodide, kasutades hapnikureaktiivset ioonisöövitust (RIE) 5 min 500 W juures ja kaitsvad alumiiniumkolonnid söövitati lahjendatud fosfor- ja lämmastikhappe lahusega. Seejärel kanti vahvlile 3 µm paksune PI-2611 kiht ja küpsetati, nagu eelnevalt kirjeldatud. Seejärel määrati mikroelektroodil olevad PI-2611 avad, kasutades positiivset paksu fotoresisti (AZ9260, Microchemicals), mis toimis maskina järgneva hapniku RIE jaoks. Hiljem kujundati seadmed PI-kihile, kasutades taas fotoresisti AZ9260 ja RIE-d. Seejärel eemaldati fotoresisti kiht atsetoonis ja vahvel puhastati isopropüülalkoholis ja kuivatati. Lõpuks kooriti seadmed vahvli küljest lahti ja olid valmis steriliseerimiskottidesse asetamiseks, et neid hüdrotermiliselt töödelda 134 °C juures standardses autoklaavis 3 tundi.
Mikroelektroodi elektrokeemiline iseloomustus
Mikroelektroodide elektrokeemiline iseloomustamine viidi läbi Metrohm Autolab PGSTAT128N potentsiostaadiga 1 × PBS-s (Sigma-Aldrich, P4417), mis sisaldas 10 mM fosfaatpuhvrit, 137 mM NaCl-i ja 2.7 mM a7.4-45093.cXNUMXCl konfiguratsiooni. Võrdlusena kasutati Ag/AgCl elektroodi (FlexRef, WPI) ja vastuelektroodina plaatinatraati (Alfa Aesar, XNUMX).
Enne jõudluse hindamist impulsseeriti elektroodid 10,000 1 laenguga tasakaalustatud impulsiga (15 ms, 100 µA). Elektroodide eksponeerimine pideva impulssprotokolliga toimus 0.9 tsüklilise voltammeetria tsükliga (-0.8 kuni +50 V) XNUMX mV s juures-1, 20 5,000 impulsi (1 ms) kordust ja avatud ahela potentsiaali uuesti määramine.
Andmete analüüs
Elektrokeemiliste iseloomustusandmete analüüsimiseks kasutati Python 3.7 pakette (Numpy, Pandas, Scipy, Pyeis, Lmfit, Matplotlib). Impedantsi spektroskoopia andmed paigaldati samaväärsele elektrimudelile, mis koosnes takistusest (R) järjestikku konstantse faasielemendiga (CPE). Sealt lähendati CPE väärtus mahtuvusele ja jagati mikroelektroodi geomeetrilise pindalaga, et saada EGNITE'i liidese mahtuvuse ekvivalentväärtus. Mikroelektroodi laengu salvestusmahtuvus (CSC) arvutati tsükliliste voltamperomeetriliste mõõtmiste põhjal, integreerides mõõdetud voolu katood- ja anoodrežiimid ning normaliseerides skaneerimiskiirusega. Katood- ja anoodlaengu salvestusmahtuvus (cCSC ja aCSC) EGNITE'i 100 mV skaneerimiskiirusel on 45.9 ± 2.4 ja 34.6 ± 2.8mC cm-2, vastavalt (n = 3). Nagu muude materjalide puhul teatatud58, sõltuvad saadud CSC-d skaneerimiskiirusest (täiendav joonis 1). 5). Hapniku redutseerimisreaktsioonide esinemise hindamiseks mõõtsime CV lainekuju lämmastikuga puhastatud elektrolüüdis59 ja ei täheldanud olulisi erinevusi lainekujus (täiendav joonis 1). 6). Kuid meie tulemused ei käsitle täielikult hapniku redutseerimise reaktsioonide mõju EGNITE'i laengu sissepritsevõimele ja selle nõuetekohaseks uurimiseks tuleb teha täiendavat tööd. Mikroelektroodi laengu injektsioonivõime (CIC) määrati vooluimpulsi amplituudi määramisega, mis kutsus esile pinge erinevuse (pärast oomilise languse eemaldamist), mis vastas elektroodi elektrokeemilise vee aknale (-0.9 V katood- ja +0.8 V anoodil versus Ag/AgCl). ) (täiendav joonis fig. 17)60.
Statistiline analüüs
Andmed on keskmised ± s.d., n = 18 EIS-i ja n = 3 kronopotentsiomeetriate jaoks. Katoodi mahtuvusliku pinge kõrvalekalde kaardi andmed on katoodse mahtuvusliku pinge muutuste keskmised ühe sündmuse kohta iga impulsi kuju kohta. n = 3 elektroodi.
Mehaanilise stabiilsuse hindamine
Ultraheli ultrahelitöötlus
EGNITE elektroodimassiivid asetati ultraheliveevannis (Elmasonic P 180H) veega täidetud keeduklaasi. Ultrahelitöötlust rakendati sagedusel 37 kHz 15 minutit 200 W juures ja sellele järgnes täiendav 15 minutit ultrahelitöötlust sagedusel 37 kHz võimsusega 300 W. Elektroodide pildid saadi enne ja pärast ultrahelitöötlusetappe.
Painutuskatse
Painutusseade (joon. 2k) koosnes kolmest silindrilisest vardast; keskmine (läbimõõt, 700 µm) langetati alla, tekitades 131° paindenurgad. Paindekatses kasutati kolme painduvat mikroelektroodi massiivi. Iga massiiv sisaldas 18 mikroelektroodi läbimõõduga 50 µm. Kahte massiivi mõõdeti pärast 10 ja 20 tsüklit, samas kui ühte seadet mõõdeti ainult 10 tsüklit, kuna see sai pärast mõõtmist käitlemisel kahjustatud. Painutuskatse tsükkel koosnes 10-sekundilisest koormuse rakendamisest pluss 10-s ilma koormuseta. Seadmeid iseloomustati elektrokeemiliselt (EIS ja CV) enne ja pärast 10 ja 20 painutustsüklit.
Epikortiline närvisalvestus
Epikortiline implantatsioon
Kõik katseprotseduurid viidi läbi vastavalt Euroopa Ühenduse Nõukogu soovitustele ja Prantsusmaa õigusaktidele laboriloomade hooldamise ja kasutamise kohta. Protokollid kiitis heaks Grenoble'i eetikakomitee (ComEth) ja volitas Prantsusmaa ministeerium (number 04815.02). Sprague-Dawley rotid (isased, 4 kuud vanad, kaaluvad ∼600 g) anesteseeriti intramuskulaarselt ketamiiniga (50 mg/kg (kehakaal)) ja ksülasiiniga (10 mg/kg (kehakaal)) ning kinnitati seejärel stereotaksilise hoidiku külge. Temporaalse kolju eemaldamine paljastas kuulmiskoore. Kortikaalse koe kahjustamise vältimiseks säilitati Dura mater. Võrdluselektroodi sisestamiseks puuriti tippu auk ja maanduselektroodi sisestamiseks puuriti teine auk, esimesest 7 mm ettepoole. Elektroodid olid 0.5 mm paksused tihvtid, mida kasutati integraallülituse pistikupesade jaoks. Need asetati kõvakestaga elektrilise kontakti saamiseks ja kinnitati hambatsemendiga kolju külge. Seejärel paigaldasime pinna mikroelektroodi lindi kuulmiskoorele, nagu on näidatud joonisel fig. 3b. Veenide mustrid tuvastavad kuulmiskoore Kriegi roti ajukaardi piirkonnas 41. Kortikaalseid signaale võimendati samaaegselt võimendusega 1,000 ja digiteeriti diskreetimissagedusega 33 kHz. Kõlar, mis asus 20 cm kõrgusel roti kõrva ees, avatud ajukoorega kontralateraalselt, edastas akustilisi stiimuleid. Edastatud stiimuleid jälgiti 0.25, 4939-tollise mikrofoniga (Brüel & Kjaer, 20), mis asetati kõrva lähedale ja esitati helirõhu tasemel (dB SPL re 80 μPa). Uurime tipu-positiivseid (negatiivseid-üles-) keskmise latentsusaja reaktsioone, mis on esile kutsutud vahelduvatest klõpsudest 70 dB SPL juures ja toonpurske stiimuleid 5 dB SPL juures sagedustega 40 kuni 5 kHz, tõusu ja languse aeg 200 ms ja kestus XNUMX ms.
Andmete analüüs
Elektrofüsioloogiliste andmete analüüsimiseks kasutati Python 3.7 pakette (Numpy, Pandas, Scipy, Neo, Elephant, Sklearn Matplotlib) ja kohandatud raamatukogu PhyREC (https://github.com/aguimera/PhyREC). R.m.s. väärtused arvutati libiseva aknaga 20 ms sagedustel üle 200 Hz. Spektrogrammid arvutati vahemiku 70 Hz kuni 1.1 kHz jaoks. PSD arvutati 60 s pidevate salvestuste kohta. Antud elektroodi massiivi jaoks arvutati kaks PSD-d: in vivo (IV) ja post mortem (PM). SNR-i väljendatakse dB-des (20 × ln(r.m.s.(IV)/r.m.s.(PM))) ja interpoleeritakse 20 punkti jaoks, mis on logaritmiliselt paigutatud vahemikku 10 Hz kuni 1 kHz.
Statistiline analüüs
Epikortilised närviandmed on esitatud joonisel fig. 3 on võetud ühe looma individuaalsetest mõõtmistest. Joonisel fig. 3c, on esitatud 64 elektroodi andmed. Joonisel fig. 3d, esitatakse kahe valitud elektroodi andmed. Joonisel fig. 3f, PSD ja SNR arvutatakse 64 EGNITE elektroodi põhjal ja on näidatud keskmisena ± s.d. Täiendaval joonisel fig. 12c, d mediaanandmed on esitatud 192 EGNITE elektroodi kohta alates n = 3 katset ja 60 plaatinaelektroodi n = 1 katse.
Intrakortikaalne neuraalne salvestus
Intrakortikaalne implantatsioon
Loomad anesteseeriti ketamiini/ksülasiini seguga (75:1, 0.35 ml/28 g i.p.) ja seda seisundit säilitati inhalatsioonimaskiga, mis sisaldas 1.5% isofluraani. Implantaadi stabiliseerimiseks asetati koljusse mitu mikrokruvi ja väikeaju peal olevat kruvi kasutati üldise maapinnana. Sond implanteeriti prefrontaalsesse ajukooresse (koordinaadid: AP, 1.5 mm; ML, ±0.5 mm; DV, -1.7 mm bregmast). Implanteerimine viidi läbi sondi katmisega maltoosiga (vt protokolli allpool), et tagada sondi ajutine jäikus ja hõlbustada sondi sisestamist. Sond suleti hambatsemendiga. Sondi ühendamiseks elektrofüsioloogilise süsteemiga kasutati miniatuurse kaabli kaudu TDT-ZifClip pistikuid. Pärast operatsiooni läbis hiir 1-nädalase taastumisperioodi, saades analgeesiat (buprenorfiin) ja põletikuvastast (meloksikaami) ravi. Neuraalne aktiivsus registreeriti mitmekanalilise Open Ephys süsteemiga diskreetimissagedusega 30 kHz Intan RHD2132 võimendiga. Auditoorsed ülesande katsed viidi läbi helikindlas kastis, mille sees oli kaks kõlarit, kasutades eelnevalt kirjeldatud töödel põhinevaid protokolle61. Heli stiimul koosnes 15 ms pikkusest valge müra klõpsust, mida korrati 100 korda (tsüklid), millest igaüks oli eraldatud 5 sekundiga (stiimulitevaheline intervall). Ülesande ajal sai loom vabalt liikuda.
Maltoosi jäigastamise protokoll
Maltoosi vesilahust kuumutatakse klaasistumispunktini (Tg), vahemikus 130–160 °C, kasutades kuumutusplaati või mikrolaineahju. Kui maltoos on viskoosne, puutub sondi tagakülg kokku ainult maltoosiga. Kui maltoos jahtub, siis see jäigastab ja jäigastab sondi.
Andmete analüüs
Iga elektroodi närvisignaalid filtreeriti võrguühenduseta, et eraldada SUA ja LFP. SUA hinnati, filtreerides signaali vahemikus 450 kuni 6,000 Hz ja üksikute neuronite naelu sorteeriti, kasutades põhikomponentide analüüsi rakendusega Offline Sorter v.4 (Plexon). LFP-de saamiseks vähendati signaalid sagedusele 1 kHz, eemaldati trendid ja filtriti sälk, et eemaldada Pythonis kohandatud skriptidega mürajoone artefaktid (50 Hz ja selle harmoonilised). AEP SNR arvutati piigi N1 amplituudi ja s.d. 20 ms perioodi jooksul enne stiimulit.
Statistiline analüüs
Joonisel fig. 3h, i on keskmised ± s.d., n = 30 kui keskmiste katsete arv. Samalt elektroodilt salvestatud andmed on näidatud päevadel 30, 60 ja 90. Esitatakse andmed ühe looma kohta.
Krooniline epikortikaalne biosobivus
Seadmete kirurgiline implanteerimine
Selles uuringus kasutati kokku 27 täiskasvanud isast Sprague-Dawley rotti (Charles River). Loomi hoiti ümbritseva õhu temperatuuril 21 ± 2 ° C ja niiskuse juures 40–50%, 12-tunnise valguse / 12-tunnise pimeduse tsüklis. Rotte majutati rühmadesse ja neile anti kogu katseperioodi vältel vaba juurdepääs dieedile ja veele. Katseprotseduurid viidi läbi kooskõlas loomade heaolu seadusega (1998) Ühendkuningriigi siseministeeriumi ja kohaliku loomade heaolu eetikakontrolli asutuse (AWERB) heakskiidul. Loomad anesteseeriti operatsiooni ajaks isofluraaniga (2–3%) ja anesteesia sügavust jälgiti varba pigistusrefleksi testiga. Loomad paigutati kehatemperatuuri säilitamiseks stereotaksilisse raami (Kopf, 900LS), mis asus termoteki kohal. Kraniotoomia auk (∼5 mm ×4 mm) tehti keskjoonest 1 mm kaugusel, kasutades 0.9 mm puuriga hambapuurit, kõvakesta eemaldati ja epikortikaalne seade asetati ajukoore pinnale. Kraniotoomia auk suleti Kwik-siliga, millele järgnes kinnitamiseks hambatsement ja nahk õmmeldi kinni. Kaotatud vedeliku asendamiseks ja operatsioonijärgse valu vähendamiseks tehti subkutaansed soolalahuse (1 ml kg (kehakaalu) kohta) ja buprenorfiini (0.03mg/kg (kehakaalu) kohta) süstid ning anesteesia tühistati.
Kudede kogumine ja töötlemine
Loomad lõpetati 2, 6 või 12 nädalat pärast implantatsiooni, kasutades läbiviidavale analüüsitüübile sobivat meetodit.
Histoloogia ja immunohistokeemia
2, 6 või 12 nädalat pärast implantatsiooni lõpetati rotid südame perfusiooniga hepariniseeritud (10 U ml) abil.-1, Sigma-Aldrich) PBS, millele järgnes 4% paraformaldehüüd (PFA, Sigma-Aldrich) PBS-s. Ajusid fikseeriti 4 tundi 24% PFA-s, seejärel viidi need 30% sahharoosi lahusesse PBS-is vähemalt 48 tundi enne isopentaanis külmutamist. Seejärel hoiti ajusid temperatuuril –80 °C kuni krüosektsioonini 25 µm juures. Seejärel värviti kude ioniseeritud kaltsiumi siduva adaptermolekuli 1 (Iba-1) jaoks, et määrata mikrogliia aktivatsiooni tase. Lühidalt, koelõigud blokeeriti 5% kitse seerumiga PBS-is koos 0.1% Triton-X-ga 1 tunni jooksul enne üleöö inkubeerimist 4 °C juures primaarse anti-Iba-1 antikehaga (1:1,000, 019-19741; Wako). Seejärel värviti sektsioone sekundaarse antikehaga, küülikuvastase Alexa Fluor 594-ga (1:400, A-11012; Thermo Fisher) 1 tund toatemperatuuril. Slaidid paigaldati katteklaasidega, kasutades Prolong Gold pleekimisvastast kinnituskandjat koos 4,6-diamidino-2-fenüülindooliga (Thermo Fisher). Sond kattis 3 × 3.7 mm suuruse ala2 ajukoore pinnal; Värvimiseks valitud koelõigud katsid selle piirkonna pikkusega 3.2 mm. Slaidid pildistati 3DHistech Pannoramic-250 mikroskoobi slaidi skanneriga 20× ja pilte analüüsiti CaseViewer v.2.4 (3DHistech) abil. Mikrogliia aktiveerimise hindamiseks kaeti 3.2, 100 mm ala ja iga 8.5 µm järel analüüsiti ühte pilti. Pildid tehti 3, XNUMX-kordse suurendusega, mis kirjeldasid epikortikaalse sondi koha lõiku, mis asub aju keskjoonest XNUMX mm kaugusel, hõlmates vahetult sondi koha all olevat ala.
Pildi töötlemine
Mikroskoopia andmeid töödeldi kujutisega, kasutades mikrogliia fenotüübi iseloomustamise algoritmi (täiendav joonis 1). 13). Mikrogliia aktiveerimist analüüsiti kohandatud CellProfileri* abil (Broad Institute, v.3.1.9 alates https://cellprofiler.org/) torujuhe. Esiteks kasutati moodulit EnhanceOrSuppressFeatures, et täiustada niitseid struktuure, näiteks neuriite, rakendades torususe suurendamise meetodit. Täiustatud piltidest segmenteeriti rakud mooduli IdentifyPrimaryObjects abil. Lahtrite esialgsed mõõtmised näitasid, et sobiva objekti läbimõõdu vahemik oli 3–40 pikslit. Sellest läbimõõduvahemikust väljaspool olevad või pildi serva puudutavad objektid visati kõrvale. Rakud segmenteeriti, kasutades kaheklassilist Otsu adaptiivset lävistrateegiat, mille adaptiivse akna suurus oli 50 pikslit. Mooduli IdentifyPrimaryObjects tuvastatud objektid sisestati moodulisse MeasureObjectSizeShape, et arvutada lahtrite klassifitseerimiseks vajalikud omadused. Moodulis ClassifyObjects määrati kategooriaks, millele klassifikatsioonid tugineda, AreaShape ja vastavaks mõõtmiseks valiti Extent. Rakud klassifitseeriti järgmiselt "aktiveeritud või aktiveerimata, lähtudes nende atribuudist Ulatus, mis on lahtri ja selle piirdekasti poolt hõivatud ala suhe. Seda klassifitseerimismeetodit ratsionaliseeris tõsiasi, et aktiveeritud mikrogliadel on suured rakukehad ja puuduvad protsessid ning seega hõivavad nad palju suurema osa nende piirdekastidest kui nende aktiveerimata kolleegid. Lõpuks kasutati soovitud statistika arvutamiseks ja väljastamiseks mooduleid CalculateMath ja ExportToSpreadsheet.
Statistiline analüüs
Andmekogumid on n = 3 iga seadmetüübi puhul (ainult PI-implantaat (PI); PI katmata mikrotöödeldud kullaga (kuld); ja PI mikrotöödeldud kullaga ja EGNITE-iga (EGNITE) kõigil ajahetkedel), välja arvatud 6-nädalase kullaga, mis on n = 2 ELISA andmete jaoks. Kontralateraalsed poolkerad ühendati igal ajahetkel, et anda n = 9 2 ja 12 nädalat pärast implantatsiooni ja n = 8 6 nädalat pärast implantatsiooni. Andmete analüüs tehti GraphPad Prism v.8 tarkvara abil. Statistiline analüüs viidi lõpule, kasutades kahepoolset dispersioonanalüüsi (ANOVA) ja vajaduse korral Tukey mitme võrdluse testi; P < 0.05 peeti oluliseks.
ELISA
Pärast implantatsiooniperioodi lõpetati loomad emakakaela dislokatsiooniga. Ajukude ekstraheeriti nii aju paremast kui ka vasakust poolkerast, külmutati vedelas lämmastikus ja säilitati kuni edasise kasutamiseni temperatuuril –80 °C. Kudede lüüsimiseks kasutati NP-40 lüüsipuhvrit (150 mM NaCl, 50 mM Tris-Cl, 1% Nonidet P40 asendaja, Fluka, pH reguleeriti väärtusele 7.4), mis sisaldas proteaasi ja fosfataasi inhibiitorit (Halt Protease Inhibitioner, Fishermockataaser, Phosrmockitasa). järgnes koe mehaaniline katkestamine (TissueLyser LT, Qiagen). Seejärel tsentrifuugiti proove 10 minutit kiirusel 5,000 pööret minutis ja supernatanti hoiti kuni edasise kasutamiseni temperatuuril 4 °C. Järgmiste tsütokiinide kvantifitseerimiseks kasutati LEGENDplex Rat Inflammation Panel (katalooginumber 740401, BioLegend), helmestepõhist multipleksset ELISA komplekti; IL-1α, IL-1β, IL-6, IL-10, IL-12p70, IL-17A, IL-18, IL-33, CXCL1 (KC), CCL2 (MCP-1), granulotsüütide-makrofaagide kolooniaid stimuleeriv faktor, interferoon-y ja tuumori nekroosifaktor. Komplekt viidi läbi vastavalt tootja juhistele, valguga laaditi fikseeritud mahus 15 µl. Pärast supernatandiga inkubeerimist töödeldi helmeid BD FACSVerse voolutsütomeetriga ja andmeid analüüsiti LEGENDplexi andmeanalüüsi tarkvara abil.
Neuraalne stimulatsioon
Intrafastsikulaarne implantatsioon
Kõik loomkatsed kiitis heaks Universitat Autònoma de Barcelona eetikakomitee vastavalt Euroopa Ühenduste Nõukogu direktiivile 2010/63/EL. Loomi hoiti temperatuuril 22 ± 2 ° C 12 h valguse / 12 pimeduse tsükli all ning toit ja vesi olid vabalt kättesaadavad. Anesteseeritud emaste Sprague-Dawley rottide istmikunärv (250–300 g, ∼18 nädalat vana) eksponeeriti kirurgiliselt ja TIME-elektroodid implanteeriti põiki üle istmikunärvi sirge nõela abil, mis oli kinnitatud 10-0 silmusniidi külge.46. Protsessi jälgiti dissektsioonimikroskoobi all, et tagada aktiivsete kohtade õige asend närvi sidemete sees (joonis 1). 4b). Katsete ajal hoiti looma kehatemperatuuri soojenduspadjaga.
Närvistimulatsioon viidi läbi kahefaasiliste vooluimpulsside jadade rakendamisel fikseeritud kestusega 100 µs faasi kohta ja amplituudi suurendamisega 0-lt 150 µA-le 1 või 3 µA sammuga sagedusel 3 Hz 33 sekundi jooksul (Stimulaator N kuni DigiEGtimer 4, erinev DigiEGtimer 13 mikroelektroodid. Samal ajal registreeriti CMAP-id GM-, TA- ja PL-lihastest, kasutades igasse lihasesse asetatud väikeseid nõelelektroode (0.4 mm pikad, 03 mm läbimõõduga roostevabast terasest nõelelektroodid A-14-XNUMXBEP, Bionic).62. Aktiivne elektrood asetati lihaskõhule ja võrdluspunkt kõõluse tasemele. Elektromüograafia salvestusi võimendati (×100 GM ja TA jaoks, × 1,000 PL; P511AC võimendid, Grass), ribapääsfiltreeriti (3 Hz kuni 3 kHz) ja digiteeriti PowerLabi salvestussüsteemiga (PowerLab16SP, ADInstruments).
Andmete analüüs
Iga CMAP amplituudi mõõdeti algtasemest maksimaalse negatiivse piigini. Pinge tipu mõõtmised normaliseeriti katses iga lihase jaoks saadud maksimaalse CMAP amplituudiga. Iga aktiivse saidi jaoks arvutati selektiivsuse indeks (SI) kui suhe normaliseeritud CMAP amplituudi vahel ühe lihase, CMAP.ija normaliseeritud CMAP amplituudide summa kolmes lihases, järgides valemit SIi = nCMAPi/∑nCMAPj, minimaalsel stimulatsioonivoolu amplituudil, mis kutsus esile minimaalse funktsionaalselt olulise lihasreaktsiooni (määratletud kui vähemalt 5% CMAP amplituudiga ühe lihase puhul selle lihase maksimaalse CMAP amplituudiga, mis oli eelnevalt määratud). Seejärel valiti antud katses iga lihase SI-deks kõigi kolme lihase suurima SI-ga aktiivsed saidid.
Krooniline intraneuraalne biosobivus
Pärast eelnevalt teatatud protseduuri50,63, tuimastatud Sprague-Dawley emaste rottide istmikunärv (250-300 g, ∼18 nädalat vana) eksponeeriti ja seadmed in vivo biosobivuse tagamiseks EGNITE'iga ja ilma selleta implanteeriti pikisuunas istmikunärvi sääreluu harusse (n = 6–8 rühma kohta). Lühidalt, närv läbistatakse trifurkatsioonist sirge nõelaga, mis on kinnitatud 10-0 silmuskeerme külge (STC-6, Ethicon); niit tõmbab painutatud elektroodiriba noolekujulist otsa. Ots on lõigatud niidi eemaldamiseks ja kummagi käe otsad on seadme väljatõmbamise vältimiseks veidi painutatud. Pikisuunaline implantaat valiti, kuna see võimaldab paremini uurida närvisisese võõrkeha reaktsiooni50.
Närvide ja loomade funktsionaalne hindamine
Loomi hinnati implantatsioonijärgse järelkontrolli käigus närvijuhtivuse, algesimeetria ja kõnniraja liikumistestide abil62. Juhtivustestide jaoks stimuleeriti implanteeritud ja kontralateraalsete käppade istmikunärvi istmikunärvi nõelelektroodidega ja PL-lihase CMAP registreeriti ülaltoodud viisil. Mõõdeti CMAP latentsust ja amplituudi. Algesimeetria testi jaoks asetati rotid traatvõrguplatvormile ja rakendati mehaanilist mittetoksilist stiimulit metallist otsaga, mis oli ühendatud elektroonilise Von Frey algesimeetriga (Bioseb). Mõõdeti implanteeritud ja kontralateraalsete käppade notsitseptiivne lävi (jõud grammides, mille juures loomad käpa välja tõmbasid). Kõndimisraja testi jaoks värviti tagakäppade tallapind musta tindiga ja iga rott jäeti mööda koridori kõndima. Jäljed koguti ja istmikunärvi funktsionaalne indeks arvutati62.
Histoloogia
2 või 8 nädala pärast perfuseeriti loomi PFA-ga (4%) ja istmikunärvid koguti, fikseeriti, külmsäilitati ja töödeldi histoloogiliseks analüüsiks. FBR hindamiseks lõigati istmikunärvid krüostaadiga (Leica CM15) 190 μm paksusteks põiklõikudeks. Proovid värviti müeliniseerunud aksonite (anti-RT97 märgistamiseks Neurofilament 200K, 1:200; Developmental Studies Hybridoma Bank) ja makrofaagidega (anti-Iba-1, 1:500; Wako). Seejärel inkubeeriti sektsioone 1 h toatemperatuuril sekundaarsete antikehadega eesli hiirevastaste Alexa Fluor 488 ja eesli küülikuvastaste Alexa Fluor 555 (1:200, Invitrogen). Valiti esinduslikud lõigud sääreluu närvi implantaadi keskosast, tehti pildid epifluorestsentsmikroskoobiga (Eclipse Ni, Nikon), mis oli ühendatud digikaameraga (DS-Ri2, Nikon) ja pildianalüüs viidi läbi ImageJ tarkvaraga (National Institutes). tervisest). Iba-1-positiivsete rakkude hulk kogu sääreluu närvi piirkonnas kvantifitseeriti ja koekapsli paksus mõõdeti implantaadi mõlema külje keskmise kaugusena lähimate aksoniteni.
Statistiline analüüs
Andmete statistilise analüüsi jaoks kasutasime ühe- või kahesuunalist ANOVA-d, millele järgnes Bonferroni post hoc testi rühmade või aegade erinevuste tuvastamiseks. Graafiliseks esituseks ja analüüsiks kasutati GraphPad Prism tarkvara. Statistilist olulisust peeti siis, kui P <0.05.
Aruande kokkuvõte
Lisateave uurimistöö kavandamise kohta on kättesaadav Loodusportfelli aruandluse kokkuvõte lingitud selle artikliga.
- SEO-põhise sisu ja PR-levi. Võimenduge juba täna.
- PlatoData.Network Vertikaalne generatiivne Ai. Jõustage ennast. Juurdepääs siia.
- PlatoAiStream. Web3 luure. Täiustatud teadmised. Juurdepääs siia.
- PlatoESG. Süsinik, CleanTech, Energia, Keskkond päikeseenergia, Jäätmekäitluse. Juurdepääs siia.
- PlatoTervis. Biotehnoloogia ja kliiniliste uuringute luureandmed. Juurdepääs siia.
- Allikas: https://www.nature.com/articles/s41565-023-01570-5
- :on
- :on
- :mitte
- : kus
- ][lk
- $ UP
- 000
- 1
- 10
- 100
- 12
- 13
- 130
- 15%
- 150
- 160
- 19
- 1998
- 20
- 200
- 2010
- 2011
- 2014
- 2016
- 2018
- 2020
- 2022
- 22
- 24
- 25
- 250
- 26
- 27
- 28
- 30
- 300
- 320
- 33
- 35%
- 350
- 40
- 400
- 41
- 43
- 46
- 50
- 500
- 54
- 58
- 60
- 600
- 7
- 70
- 700
- 75
- 8
- 80
- 87
- 9
- 90
- a
- Võimalik
- üle
- juurdepääs
- vastavust
- Vastavalt
- akustiline
- omandama
- omandatud
- omandamine
- üle
- tegu
- aktiveeritud
- Aktiveerimine
- aktiivne
- tegevus
- adaptiivne
- Täiendavad lisad
- aadress
- Kohandatud
- Täiskasvanud
- pärast
- AG
- jälle
- AL
- Alkohol
- Alexa
- algoritm
- Materjal: BPA ja flataatide vaba plastik
- võimaldab
- mööda
- am
- Ümbritsev
- summa
- Võimendab
- an
- analüüsid
- analüüs
- Ankur
- ja
- loom
- loomad
- Antikehad
- antikeha
- lahus
- taotlus
- rakendatud
- Rakendades
- lähenemine
- asjakohane
- heakskiit
- heaks
- OLEME
- PIIRKOND
- valdkondades
- ARM
- ümber
- Array
- artikkel
- AS
- hinnata
- hindamine
- seotud
- eeldus
- At
- Atmosfäär
- aatomi-
- tähelepanu
- volitatud
- saadaval
- vältima
- ära
- tagapõhi
- Pank
- Barcelona
- baas
- põhineb
- Baseline
- BD
- BE
- Laius
- sest
- olnud
- enne
- käitumine
- alla
- Parem
- vahel
- siduv
- biomeditsiiniline
- Natuke
- Must
- blokeeritud
- asutused
- keha
- mõlemad
- Kast
- karbid
- Aju
- aju
- Filiaal
- lühidalt
- lai
- tõi kaasa
- puhver
- kuid
- by
- kaabel
- arvutama
- arvutatud
- kaamera
- mahtuvuslik
- Võimsus
- mis
- kaasas
- juhul
- Kategooria
- ccl2
- rakk
- Rakke
- tsement
- kesk-
- väljakutseid
- iseloomustatud
- tasu
- Charles
- keemiline
- valitud
- klassifikatsioon
- salastatud
- klõps
- suletud
- kokteil
- kogumine
- Veerud
- kombineeritud
- tuleb
- komitee
- Ühenduste
- kogukond
- Lõpetatud
- koostis
- Tingimused
- läbi
- juhtivus
- konfiguratsioon
- Võta meiega ühendust
- seotud
- kaaluda
- Koosneb
- pidev
- kontakt
- sisaldub
- pidev
- panus
- Lähenemine
- parandada
- Vastav
- koridor
- cortex
- nõukogu
- kolleegidega
- kursus
- kaetud
- kriitiline
- Rist
- külmsäilitatud
- Praegune
- tava
- lõigatud
- tsükkel
- tsüklit
- tsütokiinid
- kahjustamine
- tume
- andmed
- andmete analüüs
- Päeva
- de
- vähenema
- loetakse
- määratletud
- kohta
- esitatud
- sõltuvad
- hoius
- hoiule
- sügavus
- kirjeldatud
- Disain
- soovitud
- üksikasjalik
- Määrama
- kindlaksmääratud
- määrates kindlaks
- arenguhäire
- seade
- seadmed
- DID
- Dieet
- erinevus
- erinevused
- erinev
- digitaalne
- digiteeritud
- lahjendatud
- otsene
- otse
- nihestus
- Katkestus
- kaugus
- jagatud
- do
- domeen
- tehtud
- alla
- Drop
- kaks
- kestus
- ajal
- E&T
- iga
- serv
- Starter
- Elektrooniline
- element
- elevant
- kõrgendatud
- haarav
- energia
- suurendama
- tõhustatud
- Lisaseade
- tagama
- varustatud
- Samaväärne
- asutatud
- Hinnanguliselt
- Eeter (ETH)
- eetiline
- EUR
- Euroopa
- EV
- hinnatud
- hindamine
- sündmus
- Iga
- kõikjal
- tõendatud
- uurima
- erand
- oodatav
- eksperiment
- eksperimentaalne
- katseid
- avatud
- Säritus
- väljendatud
- ulatus
- väljavõte
- hõlbustada
- asjaolu
- faktor
- Langema
- kaugele
- KIIRE
- FUNKTSIOONID
- naine
- Viigipuu
- Joonis
- täidetud
- Film
- filmid
- filtreerimine
- Lõpuks
- esimene
- paigaldamine
- fikseeritud
- Paindlikkus
- paindlik
- voog
- keskendunud
- keskendumine
- Järgneb
- Järel
- toit
- eest
- Sundida
- välis-
- vorm
- valem
- FRAME
- tasuta
- vabalt
- külmutamine
- prantsuse
- Alates
- esi-
- külmutatud
- täis
- täielikult
- funktsionaalne
- funktsionaalselt
- edasi
- tulevik
- kasu
- andis
- Üldine
- geomeetria
- Andma
- antud
- klaas
- GM
- Go
- Kuldne
- Grafeen
- rohi
- Maa
- Grupp
- Grupi omad
- suunised
- olnud
- Pool
- Käsitsemine
- Olema
- Tervis
- aitama
- poolkerad
- kõrgresolutsiooniga
- kõrgeim
- omanik
- Auk
- Avaleht
- Home Office
- Horisontaalne
- KUUM
- aga
- HTTPS
- huang
- i
- tuvastatud
- identifitseerima
- IEEE
- pilt
- pildianalüüs
- pildid
- mõju
- in
- Kaasa arvatud
- kasvav
- inkubeeritud
- INKUBATSIOONI
- indeks
- eraldi
- põletik
- info
- sisend
- sees
- Instituut
- juhised
- integreeritud
- Integreerimine
- ette nähtud
- Interface
- liidesed
- sisse
- uurima
- IT
- ITS
- hoitakse
- komplekt
- Koch
- silt
- labor
- suur
- suurem
- laser
- viimane
- Hilinemine
- pärast
- Seadus
- kiht
- kõige vähem
- lahkus
- Seadusandlus
- Pikkus
- Tase
- Raamatukogu
- nagu
- piirangud
- joon
- LINK
- seotud
- Vedelik
- koormus
- kohalik
- asub
- kohad
- Pikk
- pikaajaline
- kadunud
- Soodsam
- makrofaagid
- tehtud
- põhiline
- säilitada
- tegema
- kaart
- kaardid
- mask
- sobitatud
- materjal
- materjalid
- matplotlib
- maksimaalne
- mc
- keskmine
- vahendid
- mõõdetud
- mõõtmine
- mõõdud
- mõõtmine
- mehaaniline
- Meedia
- metall
- meetod
- mikroglia
- mikrofon
- Mikroskoobi
- Mikroskoopia
- Kesk-
- minutit
- minimaalne
- miinimum
- ministeerium
- segu
- ML
- mudel
- mudelid
- moodul
- Moodulid
- molekul
- jälgitakse
- kuu
- hiir
- liikuma
- kolis
- MS
- mitmekanaliline
- lihas
- Nanotehnoloogia
- riiklik
- National Institutes of Health
- loodus
- Lähedal
- vajalik
- nekroos
- vajadustele
- negatiivne
- NEO
- neto
- võrk
- Neural
- neurofilament
- Neuronid
- järgmine
- ei
- müra
- number
- tuim
- objekt
- eesmärk
- esemeid
- jälgima
- saama
- saadud
- of
- maha
- Office
- offline
- Vana
- on
- kunagi
- ONE
- ainult
- avatud
- avad
- tegutses
- or
- Muu
- meie
- välja
- väljund
- väljaspool
- üle
- üldine
- üleöö
- ülevaade
- Hapnik
- pakette
- pad
- Valu
- pandas
- paneel
- osa
- sooritama
- mustrid
- PAWS
- PBS
- tipp
- kohta
- jõudlus
- teostatud
- periood
- perifeerne
- faas
- fenotüüp
- mänd
- torujuhe
- piksel
- paigutatud
- Lennukid
- inimesele
- plaatina
- Platon
- Platoni andmete intelligentsus
- PlatoData
- pluss
- pm
- Punkt
- võrra
- portfell
- positsioon
- positiivne
- post
- potentsiaal
- võim
- esialgne
- ettevalmistamine
- valmis
- olemasolu
- esitatud
- Säilinud
- surve
- varem
- esmane
- Eelnev
- sond
- menetlused
- protsess
- töödeldud
- Protsessid
- tootmine
- Toodet
- korralikult
- omadused
- kinnisvara
- osa
- kaitsta
- Valk
- protokoll
- protokollid
- anda
- pakkudes
- Tõmbab
- pulss
- Python
- R
- valik
- alates
- ROT
- määr
- suhe
- RE
- reaktsioon
- reaktsioonid
- valmis
- vastuvõtmine
- soovitused
- dokumenteeritud
- salvestamine
- taastumine
- vähendama
- Lühendatud
- vähendamine
- viide
- regenereerimine
- režiimid
- piirkond
- suhteline
- asjakohane
- jääma
- kõrvaldama
- Eemaldatud
- eemaldades
- korduv
- asendama
- Teatatud
- Aruandlus
- esindamine
- esindaja
- teadustöö
- Vastupidavus
- resolutsioon
- suhtes
- vastavalt
- vastus
- vastuste
- Tulemused
- Ümberpööramine
- läbi
- lint
- Rikas
- õige
- Tõusma
- Jõgi
- ruum
- jooks
- s
- sama
- skaneerida
- skripte
- Teine
- kesk-
- Osa
- lõigud
- kindlustama
- vaata
- väljavalitud
- Seeria
- Seerum
- Komplektid
- mitu
- kuju
- näidatud
- Näitused
- külg
- Signaali
- signaale
- tähendus
- märkimisväärne
- Silver
- üheaegselt
- ühekordne
- site
- Saidid
- SUURUS
- nahk
- Slaid
- Slaidid
- liug
- väike
- Tõmme
- tarkvara
- lahendus
- heli
- allikas
- ruumiline
- Kõneleja
- kõlarid
- määratletud
- specs
- Spektroskoopia
- naelu
- Spin
- ruut
- Stabiilsus
- stabiliseerima
- Kestab
- Roostevaba teras
- standard
- standardiseeritud
- Käivitus
- riik
- statistiline
- statistika
- aur
- teras
- vars
- Samm
- Sammud
- stiimul
- ladustamine
- ladustatud
- otse
- Strateegia
- Strip
- tugev
- struktuuriline
- struktuuride
- uuringud
- Uuring
- nahaalune
- järgnev
- mahukas
- selline
- summa
- Pind
- Kirurgia
- süsteem
- T
- Võtma
- võtnud
- sihtmärk
- Ülesanne
- tehnikat
- Tehnoloogia
- ajutine
- test
- testid
- kui
- et
- .
- Piirkond
- Tulevik
- Suurbritannia
- oma
- SIIS
- Seal.
- soojus
- nad
- see
- need
- kolm
- künnis
- Läbi
- läbi kogu
- Seega
- aeg
- korda
- ots
- nõuanded
- kude
- titaan
- et
- TONE
- ülemine
- Summa
- liigutav
- suunas
- jälgida
- rongid
- trans
- üle
- üle antud
- Ülekanne
- üleminek
- töödeldud
- ravi
- ravi
- uuringutes
- juhendaja
- kaks
- tüüp
- Uk
- ultraheli
- all
- mõistmine
- läbis
- kuni
- kasutama
- Kasutatud
- kasutamine
- vaakum
- kehtiv
- väärtus
- Väärtused
- Versus
- kaudu
- vivo
- Pinge
- maht
- kohta
- W
- kõndima
- jalutamine
- oli
- Vesi
- we
- nädal
- nädalat
- kaalumine
- kaal
- Heaolu
- olid
- millal
- mis
- kuigi
- valge
- kogu
- aken
- Traat
- koos
- tagasivõtmine
- ilma
- Töö
- töötas
- töö
- X
- röntgen
- sephyrnet