Kõiki reaktiive kasutati nii, nagu saadi, kui pole öeldud teisiti. Kõik kemikaalid osteti firmalt Sigma Aldrich, välja arvatud loendushelmed (CountBright Absolute Counting Beads, Invitrogen). ζ- Potentsiaali mõõdeti Zetasizer NanoZS90 (Malvern Instruments) abil. Osakeste suurust ja morfoloogiat uuris SEM JEOL JSM 7800F Prime mikroskoobis koos integreeritud EDS-iga, et saada elementaaranalüüs. Osakeste suurus määrati 50 sõltumatu osakese mõõtmisega. Raadio-kiire õhukese kihi kromatograafia (ITLC) töötati välja Agilent Technologies klaasmikrokiudkromatograafia paberil, mis oli immutatud ränihappega ja analüüsiti Lablogic Flow-count TLC skanneri ja BioScan B-FC-3200 fotokordisti toru (PMT) detektoriga, kasutades Laura tarkvara. ITLC liikuv faas koosnes 0.175 M sidrunhappest ja 0.325 M trinaatriumtsitraadist vees, kui pole öeldud teisiti. Radioaktiivsete proovide mõõtmiseks kasutati Capintec CRC-25R (Capintec) või LKB Wallac 1282 Compugamma CS (PerkinElmer), mille kohta andmeid koguti EdenTermi tarkvara abil. Voolutsütomeetria katsed viidi läbi BD FACSMelody rakusorteris, kasutades tarkvara BD FACSChorus. PET/CT-pildid saadi NanoPET/CT-skanneriga (Mediso), rekonstrueeriti Nucline v.0.21 tarkvaraga ja pilte analüüsiti VivoQuant tarkvaraga (versioon 3.5, InviCRO). Loendirežiimi andmed saadi spetsiaalse MATLAB-i tarkvaratööriistaga, mille on välja töötanud Mediso. Autoradiograafia viidi läbi seadmega GE Amersham Typhoon.
Submikromeetriliste ränidioksiidi osakeste süntees
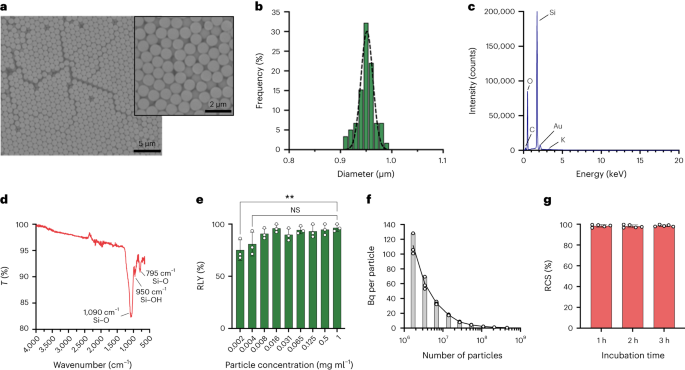
Osakesed sünteesiti Stöberi meetodil. See meetod põhineb räni alkoksiidide hüdrolüüsil ja järjestikusel kondensatsioonil monodisperssete sfääriliste ränidioksiidi osakeste saamiseks27. Räniallikana kasutati tetraetüülortosilikaati (TEOS), aluskatalüsaatorina ammoniaaki ja elektrolüüdina kaaliumkloriidi. Katalüsaatorit ja elektrolüüti sisaldavale lahusele lisati pidevalt TEOS-i lahust etanoolis. Reaktiivi algkoguse või lisamiskiiruse muutmine annab eelnevalt teatatud erinevused osakeste suuruses28. Siin valmistati enne osakeste sünteesi kaks lahust: lahus 1, mis sisaldas 19.0 mmol TEOS-i 33.3 ml EtOH-s ja lahus 2, mis sisaldas 0.23 mmol KCl 9 ml ammoniaagis, 65 ml EtOH ja 6.75 ml H.2O. Sünteesiks pandi lahus 2 250 ml ümarapõhjalisse kolbi, mida kuumutati 50 °C juures ja segati kiirusel 300 p/min 15 minutit. Seejärel lisati lahusele 1 tilkhaaval lahus 2 (varustuskiirus 0.2 ml min-1). Pärast lahuse 1 lisamist puhastati saadud osakesed tsentrifuugimisega 18,300 XNUMX °C juuresg 3 minutit ja pesti viis korda EtOH-ga. Lõpuks SiO2 mikroosakesed kuivatati vaakumis.
Submikromeetri suuruste osakeste pookimine silaani-PEG-ga5k
20 mg ml-1 silaani-PEG lahus5k (Sigma Aldrich) 98% EtOH-s lisati smSiP lahusele 5 mg ml.-1 EtOH-s 98% ja 2.8% ammoniaagis. Segu segati üleöö toatemperatuuril ja osakesed koguti tsentrifuugimisega 18,300 XNUMX °C juures.g 3 minutiks. Lõpuks pesti osakesi kolm korda destilleeritud veega ja kuivatati vaakumis üleöö. Pesulahused külmkuivatati üleöö ja kinnitamata silaani-PEG kogus5k reaktsiooni saagise arvutamiseks kaalutud. 0.05 mg ml-1 smSiP-PEG lahus5k destilleeritud vees kasutati edasisteks radiomärgistusreaktsioonideks.
[68Ga]GaCl3
Gallium-68 elueeriti kui [68Ga]GaCl3 Eckertilt ja Zieglerilt 68Ge/68Ga generaator ülipuhtas HCl-s (4 ml, 0.1 M), mis on toodetud hea tootmistava nõuete (ABX) järgi.
[68Ga]GaCl3 elueerimine katioonivahetuse teel
Elueerimise kontsentratsioon viidi läbi, kasutades lisajoonisel 1a kirjeldatud seadistust. 1. Esiteks, 4 ml [68Ga]GaCl3 elueerimine laaditi Strata-XC 33u padrunisse (Phenomenex) ja eluaat visati ära. Seejärel pesti padrunit 5 ml atsetooni/0.1 M HCl (80:20) lahusega ja eluaat visati ära. Lõpuks kontsentreeritud [68Ga]GaCl3 Koguti, lisades 700 µl atsetooni/0.05 M HCl (98:2) lahust, kuivatati N atmosfääris.2 ja resuspendeeriti 50 µl 0.5 M HEPES puhvris (pH 4.9). Kvaliteedikontrolliks viidi läbi raadio-TLC erinevatel etappidel. Protokoll võtab aega umbes 20 minutit, andes saagiseks 86.2 ± 8.5%.
Ränidioksiidi osakeste radiomärgistamine erinevates kontsentratsioonides koos 68Ga
Räniosakesed resuspendeeriti erinevates kontsentratsioonides (1 kuni 0.002 mg ml-1) 0.5 M HEPES puhvris (pH 4.9). Seejärel lisati reaktsioonituubi 50 µl lahust enne kontsentreeritud [68Ga]GaCl3 elueerimine 50 µl 0.5 M HEPES puhvris (pH 4.9). Reaktsioonid viidi läbi temperatuuril 90 °C 30 minutit ja radiokeemilise saagise arvutamiseks viidi läbi radio-TLC.
Osakeste kontsentratsiooni mõõtmine voolutsütomeetria abil
Osakeste kontsentratsioonid arvutati voolutsütomeetria abil, kasutades loendushelmeid (CountBright Absolute Counting Beads, Invitrogen), järgides tootja juhiseid. Ränidioksiidi osakesed resuspendeeriti koguses 0.05 mg ml-1, töödeldi ultraheliga 10 minutit ja lasti läbi 10 µm läbimõõduga filtri (KX süstlafilter, nailon, 25 mm, 10 µm). CountBright Absolute Counting Beads soojendati toatemperatuurini ja segati vorteksiga 30 sekundit. Seejärel lisati 50 µl ränidioksiidi osakestele 300 µl helmeid ja segu segati 30 minutit, et saada homogeenne lahus. Proovi viidi läbi voolutsütomeetril ja ettepoole hajumise (FSC) lävi määrati nii, et see hõlmaks graanuleid ja osakesi lineaarse FSC versus lineaarse külje hajumise graafikul. Seejärel reguleeriti loendushelmeste jaoks fluorestsentsdetektori pinget ja ränidioksiidi osakeste ja loendushelmeste populatsioonide eraldamiseks viidi läbi väravastrateegia. Lõpuks joonistati osakestele väravad ja absoluutsed loendushelmed ning iga proovi kohta registreeriti 1,000 helmeste sündmust. Seda strateegiat kasutades arvutati lahuses olevate osakeste arv järgmise võrrandi abil:
$$begin{array}{l}displaystyle{mathrm{Absolute}},{mathrm{count}},left(frac{mathrm{Particles}}{{{upmu l}}}right)=displaystylefrac{({mathrm{ Osakesed}},{mathrm{count}},times,{matehrm{Counting}},{mathrm{beads}},{mathrm{volume}})}{({mathrm{Counting}},{mathrm{beads}} ,{mathrm{count}},times,{mathrm{Particles}},{mathrm{volume}})} korda,{matehrm{Counting}},{matehrm{beads}},{matehrm{concentration}}left(frac) {{mathrm{Beads}}}{{{upmu l}}}right)end{array}$$
500 smSiP radiomärgistamine
Viissada smSiP lisati 50 µl kontsentreeritud [68Ga]GaCl3 elueerimine 0.5 M HEPES puhvris pH 4.9. Seejärel lisati 5.6 µl polüsorbaat 80 ja segu kuumutati temperatuuril 90 °C 30 minutit kiirusel 900 p/min termosegistis. Seejärel töötati välja viimane mitmeastmeline puhastusprotokoll, et eemaldada reageerimata/kolloidne 68Ga. Lisati 10 mikroliitrit 5 mM EDTA-d ja segu inkubeeriti 3 minutit toatemperatuuril. Seejärel tsentrifuugiti osakesi 18,300 minutit temperatuuril XNUMX XNUMX °Cg, resuspendeeriti 500 µl PBS-s, mis sisaldas 1 mM EDTA + 0.1% polüsorbaat 80, ja segati õrnalt vorteksiga 10 sekundit. Osakesi tsentrifuugiti uuesti, pesti 0.1 mM EDTA + 0.1% polüsorbaat 80 lahusega PBS-s ja segati õrnalt vorteksiga 10 sekundit. Lõpuks tsentrifuugiti osakesed ja pesti veel viis korda PBS + 0.1% polüsorbaat 80-ga ja resuspendeeriti 500 µl PBS-is. Radiomärgistusreaktsiooni jälgiti raadio-TLC abil järjestikuste reaktsioonietappide ajal, et hinnata kolloidide olemasolu (mida võib segi ajada osakestega, kui neid ei eemaldata korralikult), osakeste radiomärgistust ja lõpptoote puhtust. RLY arvutati osakeste radioaktiivsuse ja supernatantide radioaktiivsuse võrdlemisel pärast pesemisetappe.
Fraktsioneerimine
Fraktsioneerimisstrateegia jaoks mahud 0.5 µl kuni 20 µl 68Ga-smSiP teoreetilisel kontsentratsioonil 1 µl-1 lisati erinevatesse proovituubidesse 1 µl kaupa (0.5, 1, 2, 3…) ja lisati PBS, et viia lõppmaht 50 µl-ni. Seejärel pipeteeriti 37.5 µl esimesest katsutist teise proovikatsuti, 25 µl teisest katsutist kolmandasse katsutisse ja lõpuks 12.5 µl kolmandast katsutist neljandasse katsutisse. See strateegia annab neli katsutit proovi kohta lõpliku mahuga 12.5 µl katsuti kohta. Iga katseklaasi radioaktiivsust mõõdeti gamma-loenduriga ja väärtused arvutati edasiseks võrdlemiseks ja analüüsimiseks kalibreerimiskõvera abil kBq-s. Proove, mis sisaldasid suuremat osa radioaktiivsusest ainult ühes katseklaasis, töödeldi ultraheliga 30 sekundit toatemperatuuril ja viidi läbi teise fraktsioneerimisetapiga. Seejärel kasutati proove, milles kogu radioaktiivsus leiti ühes katseklaasis (ülejäänud kolmes katseklaasis tühise aktiivsusega), edasisteks in vivo / ex vivo katseteks.
PET/CT fantoomkuvamine
Ühega viidi läbi fantoomkujutise katse 68Ga-smSiP. Osakese prooviklaasi viimiseks kasutati kanüüli, et hinnata, kas üks osake võib manustamise ajal jääda kanüüli torusse lõksu. Lühidalt öeldes asetati fantoomtoru nanoPET / CT-skannerisse nii, et kanüüli ots oli toru külge kinnitatud. Pärast PET-i omandamise alustamist manustati 100 µl PBS-is resuspendeeritud osake insuliinisüstlaga, mis oli kinnitatud kanüüli algusesse. Seejärel pesti kanüüli 50 µl PBS-ga, et tagada osakeste kohaletoimetamine fantoomtorusse. PET-i omandamine viidi läbi 2 tundi, millele järgnes standardne CT-skaneerimine.
In vivo PET/CT pildistamine
Loomade pildistamise uuringud vaadati eetiliselt üle ja viidi läbi vastavalt Ühendkuningriigi siseministeeriumi 1986. aasta loomaseaduse (ASPA) loomkatseid reguleerivatele määrustele. In vivo pildistamine viidi läbi tervetel 8-nädalastel BALB/c hiirtel. Loomad anesteseeriti isofluraaniga (hapnikus 2–3%), kanüüliti ja asetati narkoosi alla skanneri voodile. Looma normaalse kehatemperatuuri hoidmiseks soojendati voodi sisemise õhuvoolu abil temperatuurini 37 °C ning hingamissagedust jälgiti ja hoiti 60–80 hingetõmmet minutis.-1 kogu skannimise ajal. Looma temperatuuri kontrolli säilitamine on oluline, kuna ootamatu temperatuuri langus võib põhjustada osakeste kiiruse vähenemist veres. Üks 68Ga-smSiP (n = 4) või 68Ga-smSiP-PEG5k osake (n = 2) manustati läbi kanüüli 100 ui PBS-s, millele järgnes pesemine 50 ui PBS-ga pärast PET kogumise alustamist (1:5 kokkulangevusrežiim; 5 ns kokkulangevuse ajaaken). PET registreeriti 2 tundi ja seejärel viidi läbi poolringikujuline CT-skaneerimine. Kogu protsessi vältel jälgiti loomade kehatemperatuuri ja hingamissagedust. Dünaamilised PET / CT kujutised rekonstrueeriti Tera-Tomo 3D rekonstrueerimise abil (400–600 keV energiaaken, 1:5 kokkulangevusrežiim, 20 iteratsiooni ja 1 alamhulk) voksli suurusega 0.4 × 0.4 × 0.4 mm3 ning korrigeeritud sumbumise, hajumise ja lagunemise suhtes. Kõigi PET/PEPT hankimiste loendirežiimi andmed leiate 68Ga-smSiP viites. 29 ja eest 68Ga-smSiP-PEG5k aadressil ref. 30.
Reaalajas jälgimine
Esiteks eksporditi skannerist andmed loendirežiimi vormingus (st ajatempli ja kristalliindeksiga vormingus tuvastatud kokkusattumusfootonite jaoks). Kasutati geomeetrilist teisendust, et teisendada kristalliindeksitest asendisse mm ühikutes. Birminghami meetod arvutab iteratiivselt MDP kõigi LoR-ide alamhulgast. See teeb seda nii, et loobutakse LoR-idest, mis asuvad MDP-st määratud kaugusel, kuna need tulenevad tõenäoliselt valedest LoR-idest, näiteks LoR-idest, mis võivad pärineda hajumist. MDP-d täpsustatakse iga iteratsiooniga; iteratsioonide arvu määrab tõhusalt f-tegur ja on seotud LoR-ide koguarvuga, mida kasutatakse osakeste lõpliku positsiooni hindamiseks selles alamhulgas (näiteks f-tegur 0.5 tähendab, et iteratsioonitsükkel lõpeb, kui 50% alamhulga LoR-idest jääb alles). Alamhulgas kasutatavate LoR-ide arvu saab vähendada, et parandada ajalist valimit (alamhulgad on ajaliselt järjestikused ilma kattumiseta) asukoha määramatuse suurendamise hinnaga (algoritmi täiendavaid üksikasju leiate artiklist Parker et al.5) PET-skanneri loendirežiimi andmete analüüsimiseks kasutati Birminghami meetodit. Osakeste jälgimiseks hiirtel kasutati adaptiivset proovi suurust. Valimi suurus määrati nii, et saavutada tasakaal piisava ajalise valimi vahel, minimeerides samas positsioneerimisvigu. Skaneerimise varases staadiumis (<100 s alates skannimise algusest) kasutati valimi suurust 200–60 LoR-i. f = 0.1, mis annab ligikaudu 1–5 sekundilise intervalli. Skaneerimisaegadel> 60 s varieerusid proovide suurused vahemikus 1,000 kuni 2,000, mis andis sõltuvalt in vivo katsest ajavahemikud 30 kuni 60 sekundit. MDP arvutamiseks kasutatud loenduste arvu (lõplikus iteratsioonis) saab leida, korrutades valimi suuruse f- teguri väärtus. Need parameetrid põhinesid eelnevatel kogemustel ja neid teavitati varasematest väljaannetest1.
Kiirus saadi kui (sqrt{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) kus ({v}_{m}^{2}) on kiirus x, y ja z juhiseid.
Ex vivo elundi omastamine
Omastamist erinevates organites hinnati gammaloendusega. Pärast in vivo PET/CT-kuvamist tapeti loomad emakakaela dislokatsiooniga ja elundid lõigati välja ja kaaluti radioaktiivsuse loendamiseks gammaloenduris (LKB Wallac 1282 Compugamma CS). Andmed väljendati süstitud annuse protsentides (annus elundis / süstitud koguannus) koe grammi kohta (%ID g-1).
Autoradiograafia
Radioaktiivsust kopsudes jälgiti kiirgusdetektoriga (EP15 sond, Morgan) ja kopsud lõigati skalpelliga väikesteks osadeks, kuni saadi väike osa radioaktiivse signaaliga koest. Kude külmutati –80 °C isopropanoolis. Kohe pärast külmutamist sisestati kude optimaalse lõiketemperatuuriga söötmesse ja lõigati krüostaadis 20 µm viiludeks. Iga lõiku uuriti detektoriga, kuni radioaktiivne viil leiti. Eelmine (tausta all), radioaktiivne ja järgmine (tausta all) viil asetati Superfrosti mikroskoobi slaidile (Epredia). Ülejäänud ülejäänud kude oli samuti taustal allpool. Kolme sektsiooniga mikroskoobi slaid kaeti toidukilega ja asetati üleöö GE autoradiograafiaplaadile. Plaati analüüsiti GE Amersham Typhooni abil eraldusvõimega 25 µm ja PMT seadistusega 4,000. Autoradiograafia pilt kanti koe pildile, näidates ühte radioaktiivsuse kohta radioaktiivses viilus. Kvantifitseerimiseks valmistati standardid erinevatele teadaolevatele tegevustele ja igaüks märgiti paberil 1 µl kvintettina. Laike inkubeeriti samas säilitusluminofoorekraanis, GE BAS-IP MS (mitmeotstarbeline standard), nagu üksikud osakesed kvantifitseeriti. Pilt saadi Amersham Typhoon 5-ga koos juhtimistarkvara versiooniga 2.0 luminofoorrežiimis piksli suurusega 100 µm ja tundlikkusega 4,000. Kujutised kvantifitseeriti tarkvaraga ImageQantTL v10.0-261, kasutades geeli kvantifitseerimise tööriistakasti. Laigud korrigeeriti, valides püsivaks taustaks piirkonna vahetult enne või pärast seda. Saadud laigu mahtu kasutati osakese Bq arvutamiseks kalibreerimiskõvera alusel.
Statistika ja reprodutseeritavus
Kvantitatiivseks analüüsiks analüüsiti vähemalt kolme bioloogilist kordust, välja arvatud in vivo andmed. 68Ga-smSiP-PEG5k (n = 2). Andmeid analüüsiti tavalise ühesuunalise dispersioonanalüüsi (ANOVA) abil, kasutades Dunnetti mitme võrdluse testi ja Studenti analüüsi. t- test. A P väärtust <0.05 peeti statistiliselt oluliseks.
- SEO-põhise sisu ja PR-levi. Võimenduge juba täna.
- PlatoData.Network Vertikaalne generatiivne Ai. Jõustage ennast. Juurdepääs siia.
- PlatoAiStream. Web3 luure. Täiustatud teadmised. Juurdepääs siia.
- PlatoESG. Süsinik, CleanTech, Energia, Keskkond päikeseenergia, Jäätmekäitluse. Juurdepääs siia.
- PlatoTervis. Biotehnoloogia ja kliiniliste uuringute luureandmed. Juurdepääs siia.
- Allikas: https://www.nature.com/articles/s41565-023-01589-8
- :on
- :mitte
- : kus
- ][lk
- 000
- 1
- 10
- 100
- 12
- 15%
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- absoluutne
- vastavust
- Saavutada
- omandatud
- omandamine
- ülevõtmised
- tegu
- tegevus
- tegevus
- adaptiivne
- lisatud
- lisades
- lisamine
- Kohandatud
- manustatud
- haldamine
- ettemaksed
- pärast
- pärast
- jälle
- AIR
- AL
- algoritm
- Materjal: BPA ja flataatide vaba plastik
- Ka
- Ammoniaak
- summa
- an
- analüüsima
- analüüs
- Ankur
- ja
- loom
- loomad
- rakendatud
- umbes
- OLEME
- tekkima
- AS
- At
- b
- tagapõhi
- Saldo
- baas
- põhineb
- alus
- BD
- BE
- enne
- Algus
- alla
- vahel
- Birmingham
- veri
- keha
- lühidalt
- tooma
- puhver
- by
- arvutama
- arvutatud
- arvutab
- arvutus
- CAN
- kaasas
- Katalüsaator
- rakk
- kemikaalide
- valimine
- klõps
- juhus
- võrdlus
- võrdlused
- koostatud
- Keskendunud
- kontsentratsioon
- läbi
- segaduses
- järjestikune
- kaaluda
- pidev
- pidevalt
- kontrollida
- kontrollitud
- muutma
- Parandatud
- Maksma
- võiks
- Võidelda
- loendamine
- kaetud
- kristall
- cs
- kõver
- lõigatud
- lõikamine
- andmed
- tarnima
- esitatud
- tarne
- Olenevalt
- kirjeldatud
- kavandatud
- detailid
- tuvastatud
- kindlaksmääratud
- arenenud
- erinevused
- erinev
- suunad
- nihestus
- kaugus
- ei
- annus
- koostatud
- Drop
- ajal
- dünaamiline
- e
- E&T
- iga
- Varajane
- tõhusalt
- elektrolüüt
- varjatud
- emissioon
- töötavad
- lõpp
- energia
- Inseneriteadus
- tagama
- seadmed
- vead
- hinnata
- Eeter (ETH)
- hindama
- hinnatud
- sündmused
- näide
- Välja arvatud
- välja arvatud
- kogemus
- eksperiment
- katseid
- väljendatud
- vale
- Viigipuu
- Film
- filtreerida
- lõplik
- Lõpuks
- esimene
- viis
- voog
- Järgneb
- Järel
- eest
- formaat
- edasi
- avastatud
- neli
- Neljas
- külmutamine
- Alates
- külmutatud
- FSC
- edasi
- Gates
- ge
- generaator
- klaas
- hea
- valitsev
- Gramm
- Kasv
- tervislik
- siin
- Avaleht
- Home Office
- HTTPS
- if
- pilt
- pildid
- Imaging
- kohe
- oluline
- parandama
- in
- sisaldama
- kasvav
- inkubeeritud
- sõltumatud
- indeks
- Indeksid
- teavitatakse
- kiire
- juhised
- instrument
- instrumendid
- integreeritud
- Interface
- sisemine
- sisse
- IT
- iteratsioon
- kordused
- hoidma
- teatud
- Kx
- viima
- Tõenäoliselt
- LINK
- kopsud
- säilitamine
- valmistatud
- tootmine
- materjal
- mai..
- vahendid
- mõõdetud
- mõõtmine
- keskmine
- meetod
- meetodid
- hiired
- mikron
- Mikroskoobi
- minutit
- minimeerimine
- miinimum
- mikser
- segu
- ML
- mobiilne
- viis
- jälgitakse
- rohkem
- Morgan
- kõige
- MS
- mitmekordne
- korrutades
- Nanotehnoloogia
- loodus
- järgmine
- ei
- normaalne
- number
- saama
- saadud
- of
- Office
- on
- ONE
- ainult
- vastupidine
- optimaalselt
- or
- tavaline
- Muu
- muidu
- välja
- üle
- üleöö
- Hapnik
- Paber
- parameetrid
- osake
- Vastu võetud
- PBS
- kohta
- protsent
- teostatud
- lemmikloom
- fantoom
- faas
- Footonid
- pilt
- piksel
- paigutatud
- Platon
- Platoni andmete intelligentsus
- PlatoData
- populatsioonid
- osa
- positsioon
- positsioneerimine
- Positron
- tava
- valmis
- olemasolu
- eelmine
- varem
- Peamine
- Eelnev
- sond
- menetlused
- protsess
- tootma
- Toode
- korralikult
- protokoll
- anda
- annab
- pakkudes
- ostetud
- kvaliteet
- kvantifitseerimine
- kvantitatiivne
- kogus
- R
- Kiirgus
- raadio
- valik
- määr
- reaktsioon
- reaktsioonid
- reaalajas
- saadud
- hiljuti
- dokumenteeritud
- taastumine
- Lühendatud
- vähendamine
- viide
- puhastatud
- piirkond
- määrused
- seostub
- jääma
- ülejäänud
- kõrvaldama
- Eemaldatud
- kordab
- Nõuded
- resolutsioon
- REST
- tulemuseks
- läbi
- -Läbi
- ruum
- jooks
- s
- sama
- skaneerida
- skaneerimine
- skaneerib
- SCI
- teaduslik
- Ekraan
- Teine
- sekundit
- lõigud
- SEM
- Tundlikkus
- komplekt
- kehtestamine
- seade
- näidates
- Sigma
- Signaali
- märkimisväärne
- Räni
- ühekordne
- SUURUS
- suurused
- Viil
- Slaid
- väike
- Tõmme
- tarkvara
- lahendus
- Lahendused
- allikas
- konkreetse
- Kaubandus-
- täpid
- etappidel
- standard
- standardite
- algus
- Käivitus
- väljendatud
- statistiliselt
- Samm
- Sammud
- ladustamine
- Strateegia
- oja
- õppinud
- uuringud
- Õppimine
- piisav
- varustama
- küsitletud
- süntees
- võtab
- tehnika
- Tehnoloogiad
- test
- kui
- et
- .
- SIIS
- teoreetiline
- soojus
- Need
- Kolmas
- see
- kolm
- künnis
- Läbi
- läbi kogu
- aeg
- korda
- ajatempel
- ots
- kude
- et
- tööriist
- Tööriistakast
- Summa
- jälgida
- Jälgimine
- Transformation
- lõksus
- kaks
- Uk
- Ebakindlus
- all
- Ootamatu
- üksused
- kuni
- Kasutatud
- kasutamine
- vaakum
- väärtus
- Väärtused
- VeloCity
- versioon
- Versus
- vivo
- Pinge
- maht
- mahud
- voksel
- W
- oli
- pesemine
- Vesi
- olid
- millal
- kas
- mis
- kuigi
- kogu
- will
- aken
- koos
- jooksul
- saak
- andis järele
- saagikus
- sephyrnet
- Tõmblukk