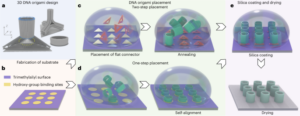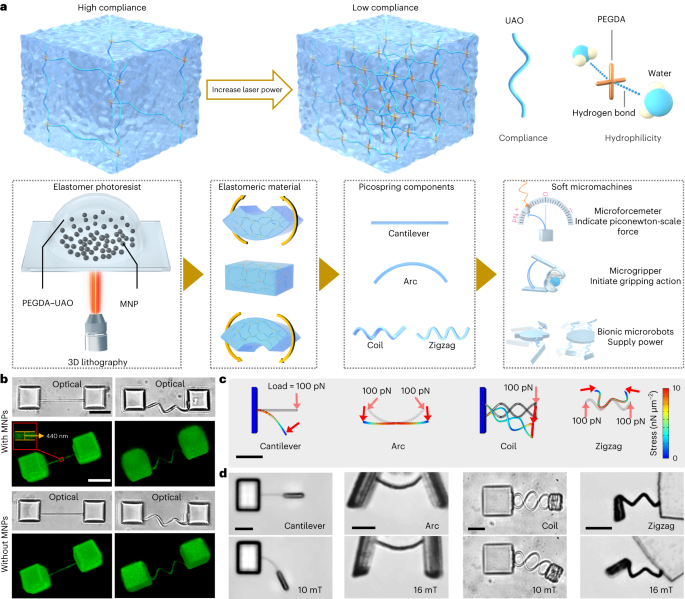
Preparación fotorresistente magnético-elástica.
Todos los productos químicos se adquirieron de Sigma-Aldrich a menos que se especifique lo contrario. El fotorresistente elástico consistía en oligómero de acrilato de uretano al 70 % en peso, diacrilato de poli(etilenglicol) al 28.40 % en peso como reticulante, 1-(4-(2-(dimetilamino)etoxi)fenil)-2-fenil-1-butanona al 1.5 en peso. % como fotoiniciador, y un complejo de 2,2,6,6-tetrametilpiperidina-1-oxilo 0.05 % en peso y metacrilato de metilo 0.05 % en peso como extintor. La mezcla se burbujeó con nitrógeno durante 30 min y se aspiró al vacío durante 30 min para desgasificar. Las MNP se prepararon basándose en un método clásico de coprecipitación. Brevemente, 5.38 g FeCl3· 6H2O y 1.98 g FeCl2· 4H2O se disolvieron en 200 ml de H2O. Luego se agregaron gota a gota 7 ml de hidróxido de amonio al 25% a la mezcla, que se agitó continuamente durante 3 h. Luego, las partículas recolectadas se lavaron con agua tres veces y se modificaron adicionalmente con metacrilato de 3-(trimetoxisilil)propilo en etanol en concentraciones de 1% en peso y 0.5% en peso a 80 °C durante 1 h (ref. 20). Las MNP se recogieron después de lavarlas con etanol tres veces. El fotorresistente magnético-elástico se preparó mezclando MNP en el fotorresistente elástico en una concentración del 5% o del 10% para la microtortuga especial que contenía doble concentración de MNP. Finalmente, el fotorresistente magnético-elástico se burbujeó con N2 durante 30 min y se aspiró durante 30 min. El fotorresistente preparado siempre debe mantenerse alejado de la luz a 4 °C antes de su uso.
Análisis numérico
Para diseñar las microestructuras de manera eficiente en función de las propiedades del material, se realizaron simulaciones para predecir la transformación de la forma de las microestructuras antes de la fabricación. Para los resultados presentados en las Figs. 1d y 6d, y datos extendidos Figs. 3 y 7, utilizamos un módulo multifísico definido por el usuario del software comercial de análisis de elementos finitos Comsol. Todos los sólidos y fluidos se consideraban incompresibles. El módulo de Young E se fijó en 0.422 MPa para los microforcemetros y 1.525 Mpa para los demás componentes elásticos, según los resultados de caracterización mecánica del picoresorte cantilever. El índice de Poisson para todos los materiales se fijó en 0.49, suponiendo que el material es casi incompresible. En todas las simulaciones, el medio de esperma (SP-TALP) se configuró como un fluido newtoniano con una densidad de 103 kg·m-3 y viscosidad de 1 mPa s. Durante el análisis de elementos finitos, la carga aplicada se dio en función del par magnético en el sistema de coordenadas local. El par magnético Tm se calculó utilizando una función simplificada aplicada al material magnético blando51:
$$begin{array}{l}{T}^{{mathrm{m}}}=frac{chi V}{mu }{B}^{2},sin izquierda(theta -arctanleft(tantheta veces frac{1 +0.118chi }{1+0.432chi }derecha)derecha)sqrt{{izquierda(frac{costheta }{1+0.118chi }derecha)}^{2}+{izquierda(frac{sintheta }{1+0.432chi } derecha)}^{2}}fin{matriz}$$
donde θ es el ángulo formado por el campo magnético con una densidad de flujo de B al fácil eje magnético del segmento; χ, V y μ representan la susceptibilidad magnética y el volumen aparente del segmento, y la permeabilidad magnética del agua (ver detalles en el Texto complementario 2). Las cargas límite de la simulación mecánica se aplicaron paralelas a la sección transversal de los resortes elásticos en el sistema de coordenadas local. Los pares magnéticos aplicados sobre las aletas de la microtortuga que se muestra en la Fig. 6d se calcularon de acuerdo con la ecuación anterior, simplificando las aletas como formas rectangulares como proyección en dos dimensiones.
Además, el micropingüino se analizó con un modelo cinemático resuelto mediante el método iterativo de cuarto orden de Runge-Kutta con MATLAB. Como se muestra en la figura de datos extendidos. 6d, las aletas y el torso del micropingüino se simplificaron como cuboides. Los componentes elásticos se simplificaron como resortes lineales. La rigidez a la flexión del componente elástico se obtuvo ajustando el par magnético equilibrado con respecto al ángulo de deflexión, que se mide como la mitad del ángulo variado de dos aletas en cada campo magnético. Se pueden encontrar parámetros de simulación adicionales en el texto complementario. 2. Los resultados de la simulación se utilizaron luego para guiar el diseño y la fabricación de las microestructuras y, además, fueron validados por los resultados experimentales.
Fabricación de microestructuras
Las microestructuras se fabricaron utilizando un sistema de escritura láser directa 3D (Photonic Professional GT, Nanoscribe). Durante la fabricación, la potencia del láser se fijó en 25.0 mW para todas las piezas rígidas, 5.5 mW para los picorresortes sensores de fuerza y 6.0 mW para todos los demás componentes elásticos, a menos que se especifique lo contrario. Después de la exposición, la muestra se reveló en acetona durante 24 h para eliminar todos los componentes no polimerizados. Como se muestra en la figura de datos extendidos. 1a, el ambiente se cambió de acetona a un medio a base de agua con ácido plurónico F127 (PF127) como espesante gradualmente a una velocidad de 200 μl min.-1 durante 12 h. Después de eso, la solución se reemplazó suavemente con SP-TALP con una pipeta. La integralidad estructural de las microestructuras basadas en picoresortes se mantuvo bien después de estas operaciones (Datos ampliados, Fig. 1b). En particular, en el experimento del microgripper, SP-TALP fue además reemplazado por un medio celular que imita el fluido del oviducto (medio celular que contiene 0.4% de metilcelulosa).52.
Durante la fabricación del microoscilador, el microoscilador de resorte helicoidal y el microforcemetro, el sustrato de vidrio se silanizó antes de su uso para evitar el desprendimiento de las microestructuras del sustrato. Se usó metacrilato de 3-(trimetoxisilil)propilo para unir los grupos terminales de metacrilato al sustrato, formando un enlace covalente entre el sustrato de vidrio y el fotoprotector magnético-elástico.53.
Durante la fabricación de la microtortuga, la exposición se realizó dos veces utilizando el fotoprotector con y sin MNP. Primero, se utilizó el fotorresistente elástico sin MNP para fabricar el torso. Después de eso, el fotorresistente fue reemplazado por un fotorresistente magnético-elástico. El sustrato de vidrio se pegó con un capilar de vidrio como indicador de alineación para alinearlo con las líneas de marca previamente marcadas en el soporte de la muestra para alinear la muestra en la misma posición que la primera exposición. El origen se encontró nuevamente según la posición del torso fabricado y el código de estructura se corrigió con un ángulo específico según el cambio de orientación del torso para mejorar al máximo la precisión de la fabricación. Luego se realizó la segunda exposición para fabricar las aletas y los componentes elásticos.
caracterización de materiales
Se utilizó un microscopio de espectro láser confocal (Zeiss LSM 980) para obtener la geometría 3D del microforcemetro con un láser de excitación de 488 nm y una detección de emisión de 580 nm. Se utilizó ImageJ para generar el modelo 3D de la estructura y medir las dimensiones.
La propiedad elástica del voladizo se calibró mediante un sistema de trampa óptica (Lumicks C-Trap). Se utilizaron microperlas de poliestireno de cinco micrómetros para calibrar la potencia del láser de la trampa óptica, proporcionando constantes de fuerza de captura de ciertas potencias del láser. Luego se tiraron de las microperlas para deformar el microforcemetro lo más lentamente posible, de modo que se pudiera despreciar la fuerza de arrastre. La curva de flexión del microforcemetro con respecto a la fuerza aplicada se puede determinar registrando las posiciones de la microperla y los ángulos de deflexión del voladizo (consulte los detalles en el Texto complementario 1.2). Cada grupo de mediciones se repitió en tres muestras. Las imágenes y los vídeos se analizaron con ImageJ y los datos se equiparon con OriginPro. La viscosidad de SP-TALP se tomó como 1 mPa s. La caracterización mecánica de las piezas rígidas fabricadas a 25 mW se realizó utilizando un AFM, como se muestra en la figura complementaria. 3 (ver detalles en el Texto Suplementario 1.2).
La propiedad de magnetización del material se caracterizó mediante un magnetómetro de dispositivo de interferencia cuántica superconductora (SQUID, Quantum Design) a temperatura ambiente con campos magnéticos de hasta 100 mT. Las muestras se prepararon como una matriz de 8,848 sólidos rectangulares con una longitud de 15 μm y un área de sección de 16 μm.2. La susceptibilidad del volumen se calculó como 0.1220, ajustando la magnetización con respecto al campo aplicado utilizando el software OriginPro.
Medición de la fuerza de propulsión mediante el microforcemetro.
Los microtubos motores de esperma, los microchorros tubulares y las microhélices fueron fabricados por TPL utilizando IP-DIP como fotoprotector. Después de la exposición, las muestras se secaron en un secador de punto crítico después de 20 minutos de revelado en mr-Dev 600 (Micro Resist) y se lavaron tres veces con isopropanol. Se recubrieron capas metálicas de Fe (10 nm) / Ti (5 nm) sobre los microtubos motores de esperma y las microhélices mediante pulverización catódica. Se recubrieron capas de Fe (10 nm)/Ti (5 nm)/Pt (10 nm) sobre el microchorro tubular mediante deposición por haz de electrones. El esperma bovino se preparó siguiendo el protocolo previamente informado.2. Todas las muestras se trataron en solución PF127 (1%) durante 0.5 h antes de su uso. La medición de los motores de los espermatozoides se realizó en la cámara del microforcemetro con 1 ml de SP-TALP que contenía aproximadamente 103 microtubos y 104 esperma. El motor del espermatozoide se formó cuando un espermatozoide quedó atrapado en un microtubo nadando aleatoriamente. Luego, el motor del espermatozoide fue guiado por el campo magnético externo, de aproximadamente 2 mT, hacia la barra de acción del microforcemetro. El campo magnético se ajustó perpendicularmente a la barra de acción, para evitar la influencia del par magnético en la deformación del voladizo. La medición de los microchorros se realizó en SP-TALP que contenía 1% H2O2 y dodecilsulfato de sodio al 0.1%. Se agregaron aproximadamente 20 microchorros y se guiaron de la misma manera que los motores de esperma. La medición de las microhélices se realizó aplicando un campo magnético giratorio de 10 mT a 40 Hz para accionamiento magnético. La fuerza de propulsión, es decir, la fuerza elástica cuando la velocidad del motor del espermatozoide es cero, se calculó mediante interpolación lineal en la curva de calibración del microforcemetro excepto la fuerza de propulsión del microjet, que se obtuvo a partir de la curva de simulación del análisis de elementos finitos. del microforcemetro corto. Todas las mediciones se realizaron a 37 °C a menos que se especifique lo contrario. ImageJ y OriginPro analizaron vídeos y datos. Las fuerzas elásticas se calcularon por interpolación en la curva de calibración del microforcemetro en la Fig. 3c, d.
Control magnético del micropinza.
El accionamiento magnético se realizó mediante un sistema de electroimán (Magnebotix MFG 100-i). Los campos magnéticos secuenciales en el tiempo se generaron mediante el diseño Bx, By y Bz con funciones por partes. Después del proceso de cambio de medio, las muestras del microrobot y la micropinza se trataron en el baño ultrasónico durante 5 minutos. Luego se usó una pipeta de 100 μl para soplar suavemente las muestras con medios para separar completamente las microestructuras del sustrato sin silanización. En los experimentos con microrobots, las muestras se dispersaron directamente en SP-TALP y se operaron en el campo magnético. En los experimentos con la micropinza, a la solución de muestra se le añadieron microobjetos preparados previamente (microperlas y microcoágulos). La muestra de microperlas se obtuvo dispersando directamente microperlas de poliestireno de 5 µm a aproximadamente 103 ml-1 como se muestra en la Fig. 4c, f. Los microcoágulos a base de proteínas se sintetizaron con albúmina sérica bovina mediante el uso de un método de microemulsión como se informó anteriormente.2. La solución que imita el fluido del oviducto se preparó basándose en el medio celular HeLa que contenía 0.4% de metilcelulosa para imitar la propiedad viscoelástica del fluido. Se aplicaron campos magnéticos giratorios para la locomoción de la micropinza de forma rodante y se aplicaron campos magnéticos uniformes para abrir el cubo de la pinza. Los vídeos y datos se manejaron con ImageJ y OriginPro.
Después de manipular las células HeLa, la célula objetivo se tiñó con un kit de tinción viva/muerta que contenía diacetato de fluoresceína y yoduro de propidio. Después de un período de incubación de 10 minutos, se capturaron imágenes de fluorescencia multicanal utilizando excitación a una longitud de onda de 470 nm para células vivas (longitud de onda de emisión 530 nm) y 540 nm para células muertas (longitud de onda de emisión 618 nm). Posteriormente, la célula HeLa objetivo se cultivó dentro del cubo del microgripper durante 4 h adicionales. Luego se realizó una segunda manipulación para transportar la célula HeLa a lo largo de una trayectoria rectangular. Después de esta manipulación, se volvieron a adquirir imágenes de fluorescencia. La presencia de fluorescencia verde de la célula objetivo después de la manipulación indicó que la micropinza no tuvo ningún impacto adverso en la viabilidad de la célula durante la manipulación, en contraste con la fluorescencia roja observada en células muertas al azar. El control de la orientación de la celda que se muestra en la Fig. 4g se implementó cambiando la dirección del vector del campo magnético aplicado después de que el micropinza había agarrado el grupo de células. Se aplicó un campo magnético uniforme de 6 mT a lo largo +x dirección para agarrar y definir la orientación inicial del grupo de células. Para cambiar la orientación de la celda en el x–y (guiñada) o x–z (paso), los vectores del campo magnético simplemente se rotaron a lo largo del z or y ejes en cualquier grado bajo demanda. Para cambiar la orientación de la celda en el y–z plano (rollo), se aplicó otro campo magnético giratorio a 2 mT y 20 Hz. La orientación del grupo celular en el y–z El plano se cambió cambiando el eje de rotación del campo magnético giratorio, mientras que el campo magnético uniforme de 6 mT se mantuvo a lo largo del +x eje.
Control magnético del micropingüino y la microtortuga.
Los microrobots con movimiento simétrico en el tiempo no pueden lograr un desplazamiento neto con un número de Reynolds bajo54. Una estrategia eficaz para romper la simetría del tiempo es hacer que la orientación del microrobot durante la transformación sea diferente de su orientación durante la recuperación. Como demostración, implementamos una estrategia de cambio de orientación para controlar al micropingüino. Datos ampliados Fig. 6a Representa las secuencias de los campos magnéticos con una duración de ciclo de 9 s como se muestra en la Fig. 6a: 0–1 s, se aplicó un campo magnético uniforme de 16 mT a lo largo del x eje (fases 1-2); 1–1.5 s, campo magnético de rotación de 16 mT a lo largo del y eje; 1.5–2.5 s, campo magnético uniforme de 2 mT a lo largo del z eje (fases 2-3); 2.5–4.5 s, campo magnético de rotación de 2 mT a lo largo del y eje; 4.5–5.5 s, campo magnético uniforme de 16 mT a lo largo del x eje (fases 3-4); 5.5–6 s, campo magnético de rotación de 16 mT a lo largo del y eje; 6–7 s, campo magnético uniforme de 2 mT a lo largo del z eje (fases 4-1); 7–9 s, campo magnético de rotación de 2 mT a lo largo del y eje. Después de un ciclo de 9 s, el micropingüino recupera su orientación original y gana un desplazamiento neto a lo largo del x eje. Datos ampliados Fig. 6b muestra las secuencias del campo magnético con una duración del ciclo de 5.5 s del micropingüino en una forma de natación más eficiente. En este caso, los campos magnéticos uniforme y de rotación se mezclaron, lo que permitió la rotación simultánea del micropingüino y la apertura y cierre de las aletas.
Una desventaja de la estrategia de control de cambio de orientación es la rotación concomitante de todo el robot, a pesar de su aplicabilidad universal a microrobots elásticos para generar un desplazamiento neto. Esta rotación se puede evitar utilizando un conjunto de picorresortes que accionan diferentes partes móviles de microrobots con magnetización no homogénea, por ejemplo, la microtortuga. Datos ampliados Fig. 7a muestra los resultados de la simulación del análisis de elementos finitos, que ayudan a buscar las direcciones más eficientes de los campos magnéticos. La secuencia del campo magnético de la estrategia de control final se muestra en la figura de datos ampliados. 7b. Sólo se necesitan campos magnéticos uniformes para generar un desplazamiento neto para la microtortuga debido a la actuación coordinada y las funciones de amortiguación de los pares de picorresortes izquierdo y derecho que controlan diferentes aletas. Entonces solo se controló a la microtortuga para que se moviera en dos dimensiones del x–y plano sin rotación ni desplazamiento en el z Eje: 0–1 s, 2 mT a lo largo de 15° (sentido antihorario como positivo) desde el +y dirección (eje simétrico de la microtortuga); 1–1.5 s, 2 mT a lo largo de −75° desde +y; 1.5–2.5 s, 16 mT a lo largo de −105° a lo largo +y; 2.5–3 s, 2 mT a lo largo +y. Todos los experimentos de locomoción de los microrobots se realizaron en PBS a 25 °C. La microtortuga contiene el doble de concentración de MNP y se controló con un período de ciclado de 0.8 s (Datos ampliados, Fig. 8) con secciones de fase comparables de 0 a 0.25 s, 0.25 a 0.4 s, 0.4 a 0.7 s y 0.7 a 0.8 s.
Evaluación de biocompatibilidad
Se utilizaron células HeLa para evaluar la biocompatibilidad de las micromáquinas, específicamente las matrices de micropinzas. En resumen, se colocaron 7 muestras de matrices de micropinzas fabricadas en los pocillos de cultivo celular de placas de 6 pocillos y se llenaron con 3 ml de medio de cultivo. Los pocillos del grupo de control se llenaron únicamente con medio celular. Cada pocillo fue sembrado con aproximadamente 105 Células HeLa. Después de 48 h de incubación, 1 pocillo del grupo de micropinza y 1 del grupo de control se tiñeron directamente utilizando el kit de tinción vivo/muerto que contenía diacetato de fluoresceína (5 mg ml-1 en acetona) y yoduro de propidio (1 mg ml-1 en PBS). Se tomaron imágenes de fluorescencia multicanal utilizando microscopía de fluorescencia (Cell Observer, Carl Zeiss Microscopy) bajo excitación a una longitud de onda de 470 nm para células vivas (longitud de onda de emisión 530 nm) y 540 nm para células muertas (longitud de onda de emisión 618 nm). Después de 72 h de incubación, los 12 pocillos restantes de células se tripsinizaron, se tiñeron y se contaron bajo el microscopio de fluorescencia. La viabilidad celular se calculó como la relación entre el número de células vivas (verde) y el recuento celular total.
Estadística y reproducibilidad
No se utilizó ningún método estadístico para predeterminar el tamaño de la muestra. No se excluyeron datos de los análisis. Las células y las muestras fabricadas se asignaron aleatoriamente a los respectivos grupos antes de la operación. Los investigadores no estaban cegados a la asignación durante los experimentos y la evaluación de resultados.
Resumen de informes
Más información sobre el diseño de la investigación está disponible en el Resumen de informes de la cartera de naturaleza vinculado a este artículo.
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- Fuente: https://www.nature.com/articles/s41565-023-01567-0
- :es
- :no
- $ UP
- 1
- 10
- 100
- 12
- 15%
- 16
- 20
- 200
- 2010
- 2019
- 2020
- 22
- 23
- 24
- 25
- 28
- 30
- 35%
- 3d
- 40
- 49
- 51
- 52
- 53
- 54
- 600
- 7
- 70
- 72
- 8
- 80
- 9
- 98
- a
- Nuestra Empresa
- arriba
- Conforme
- la exactitud
- Lograr
- adquirido
- la columna Acción
- adicional
- Adicionales
- Equilibrado
- adverso
- Después
- de nuevo
- AL
- alinear
- alineado
- alineando
- Todos
- asignación
- a lo largo de
- hacerlo
- am
- an
- análisis
- análisis
- analizo
- Comercial
- y
- Otra
- cualquier
- aplicada
- La aplicación de
- aproximadamente
- somos
- Reservada
- en torno a
- Formación
- artículo
- AS
- evaluar
- evaluación
- asigna
- At
- adjuntar
- Hoy Disponibles
- evitar
- evitado
- EJES
- Eje
- Equilibrado
- de caramelos
- basado
- BE
- se convirtió en
- antes
- entre
- volar
- cuerpos
- Descanso
- brevemente
- by
- calculado
- PUEDEN
- no puede
- capturar
- capturado
- Carl
- case
- (SCD por sus siglas en inglés),
- Células
- a ciertos
- Cámara
- el cambio
- cambiado
- cambio
- caracterizada
- productos químicos
- clásico
- clic
- cierre
- Médico
- código
- completo
- comparable
- integraciones
- componente
- componentes
- concentración
- contiene
- continuamente
- contraste
- control
- controlado
- CONTROL
- coordinar
- coordinado
- corregido
- podría
- COVALENTE
- crítico
- Cultura
- curva
- Cycle
- datos
- muerto
- definir
- Grado
- Demanda
- densidad
- Diseño
- diseño
- A pesar de las
- detalles
- Detección
- determina
- desarrollado
- Desarrollo
- dispositivo
- una experiencia diferente
- dimensiones
- de reservas
- dirección
- direcciones
- directamente
- Desventaja
- disperso
- desplazamiento
- hecho
- doble
- conducción
- caído
- secadora
- duración
- durante
- e
- E & T
- cada una
- de forma sencilla
- ed
- eficiente
- eficiente.
- elementos
- emisión
- permitiendo
- mejorar
- Entorno
- enzimático
- Éter (ETH)
- ejemplo
- Excepto
- excluidos
- experimento
- experimental
- experimentos
- Exposición
- extendido
- externo
- Fe
- campo
- Terrenos
- Higo
- Figura
- lleno
- final
- Finalmente
- Nombre
- adecuado
- fluido
- FLUX
- siguiendo
- FORCE
- Fuerzas
- formado
- encontrado
- Desde
- completamente
- función
- funciones
- promover
- Además
- Ganancias
- generar
- generado
- la generación de
- geometría
- dado
- Diezmos y Ofrendas
- vaso
- gradualmente
- Verde
- Grupo procesos
- Grupo
- guía
- guiado
- tenido
- A Mitad
- ayuda
- poseedor
- HTTPS
- IEEE
- imágenes
- Impacto
- implementar
- implementado
- in
- Incubación
- indicado
- Indicador
- influir
- información
- inicial
- dentro
- COMPLETAMENTE
- interferencia
- dentro
- Los investigadores
- SUS
- mantenido
- kit
- láser
- ponedoras
- izquierda
- Longitud Mínima
- Vida
- luz
- líneas
- LINK
- vinculado
- para vivir
- carga
- cargas
- local
- Baja
- Campo magnético
- para lograr
- manipulando
- Manipulación
- manera
- marcado
- materiales
- materiales
- medir
- mesurado
- multiplataforma
- medidas
- mecánico
- mecánica
- Medios
- mediano
- metal
- Método
- micro
- Microscopio
- Microscopía
- min
- mezclado
- Mezcla
- mezcla
- ML
- modelo
- modelado
- modificado
- módulo
- más,
- más eficiente
- MEJOR DE TU
- movimiento
- movimiento
- emocionante
- MT
- múltiples
- nanotecnología
- Naturaleza
- red
- no
- notablemente
- número
- observado
- obtener
- obtenido
- of
- on
- A bordo
- una vez
- , solamente
- habiertos
- apertura
- operado
- Inteligente
- Operaciones
- or
- Natural
- reconocida por
- Otro
- de otra manera
- salir
- Resultado
- pares
- Paralelo
- parámetros
- partes
- PBS
- realizado
- período
- fase
- Paso
- metido
- avión
- Aviones
- Platón
- Inteligencia de datos de Platón
- PlatónDatos
- punto
- portafolio
- posición
- abiertas
- positivo
- posible
- industria
- poderes
- predecir
- preparado
- presencia
- presentó
- previamente
- Profesional
- Proyección
- propiedades
- perfecta
- propulsión
- comprado
- Cuántico
- Rate
- proporción
- vea la grabación
- Recupera
- recuperación
- Rojo
- referencia
- considerado
- ,
- restante
- de forma remota
- remove
- repetido
- reemplazados
- reportado
- Informes
- representar
- la investigación
- respeto
- aquellos
- Resultados
- Derecho
- rígido
- robot
- Rodar
- Rolling
- Conferencia
- s
- mismo
- SCI
- Segundo
- (secciones)
- ver
- ver detalles
- EL EQUIPO
- segmento
- sensor
- Secuencia
- Serum
- set
- Forma
- formas
- En Corto
- tienes
- mostrado
- Shows
- simplificado
- simplificando
- simplemente
- simulación
- simultáneo
- Tamaño
- Despacio
- chica
- So
- sodio
- Soft
- Software
- a medida
- resuelto
- especial
- soluciones y
- específicamente
- especificado
- Spectrum
- velocidad
- esperma
- estadístico
- Estrategia
- estructural
- estructura
- Después
- susceptibilidad
- nadar
- te
- toma
- Target
- terminal
- texto
- esa
- La
- luego
- Estas
- theta
- así
- Tres
- garrapata
- equipo
- veces
- a
- Total
- hacia
- trayectoria
- trans
- transporte
- captura
- tratados
- Twice
- dos
- Ultrasónico
- bajo
- Universal
- utilizan el
- usado
- usando
- validado
- viabilidad
- Videos
- volumen
- fue
- Lavado
- Agua
- Camino..
- we
- WELL
- Wells
- tuvieron
- cuando
- que
- mientras
- todo
- sin
- la escritura
- zephyrnet
- cero