El tratamiento del cáncer con radiación puede estimular la respuesta inmune del cuerpo e inhibir el crecimiento tumoral, pero también puede reducir el nivel de linfocitos, los glóbulos blancos asociados con la respuesta inmune, lo que resulta en un control deficiente del tumor y un mal pronóstico. La gravedad de esta linfopenia inducida por la radiación se correlaciona con la dosis administrada a las células sanguíneas y los linfocitos circulantes. Como tal, minimizar la dosis en el corazón, la sangre periférica y los órganos linfoides podría ayudar a reducir este efecto perjudicial.
Para investigar más a fondo esta teoría, Antje Galts y Abdel Khalek Hammi de la Universidad TU Dortmund exploró si la radioterapia FLASH (radiación administrada en dosis ultraaltas) podría reducir el nivel de agotamiento de las células inmunes durante la terapia de protones en pacientes con cáncer cerebral.
“El mecanismo biológico detrás del efecto ahorrador de FLASH observado en dosis altas aún no se comprende completamente. Sin embargo, una de las teorías propuestas es la hipótesis inmune, que sugiere que la administración instantánea de dosis de irradiación FLASH reduce significativamente el agotamiento de los linfocitos circulantes al minimizar el tiempo de exposición”, explica Hammi. "En nuestro estudio, demostramos que un tratamiento hipofraccionado y una administración rápida de dosis protegieron a las células inmunes hasta 27 veces en comparación con un plan de tratamiento convencional de escaneo con haz de lápiz de protones fraccionado".
Galts y Hammi utilizaron un modelo dosimétrico de flujo sanguíneo para simular la dosis a los linfocitos circulantes durante la terapia de protones de intensidad modulada (IMPT) convencional y basada en FLASH de un tumor cerebral. El modelo de administración de haz dinámico simula un plan de tratamiento fraccionado IMPT considerando la variación espaciotemporal de la tasa de dosis de cada haz de lápiz de protones. Hammi señala que el modelo incorpora parámetros de entrega realistas de ciclotrones disponibles comercialmente.
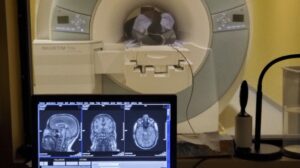
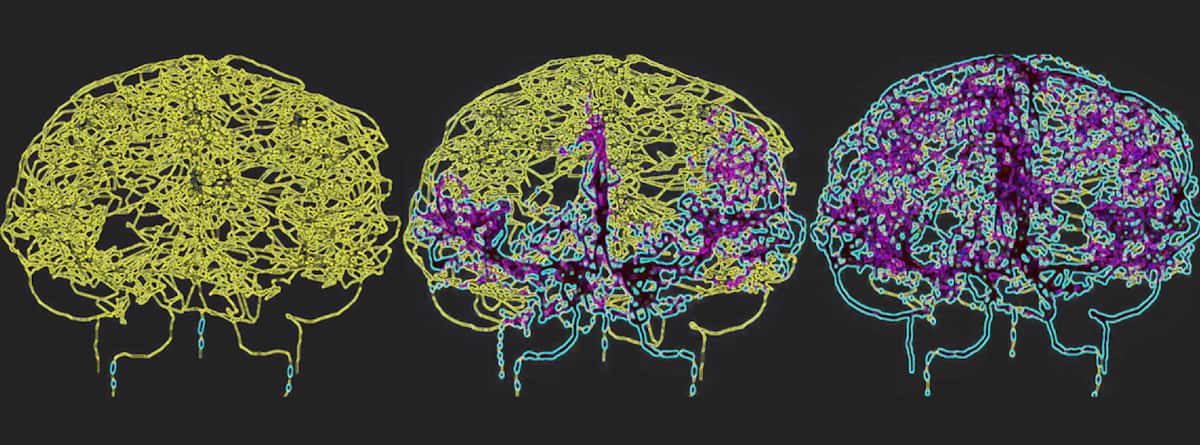
Para reflejar con precisión la circulación sanguínea en el cerebro humano, Galts y Hammi mapearon los vasos sanguíneos directamente a partir de imágenes de angiografía por resonancia magnética del cerebro. Utilizaron el modelo cerebrovascular resultante, que incluía 465 vasos sanguíneos y 8841 ramas de vasos individuales, para simular la circulación de células inmunes dentro del torrente sanguíneo.
Los investigadores crearon planes de tratamiento IMPT realistas para un tumor de glioblastoma, utilizando cuatro haces de protones incidentes y parámetros de administración clínicamente relevantes. Luego calcularon los campos de radiación variables en el tiempo a los que está expuesta la sangre circulante durante la ejecución de los planes de terapia de protones y la dosis acumulada después del tratamiento, informando sus hallazgos en Física en Medicina y Biología.
El glioblastoma es la forma más letal de cáncer cerebral y su tratamiento con radioterapia puede provocar linfopenia prolongada inducida por la radiación. "Al modelar un sistema cerebrovascular durante la administración de radiación, esperamos obtener conocimientos más profundos sobre cómo la radioterapia afecta la respuesta inmune en estos grupos de pacientes, lo que podría conducir a mejores estrategias terapéuticas", dice Hammi.
Comparaciones de planes
Galts y Hammi examinaron cuatro escenarios de tratamiento: IMPT FLASH con una única fracción de 22.3 Gy; FLASH hipofraccionado utilizando dos fracciones de 14.6 Gy y cinco de 8 Gy; e IMPT convencional utilizando treinta y dos fracciones de 2 Gy. Para cada plan de tratamiento, evaluaron el impacto dosimétrico sobre los linfocitos circulantes y estimaron la radiotoxicidad resultante.
Los histogramas de dosis-volumen revelaron que la radioterapia FLASH redujo significativamente la proporción de células irradiadas en comparación con la tasa de dosis convencional IMPT. Durante la primera fracción de tratamiento, los tres esquemas FLASH irradiaron alrededor del 1.52% del volumen de sangre circulante, mientras que la IMPT convencional irradió el 2.18%. Los planes FLASH hipofraccionados, distribuidos en dos o cinco fracciones, aumentaron este volumen irradiado al 3.01% y al 7.35%, respectivamente, mientras que el IMPT convencional expuso el 42.41% de la sangre periférica a la radiación.
A continuación, los investigadores examinaron el nivel de linfocitos circulantes que recibieron una dosis de al menos 7 cGy (un umbral que provoca un agotamiento del 2 % en la población de linfocitos) durante todo el tratamiento. Tras completar el IMPT convencional, el 25.65% de los linfocitos circulantes recibieron una dosis de al menos 7 cGy. Para los tratamientos FLASH de una, dos y cinco fracciones, los volúmenes que recibieron más de este umbral de dosis fueron del 1.21 %, 2.30 % y 5.14 %, respectivamente.
Los volúmenes de linfocitos circulantes que recibieron dosis de más de 100 cGy, lo que causa un agotamiento del 30%, fueron del 0.77%, 1.28% y 2.09% para FLASH de una, dos y cinco fracciones, respectivamente, y del 0.10% durante el IMPT convencional.
Galts y Hammi también estudiaron la respuesta de los linfocitos CD4+ y CD8+, que tienen diferentes distribuciones en la sangre periférica, a los distintos escenarios de irradiación. Para ambos tipos de linfocitos, la muerte celular después de la primera fracción fue del 0.66%, 0.62%, 0.32% y 0.08% para FLASH de una, dos y cinco fracciones y para IMPT convencional, respectivamente.
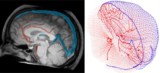
El modelo computacional determina la dosis en sangre durante la radioterapia.
Después del tratamiento completo, la depleción de linfocitos fue del 1.02% y del 1.56% para las fracciones de dos y cinco tratamientos, respectivamente, y del 2.14% para el IMPT convencional. Estos hallazgos demuestran que la terapia de protones FLASH preserva las células inmunes circulantes durante el tratamiento intracraneal, y FLASH de fracción única reduce la tasa de agotamiento en casi un 70 % en comparación con la IMPT convencional.
Hammi cuenta Mundo de la física que ahora están ampliando el modelo para incluir los cánceres de cabeza y cuello. "Además, estamos explorando varios métodos de administración de FLASH y su impacto en el agotamiento del sistema inmunológico, con un enfoque particular en el tratamiento FLASH conformal que se basa en la modulación de energía pasiva y específica del paciente", explica. "Este modelo de administración tiene el potencial de ahorrar más linfocitos circulantes en comparación con la administración FLASH directa".
- Distribución de relaciones públicas y contenido potenciado por SEO. Consiga amplificado hoy.
- PlatoData.Network Vertical Generativo Ai. Empodérate. Accede Aquí.
- PlatoAiStream. Inteligencia Web3. Conocimiento amplificado. Accede Aquí.
- PlatoESG. Carbón, tecnología limpia, Energía, Ambiente, Solar, Gestión de residuos. Accede Aquí.
- PlatoSalud. Inteligencia en Biotecnología y Ensayos Clínicos. Accede Aquí.
- Fuente: https://physicsworld.com/a/flash-irradiation-spares-immune-cells-during-proton-therapy/
- :posee
- :es
- :no
- $ UP
- 1
- 10
- 100
- 14
- 160
- 2%
- 22
- 25
- 27
- 35%
- 7
- 73
- 8
- a
- Acumulado
- precisamente
- Después
- Todos
- casi
- también
- an
- y
- somos
- en torno a
- AS
- evaluado
- asociado
- At
- Hoy Disponibles
- basado
- Manga
- detrás de
- sangre
- vasos sanguineos
- ambas
- Cerebro
- Cáncer de cerebro
- sucursales
- pero
- by
- calculado
- PUEDEN
- Cáncer
- los pacientes con cáncer
- cánceres
- Causar
- causas
- (SCD por sus siglas en inglés),
- Células
- circulante
- Circulación
- clic
- clínicamente
- comercialmente
- en comparación con
- completando
- en vista de
- control
- convencional
- podría
- creado
- más profundo
- liberado
- entrega
- métodos de entrega
- demostrar
- determina
- perjudicial
- una experiencia diferente
- directamente
- distribuciones
- dosificar
- dosis
- durante
- lugar de trabajo dinámico
- cada una
- efecto
- energía
- Todo
- igual
- equilibrio
- estimado
- Éter (ETH)
- en expansión
- Explica
- explorado
- Explorar
- expuesto
- Exposición
- RÁPIDO
- Terrenos
- Los resultados
- Nombre
- Digital XNUMXk
- Flash
- de tus señales
- Focus
- siguiendo
- formulario
- Digital XNUMXk
- fracción
- Desde
- ser completados
- completamente
- promover
- Obtén
- Grupo
- Crecimiento
- Tienen
- he
- Corazón
- ayuda
- Alta
- esperanza
- Cómo
- Sin embargo
- HTTPS
- humana
- imagen
- imágenes
- inmune
- Sistema inmunológico
- Impacto
- mejorado
- IMPUESTO
- in
- incidente
- incluir
- incluido
- incorpora
- aumentado
- INSTRUMENTO individual
- información
- Insights
- dentro
- investigar
- IT
- jpg
- matanza
- líder
- menos
- izquierda
- Nivel
- Etiqueta LinkedIn
- por más tiempo
- max-ancho
- mecanismo
- medicina
- métodos
- minimizando
- modelo
- modelado
- modelización
- más,
- MEJOR DE TU
- mr
- Notas
- ahora
- observado
- of
- on
- ONE
- habiertos
- or
- nuestros
- salir
- Más de
- parámetros
- particular
- pasivo
- los pacientes
- periférico
- Física
- Mundo de la física
- plan
- jubilación
- Platón
- Inteligencia de datos de Platón
- PlatónDatos
- pobre
- población
- posible
- la posibilidad
- propagación
- proporción
- propuesto
- La radiación
- Radioterapia
- Rate
- Tarifas
- realista
- recibido
- aprovecha
- reducir
- Reducción
- reduce
- la reducción de
- reflejar
- Informes
- investigadores
- respectivamente
- respuesta
- resultante
- Revelado
- Derecho
- s
- dice
- exploración
- escenarios
- esquemas
- gravedad
- mostró
- significativamente
- soltero
- comienzo
- estimular
- estrategias
- stream
- estudiado
- ESTUDIO
- tal
- Sugiere
- te
- decirles
- que
- esa
- El
- su
- luego
- teoría
- Terapéutico
- terapia forestal
- Estas
- ellos
- así
- Tres
- umbral
- A través de esta formación, el personal docente y administrativo de escuelas y universidades estará preparado para manejar los recursos disponibles que derivan de la diversidad cultural de sus estudiantes. Además, un mejor y mayor entendimiento sobre estas diferencias y similitudes culturales permitirá alcanzar los objetivos de inclusión previstos.
- uña del pulgar
- equipo
- veces
- a
- tratar
- del mismo día
- tratamientos
- verdadero
- tumor
- dos
- tipos
- entendido
- universidad
- usado
- usando
- diversos
- buque
- vasos
- volumen
- volúmenes
- fue
- we
- tuvieron
- cuando
- sean
- que
- mientras
- complejo de salvador blanco
- dentro de
- mundo
- amarillo
- aún
- zephyrnet