16. Januar 2024
(Nanowerk-Neuigkeiten) Eine wichtige chemische Reaktion – bei der die Bewegung von Protonen zwischen der Oberfläche einer Elektrode und einem Elektrolyten einen elektrischen Strom antreibt – ist ein entscheidender Schritt in vielen Energietechnologien, einschließlich Brennstoffzellen und Elektrolyseuren zur Herstellung von Wasserstoffgas. Zum ersten Mal haben MIT-Chemiker detailliert dargelegt, wie diese protonengekoppelten Elektronentransfers an einer Elektrodenoberfläche ablaufen. Ihre Ergebnisse könnten Forschern dabei helfen, effizientere Brennstoffzellen, Batterien oder andere Energietechnologien zu entwickeln. „Unser Fortschritt in dieser Arbeit bestand darin, die Art und Weise zu untersuchen und zu verstehen, wie diese Elektronen und Protonen an einer Oberfläche koppeln, was für katalytische Reaktionen relevant ist, die im Zusammenhang mit Energieumwandlungsgeräten oder katalytischen Reaktionen wichtig sind“, sagt Yogesh Surendranath, a Professor für Chemie und Chemieingenieurwesen am MIT und leitender Autor der Studie. Unter anderem konnten die Forscher genau nachvollziehen, wie sich Änderungen im pH-Wert der eine Elektrode umgebenden Elektrolytlösung auf die Geschwindigkeit der Protonenbewegung und den Elektronenfluss innerhalb der Elektrode auswirken. Der MIT-Absolvent Noah Lewis ist der Hauptautor des Artikels, der heute in erscheint Nature Chemistry („Ein mechanistisches Gerüst auf molekularer Ebene für die Kinetik des protonengekoppelten Elektronentransfers an der Grenzfläche“). Ryan Bisbey, ein ehemaliger MIT-Postdoc; Karl Westendorff, ein MIT-Absolvent; und Alexander Soudackov, ein Forschungswissenschaftler an der Yale University, sind ebenfalls Autoren des Papiers.
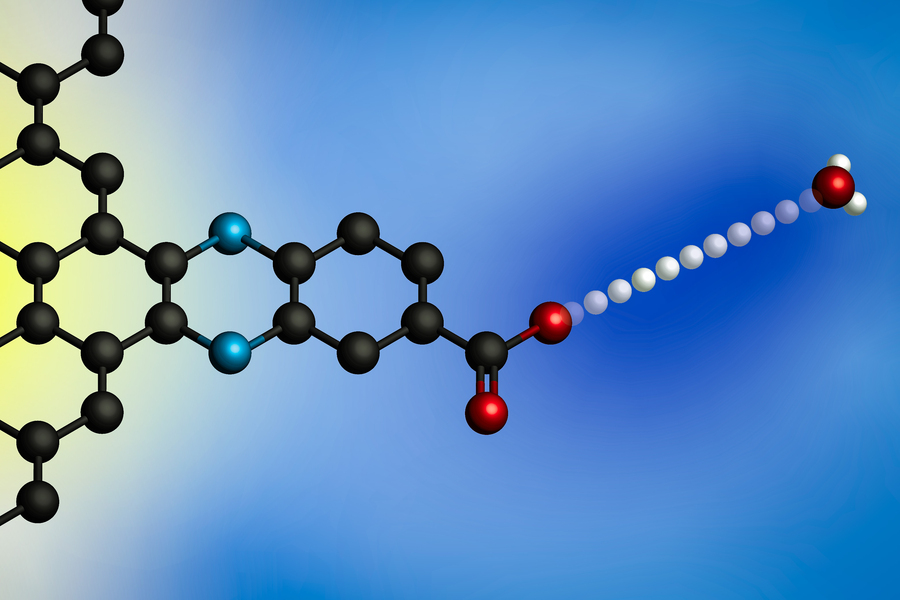 Durch Anlegen einer elektrischen Spannung wird ein Proton von einem Hydroniumion (rechts) auf die Oberfläche einer Elektrode übertragen. Mithilfe von Elektroden mit molekular definierten Protonenbindungsstellen entwickelten MIT-Forscher ein allgemeines Modell für diese protonengekoppelten Elektronentransferreaktionen an der Grenzfläche. (Bild: Mit freundlicher Genehmigung der Forscher)
Durch Anlegen einer elektrischen Spannung wird ein Proton von einem Hydroniumion (rechts) auf die Oberfläche einer Elektrode übertragen. Mithilfe von Elektroden mit molekular definierten Protonenbindungsstellen entwickelten MIT-Forscher ein allgemeines Modell für diese protonengekoppelten Elektronentransferreaktionen an der Grenzfläche. (Bild: Mit freundlicher Genehmigung der Forscher)
 Durch Anlegen einer elektrischen Spannung wird ein Proton von einem Hydroniumion (rechts) auf die Oberfläche einer Elektrode übertragen. Mithilfe von Elektroden mit molekular definierten Protonenbindungsstellen entwickelten MIT-Forscher ein allgemeines Modell für diese protonengekoppelten Elektronentransferreaktionen an der Grenzfläche. (Bild: Mit freundlicher Genehmigung der Forscher)
Durch Anlegen einer elektrischen Spannung wird ein Proton von einem Hydroniumion (rechts) auf die Oberfläche einer Elektrode übertragen. Mithilfe von Elektroden mit molekular definierten Protonenbindungsstellen entwickelten MIT-Forscher ein allgemeines Modell für diese protonengekoppelten Elektronentransferreaktionen an der Grenzfläche. (Bild: Mit freundlicher Genehmigung der Forscher)
Vorbeiziehende Protonen
Protonengekoppelter Elektronentransfer tritt auf, wenn ein Molekül, oft Wasser oder eine Säure, ein Proton auf ein anderes Molekül oder auf eine Elektrodenoberfläche überträgt, wodurch der Protonenakzeptor dazu angeregt wird, ebenfalls ein Elektron aufzunehmen. Diese Art von Reaktion wurde für viele Energieanwendungen genutzt. „Diese protonengekoppelten Elektronentransferreaktionen sind allgegenwärtig. Sie sind oft Schlüsselschritte in katalytischen Mechanismen und besonders wichtig für Energieumwandlungsprozesse wie die Wasserstofferzeugung oder die Brennstoffzellenkatalyse“, sagt Surendranath. In einem wasserstofferzeugenden Elektrolyseur wird dieser Ansatz verwendet, um Protonen aus Wasser zu entfernen und den Protonen Elektronen hinzuzufügen, um Wasserstoffgas zu bilden. In einer Brennstoffzelle wird Strom erzeugt, wenn Protonen und Elektronen aus Wasserstoffgas entfernt und mit Sauerstoff vermischt werden, um Wasser zu bilden. Der protonengekoppelte Elektronentransfer ist bei vielen anderen Arten chemischer Reaktionen üblich, beispielsweise bei der Kohlendioxidreduktion (der Umwandlung von Kohlendioxid in chemische Brennstoffe durch Zugabe von Elektronen und Protonen). Wissenschaftler haben viel darüber gelernt, wie diese Reaktionen ablaufen, wenn es sich bei den Protonenakzeptoren um Moleküle handelt, da sie die Struktur jedes Moleküls genau steuern und beobachten können, wie Elektronen und Protonen zwischen ihnen wechseln. Wenn jedoch ein protonengekoppelter Elektronentransfer an der Oberfläche einer Elektrode stattfindet, ist der Prozess viel schwieriger zu untersuchen, da Elektrodenoberflächen normalerweise sehr heterogen sind und viele verschiedene Stellen aufweisen, an die ein Proton potenziell binden könnte. Um dieses Hindernis zu überwinden, entwickelte das MIT-Team eine Methode zum Design von Elektrodenoberflächen, die ihnen eine viel präzisere Kontrolle über die Zusammensetzung der Elektrodenoberfläche ermöglicht. Ihre Elektroden bestehen aus Graphenschichten, an deren Oberfläche organische, ringhaltige Verbindungen angebracht sind. Am Ende jedes dieser organischen Moleküle befindet sich ein negativ geladenes Sauerstoffion, das Protonen aus der umgebenden Lösung aufnehmen kann, wodurch ein Elektron aus dem Kreislauf in die Graphitoberfläche fließt. „Wir können eine Elektrode schaffen, die nicht aus einer großen Vielfalt an Stellen besteht, sondern eine einheitliche Anordnung einer einzigen Art sehr genau definierter Stellen ist, die jeweils ein Proton mit der gleichen Affinität binden können“, sagt Surendranath. „Da wir diese sehr genau definierten Standorte haben, konnten wir die Kinetik dieser Prozesse wirklich entschlüsseln.“ Mit diesem System konnten die Forscher den Stromfluss zu den Elektroden messen und so die Rate der Protonenübertragung auf das Sauerstoffion an der Oberfläche im Gleichgewicht berechnen – dem Zustand, in dem die Rate der Protonenabgabe an die Oberfläche hoch ist und der Protonentransfer von der Oberfläche zurück in die Lösung sind gleich. Sie fanden heraus, dass der pH-Wert der umgebenden Lösung einen erheblichen Einfluss auf diese Rate hat: Die höchsten Raten traten an den äußersten Enden der pH-Skala auf – pH 0, der sauerste, und pH 14, der basischste. Um diese Ergebnisse zu erklären, entwickelten die Forscher ein Modell, das auf zwei möglichen Reaktionen basiert, die an der Elektrode auftreten können. 3O+), die in stark sauren Lösungen in hoher Konzentration vorliegen, geben Protonen an die Sauerstoffionen der Oberfläche ab und erzeugen so Wasser. Im zweiten Fall gibt Wasser Protonen an Sauerstoffionen an der Oberfläche ab und erzeugt so Hydroxidionen (OH).-), die in stark basischen Lösungen in hoher Konzentration vorliegen. Allerdings ist die Geschwindigkeit bei pH 0 etwa viermal schneller als bei pH 14, was teilweise darauf zurückzuführen ist, dass Hydronium Protonen schneller abgibt als Wasser.Eine Reaktion zum Umdenken
Zu ihrer Überraschung stellten die Forscher auch fest, dass die beiden Reaktionen nicht bei neutralem pH-Wert 7, wo die Hydronium- und Hydroxidkonzentrationen gleich sind, gleiche Geschwindigkeiten aufweisen, sondern bei pH 10, wo die Konzentration der Hydroxidionen eine Million Mal so hoch ist wie die von Hydronium. Das Modell legt nahe, dass dies darauf zurückzuführen ist, dass die Vorwärtsreaktion mit Protonenabgabe durch Hydronium oder Wasser mehr zur Gesamtgeschwindigkeit beiträgt als die Rückreaktion mit Protonenentfernung durch Wasser oder Hydroxid. Bestehende Modelle, wie diese Reaktionen an Elektrodenoberflächen ablaufen, gehen davon aus, dass die Vorwärts- und Rückwärtsreaktionen gleichermaßen zur Gesamtgeschwindigkeit beitragen. Die neuen Erkenntnisse legen daher nahe, dass diese Modelle möglicherweise überdacht werden müssen, sagen die Forscher. „Das ist die Standardannahme, dass die Vorwärts- und Rückwärtsreaktionen gleichermaßen zur Reaktionsgeschwindigkeit beitragen“, sagt Surendranath. „Unser Befund ist wirklich aufschlussreich, denn er bedeutet, dass wir die Annahme, mit der Menschen alles von der Brennstoffzellenkatalyse bis zur Wasserstoffentwicklung analysieren, möglicherweise überdenken müssen.“ Mit ihrem Versuchsaufbau untersuchen die Forscher nun, wie die Zugabe verschiedener Ionenarten zur Elektrolytlösung rund um die Elektrode die Geschwindigkeit des protonengekoppelten Elektronenflusses beschleunigen oder verlangsamen kann. „Mit unserem System wissen wir, dass unsere Standorte konstant sind und sich nicht gegenseitig beeinflussen, sodass wir herausfinden können, welche Auswirkungen die Änderung in der Lösung auf die Reaktion an der Oberfläche hat“, sagt Lewis.- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- Quelle: https://www.nanowerk.com/news2/green/newsid=64425.php
- :hast
- :Ist
- :nicht
- :Wo
- $UP
- 1
- 10
- 11
- 13
- 14
- 16
- 7
- 8
- a
- Fähig
- Über Uns
- Akzeptieren
- hinzufügen
- hinzugefügt
- Hinzufügen
- vorantreiben
- beeinflussen
- beeinflussen
- Udo
- erlaubt
- ebenfalls
- unter
- an
- analysieren
- und
- Ein anderer
- erscheint
- Anwendungen
- Anwendung
- Ansatz
- SIND
- Feld
- AS
- annehmen
- Annahme
- At
- Autor
- Autoren
- Zurück
- basierend
- basic
- Batterien
- BE
- weil
- war
- zwischen
- binden
- Bindung
- aber
- by
- Berechnen
- CAN
- Kohlenstoff
- Kohlendioxid
- Ursachen
- Zelle
- Die Zellen
- Center
- Übernehmen
- Änderungen
- berechnet
- chemisch
- Chemie
- Apotheke
- gemeinsam
- Zusammensetzung
- Konzentration
- konstante
- Kontext
- beitragen
- trägt dazu bei
- Smartgeräte App
- Umwandlung (Conversion)
- könnte
- Paar
- erstellen
- kritischem
- Strom
- Datum
- Deal
- Standard
- definiert
- Übergeben
- liefert
- Design
- Detail
- entwickelt
- Geräte
- anders
- schwer
- entdeckt
- Diversität
- do
- Tut nicht
- Dabei
- Spende
- nach unten
- Laufwerke
- jeder
- bewirken
- effizient
- Die elektrische
- Strom
- Elektrolyt
- Elektronen
- Ende
- endet
- Energie
- Entwicklung
- gleich
- gleichermaßen
- Gleichgewicht
- Äther (ETH)
- alles
- Evolution
- genau
- Beispiel
- vorhandenen
- experimentell
- Erklären
- Extrem
- beschleunigt
- Suche nach
- Befund
- Vorname
- erstes Mal
- Fluss
- Aussichten für
- unten stehende Formular
- Früher
- vorwärts
- gefunden
- vier
- Unser Ansatz
- für
- Treibstoff
- Brennstoffzellen
- Treibstoffe
- GAS
- Allgemeines
- erzeugt
- Erzeugung
- Generation
- gibt
- Abschluss
- Graphene
- groß
- passieren
- vorgespannt
- Haben
- Herz
- Hilfe
- GUTE
- höchste
- Ultraschall
- aber
- HTTPS
- Hydrierung
- Image
- wichtig
- in
- Einschließlich
- in
- Beteiligung
- IT
- jpg
- Karl
- Wesentliche
- Art
- Wissen
- führen
- gelernt
- Lewis
- viele
- Kann..
- Mittel
- messen
- Mechanismen
- Mitte
- Million
- MIT
- MIT-Absolvent
- Modell
- für
- Molekül
- mehr
- effizienter
- vor allem warme
- Bewegung
- Bewegung
- viel
- Natur
- Need
- negativ
- Neutral
- Neu
- Noah
- jetzt an
- beobachten
- Hindernis
- auftreten
- aufgetreten
- of
- vorgenommen,
- on
- or
- bio
- Andere
- UNSERE
- übrig
- Gesamt-
- Überwinden
- Sauerstoff
- Papier
- Teil
- besonders
- passieren
- Personen
- Plato
- Datenintelligenz von Plato
- PlatoData
- möglich
- Potenzial
- möglicherweise
- präzise
- genau
- Prozessdefinierung
- anpassen
- produziert
- Professor
- Protonen
- Bewerten
- Honorar
- Reaktion
- Reaktionen
- Lesen Sie mehr
- wirklich
- Reduktion
- relevant
- Entfernung
- entfernen
- Entfernt
- Erneuerbar
- erneuerbare Energie
- Forschungsprojekte
- Forscher
- Die Ergebnisse
- Enthüllt
- rückgängig machen
- Recht
- Lutz
- s
- gleich
- sagt
- Skalieren
- Wissenschaftler
- Wissenschaftler
- Zweite
- Senior
- Setup
- signifikant
- Single
- am Standort
- Seiten
- langsam
- So
- Lösung
- Lösungen
- etwas
- Geschwindigkeit
- Bundesstaat
- Schritt
- Shritte
- stimuliert
- starker
- Struktur
- Schüler und Studenten
- Studie
- Studieren
- so
- vorschlagen
- Schlägt vor
- Oberfläche
- Überraschung
- Umgebung
- System
- Nehmen
- Team
- Technologies
- als
- zur Verbesserung der Gesundheitsgerechtigkeit
- Das
- Der Staat
- ihr
- Sie
- Diese
- vom Nutzer definierten
- fehlen uns die Worte.
- diejenigen
- Zeit
- mal
- zu
- heute
- Spur
- privaten Transfer
- Transfers
- XNUMX
- tippe
- Typen
- allgegenwärtig
- Verständnis
- Universität
- entwirren
- us
- benutzt
- Verwendung von
- gewöhnlich
- sehr
- wurde
- Wasser
- Weg..
- we
- gut definiert
- waren
- Was
- wann
- welche
- breit
- mit
- .
- Zephyrnet