NMPA veröffentlichte am 15. Januar 2024 das endgültige Dokument „Guideline on Medical Device Real-world Study Design and Statistical Analysis“. Die Entwurfsversion wurde am 28. September 2023 veröffentlicht.
Bedeutung der Richtlinie
Die Richtlinie wird es ausländischen Herstellern erleichtern, das Hainan Real-World Data-Pilotprogramm weiter zu erkunden.
Die Pilotzone Hainan Boao ermöglicht die Verwendung nicht zugelassener medizinischer Geräte, In-vitro-Diagnostika und Arzneimittel mit klinischer Dringlichkeit im Ausland in China. Bei der Kommerzialisierung und dem Verkauf ihrer Produkte können Hersteller RWD über RWS in Hainan als lokale klinische Beweise in China sammeln, um ihre nationale NMPA-Registrierungsgenehmigung zu unterstützen. Das Sonderprogramm könnte ihren Marktzugang in China auf vier Monate verkürzen.
Die Regierung von Hainan veröffentlichte die „Vorschriften zur Verwaltung dringend benötigter importierter Arzneimittel und medizinischer Geräte in der Boao Lecheng International Medical Tourism Pilot Zone des Freihandelshafens Hainan” am 28. März 2023. In dem Dokument heißt es, dass es im Gegensatz zur nationalen Zulassung KEINE lokale Typprüfung oder eine erhebliche Beweislast erfordert.
Höhepunkte der Richtlinie
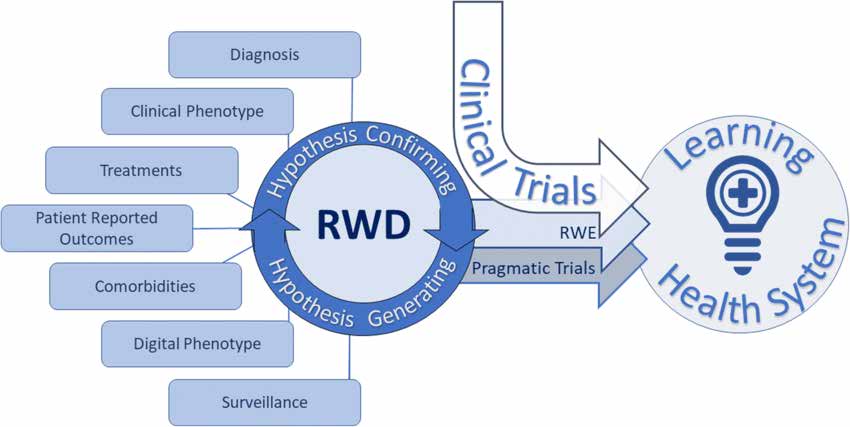
Das Dokument zu Studiendesign und statistischer Analyse beschreibt verschiedene Arten realer Forschung wie folgt:
Pragmatische randomisierte kontrollierte Studien (pRCTs) sind darauf ausgelegt, Behandlungsergebnisse in realen Gesundheitsumgebungen zu bewerten. Sie verwenden Randomisierungs- und Kontrollgruppen, um die Wirksamkeit der Intervention zu bewerten. Die pRCTs liefern qualitativ hochwertige Beweise aus der Praxis und eignen sich für verschiedene Patientengruppen und klinische Szenarien.
Observational Real-World Research umfasst verschiedene Studiendesigns:
- Beschreibende Studiendesigns Patientenmerkmale oder Gesundheitszustände beschreiben, ohne auf eine Kausalität schließen zu lassen.
- Kohortenentwürfe Verfolgen Sie die Ergebnisse bei verschiedenen Patientengruppen basierend auf der Gerätenutzung mit prospektiven und retrospektiven Optionen.
- Fallkontrolle und abgeleitete Designs Vergleichen Sie Patienten mit und ohne Gerätenutzung und schließen Sie verschachtelte Fall-Kontroll- und Fall-Kohorten-Studien ein.
- Reale Daten als externe Kontrollen Dazu gehört die Verwendung realer Daten als Kontrollgruppe, obwohl detaillierte Richtlinien fehlen.
Das Dokument skizziert Überlegungen zur Gestaltung realer Forschungsprotokolle:
- Hintergrund und Ziele: Definieren Sie Forschungshintergrund, Ziele sowie Sicherheits- und Wirksamkeitsprobleme auf der Grundlage vorhandener Daten.
- Machbarkeitsbewertung: Bewerten Sie die Machbarkeit der Durchführung realer Forschung unter Berücksichtigung der Datenverfügbarkeit, -qualität und verwirrender Variablen.
- Wählen Sie ein geeignetes Forschungsdesign: Wählen Sie das Design basierend auf Zielen aus, ob experimentell oder beobachtend.
- Studienflussdiagramm: Erstellen Sie ein Flussdiagramm, das den Studienprozess detailliert beschreibt, einschließlich Patientenauswahl, Interventionen und Untersuchungen.
- Studienpopulation definieren: Definieren Sie eindeutig Einschluss- und Ausschlusskriterien für die Studienpopulation.
- Gerätebelichtung: Bewerten Sie, wie Patienten dem Gerät ausgesetzt sind, und berücksichtigen Sie dabei mögliche Vorurteile.
- Kontrollgruppe: Bestimmen Sie geeignete Kontrollgruppen für Beobachtungsstudien, um Störvariablen auszugleichen.
- Zielparameter: Definieren Sie Ergebnismaße, einschließlich ihres Zwecks, ihrer Definition und ihrer Messmethoden.
- Datensammlung: Entwickeln Sie Datenerfassungsformulare und Wörterbücher und geben Sie Datenquellen, Qualitätsinformationen und Verknüpfungsmethoden an.
- Anpassung für Störvariables: Identifizieren Sie verwirrende Variablen und schließen Sie sie mit Gründen ein bzw. aus.
- Nachlaufzeit: Definieren Sie Nachbeobachtungs- oder Beobachtungszeiten für Patienten, um Forschungsfragen angemessen zu beantworten.
- Berechnung der Stichprobengröße und Trennschärfe: Berechnen Sie die Stichprobengröße und die statistische Aussagekraft unter Berücksichtigung verschiedener Faktoren.
Es unterstreicht auch die Bedeutung der Qualitätskontrolle:
- Datenqualität: Bewerten Sie die Datenqualität im Hinblick auf Repräsentativität, Vollständigkeit, Genauigkeit und mehr.
- Bias-Risiko: Beschreiben Sie Maßnahmen zur Kontrolle von Bias-Risiken in verschiedenen Phasen, einschließlich Auswahl, Information und Confounding Bias.
- Beurteilung der Voreingenommenheit: Erkennen Sie verschiedene Arten von Voreingenommenheiten und beurteilen Sie deren Richtung und Ausmaß.
- Ethische Überprüfung: Stellen Sie sicher, dass ethische Überprüfungen und informierte Einwilligungen den Vorschriften entsprechen.
Vergleich zweier Versionen
Im Vergleich zur Entwurfsversion wird im endgültigen Dokument im Abschnitt „Statistische Analyse“ die „Bestimmung von Störvariablen, die geändert werden müssen“ erwähnt.
Bei nicht-randomisierten realen Forschungsdesigns ist die Identifizierung von Störvariablen entscheidend für die Kontrolle von Verzerrungen. Drei Kriterien werden verwendet, um sie zu identifizieren: Eine Variable hat einen kausalen Zusammenhang mit dem Ergebnis, ist mit der Gruppierungsvariablen (Exposition) verbunden und ist keine Zwischenvariable im kausalen Pfad. Ein empfohlener Ansatz beinhaltet einen rationalen Variablenauswahlprozess auf der Grundlage von Fachwissen und klinischer Erfahrung in Zusammenarbeit mit klinischen und statistischen Experten. Für unsichere Variablen wird eine Sensitivitätsanalyse empfohlen, die Gründe und unterstützende Daten für den Einschluss/Ausschluss liefert. Es wird ein konservativer Ansatz zur Variablenauswahl empfohlen, der nicht verwandte Variablen vermeidet und Probleme wie Multikollinearität und Interaktionseffekte berücksichtigt, die durch gerichtete azyklische Graphen (DAGs) visualisiert werden.
Für eine englische Kopie der Richtlinie senden Sie bitte eine E-Mail info@ChinaMedDvice.com. Für die Übersetzung berechnen wir Schutzgebühren.
Klicken Sie sich einfach durch um die Neuigkeiten im Hainan Real World Data-Programm.
Klicken Sie sich einfach durch um die Kommunikationsrichtlinie Zusammenarbeit mit Regulierungsbehörden.
Sehen Sie hier unsere aufgezeichnetes Webinar zur Hainan-Politik.
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- Quelle: https://chinameddevice.com/real-world-study-nmpa/
- :hast
- :Ist
- :nicht
- 15%
- 2023
- 2024
- 28
- a
- Zugang
- Genauigkeit
- azyklisch
- angemessen
- Verwaltung
- beraten
- erlaubt
- ebenfalls
- an
- Analyse
- und
- beantworten
- Ansatz
- angemessen
- Genehmigung
- SIND
- AS
- beurteilen
- damit verbundenen
- At
- Verwaltung
- Verfügbarkeit
- Vermeidung von
- Hintergrund
- Balance
- basierend
- BE
- vorspannen
- Vorurteile
- Last
- Berechnen
- CAN
- Charakteristik
- berechnen
- China
- Auswählen
- Klinische
- Zusammenarbeit
- sammeln
- Sammlung
- COM
- entsprechen
- Bedingungen
- Leitung
- Zustimmung
- konservativ
- Überlegungen
- Berücksichtigung
- Smartgeräte App
- gesteuert
- Regelung
- Steuerung
- erstellen
- Kriterien
- wichtig
- technische Daten
- Datenqualität
- definieren
- Definition
- Abgeleitet
- beschreiben
- beschreibt
- Design
- entworfen
- Entwerfen
- Designs
- detailliert
- Detaillierung
- Bestimmen
- entwickeln
- Gerät
- Geräte
- anders
- gerichtet
- Richtung
- verschieden
- Dokument
- die
- Lüftung
- Drogen
- Wirksamkeit
- Effekten
- betont
- Englisch
- gewährleisten
- ethisch
- bewerten
- Beweis
- vorhandenen
- ERFAHRUNGEN
- experimentell
- Experten
- ERKUNDEN
- ausgesetzt
- Belichtung
- extern
- erleichtern
- Faktoren
- Durchführbarkeit
- Honorare
- Finale
- abgeschlossen
- Folgende
- Aussichten für
- Formen
- Frei
- weiter
- der Regierung
- Graphen
- Gruppe an
- Gruppen
- Richtlinien
- Gesundheit
- Gesundheitswesen
- hochwertige
- Ultraschall
- HTTPS
- identifizieren
- Identifizierung
- Bedeutung
- in
- das
- Dazu gehören
- Einschließlich
- Aufnahme
- Information
- informiert
- Interaktion
- Mittel
- International
- Intervention
- Interventionen
- beinhaltet
- Probleme
- IT
- Januar
- jpg
- Wissen
- fehlt
- Führer
- Gefällt mir
- aus einer regionalen
- Hersteller
- März
- Markt
- Messung
- Maßnahmen
- sowie medizinische
- medizinisches Gerät
- Medizinprodukte
- Erwähnungen
- Methoden
- könnte
- Monat
- mehr
- National
- Need
- Beobachtung
- Beobachtungs
- of
- on
- Optionen
- or
- UNSERE
- Ergebnis
- Ergebnisse
- Umrissen
- in Übersee
- Weg
- Vertrauen bei Patienten
- Patienten
- Pilot
- Plato
- Datenintelligenz von Plato
- PlatoData
- Bitte
- Politik durchzulesen
- Bevölkerung
- Populationen
- Potenzial
- Werkzeuge
- Prozessdefinierung
- Produkte
- Professionell
- Programm
- Beweis
- prospektiv
- Protokolle
- die
- Bereitstellung
- veröffentlicht
- Zweck
- Qualität
- Fragen
- Zufällig
- Rational
- echt
- realen Welt
- Gründe
- empfohlen
- Registrierung:
- Vorschriften
- Regulierungsbehörden
- Beziehung
- freigegeben
- erfordern
- Forschungsprojekte
- Bewertungen
- Risiken
- Sicherheit
- sagt
- Szenarien
- Abschnitt
- Auswahl
- in XNUMX Minuten
- Sensitivität
- September
- Einstellungen
- signifikant
- Größe
- Quellen
- besondere
- Stufen
- statistisch
- Status
- Es wurden Studien
- Studie
- geeignet
- Support
- Unterstützung
- AGB
- Testen
- zur Verbesserung der Gesundheitsgerechtigkeit
- Das
- ihr
- Sie
- vom Nutzer definierten
- obwohl?
- nach drei
- Durch
- mal
- zu
- Tourismus
- verfolgen sind
- Handel
- Übersetzungen
- Behandlungen
- Studien
- XNUMX
- tippe
- Typen
- Unsicher
- Dringlichkeit
- dringend
- -
- benutzt
- Verwendung von
- Variable
- verschiedene
- Version
- wurde
- we
- ob
- während
- werden wir
- mit
- ohne
- arbeiten,
- weltweit wie ausgehandelt und gekauft ausgeführt wird.
- Zephyrnet