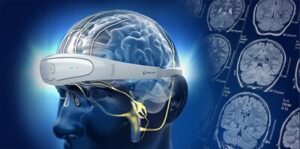
Neuro20 Technologies ist das erste in den USA ansässige Unternehmen, das ein von der FDA zugelassenes medizinisches Textil zur elektrischen Muskelstimulation herstellt, das den Kreis zwischen Diagnostik und Eingriffen in einem drahtlosen Betriebssystem schließt
TAMPA, Florida., 2. März 2023 / PRNewswire / - Neuro20 Technologies Corp, ein Hersteller tragbarer medizinischer Geräte, der sich auf die Entwicklung drahtloser tragbarer Textilien der nächsten Generation zur Behandlung von neuromuskulären Verletzungen und Erkrankungen bei gleichzeitiger Verbesserung der Leistungsfähigkeit des Menschen spezialisiert hat, gab heute bekannt, dass die US-amerikanische Food and Drug Administration (FDA) die 510(k)-Zulassung des Unternehmens genehmigt hat. Antrag auf Marktzulassung für sein Neuro20 PRO System.
Als erstes tragbares Gerät seiner Art kontrahiert der Neuro20 PRO System Ganzkörper-Elektro-Muskelstimulator-Anzug, Software und Betriebssystem unwillkürlich 42 Muskeln unabhängig voneinander oder durch eine beliebige Kombination von Co-Kontraktionen, mit Steuerspezifität für jeden Muskel für 1 bis 10 Patienten auf einmal.
„Neuro20 Technologies hat die größte Hürde in der Rehabilitation gelöst: die Korrektur alter Gewohnheiten, die als Reaktion auf alte Verletzungen entstanden sind“, sagte Dr. Davis W. Brockenshire, DC, von Innovative Health Solutions, a Michigan-basierte Praxis, die sich auf fortgeschrittene funktionelle Medizin spezialisiert hat. „Die Fähigkeit, korrigierende Bewegungsmuster ohne Verletzung oder Erschöpfung neu zu trainieren, ermöglicht es dem Klienten, eine ansonsten unerreichbare Leistungsfreiheit zu erreichen. Ich persönlich verwende das Neuro20 PRO System, um optimale Bewegungsmuster wiederzuerlangen und aufrechtzuerhalten, die auf Verletzungen zurückzuführen sind, die ich mir über ein Leben lang bei sportlichen Wettkämpfen zugezogen habe.“
Der Anzug des Neuro20 PRO-Systems verfügt über groß konturierte Elektroden, um die maximale Aktivierung von Motoneuronen abzudecken, was ihn von aktuellen elektrischen Muskelstimulationssystemen auf dem Markt unterscheidet. Das Neuro20 PRO System verfügt über vier Programme und neun Untermodi für Kraft und Erholung, einschließlich proprietärer PEMS-Programme (Patterned Electrical Muscle Stimulation), die unwillkürlich Muskeln in der gesamten Motorkette kontrahieren und bestimmte Bewegungsmuster replizieren, während der Patient versucht, eine freiwillige Übersteuerung zu erzeugen die Bewegung.
Die Ergebnisse der Elektrostimulation zeigen je nach Genexpression eine bis zu 20 %ige Steigerung der maximalen freiwilligen Kontraktion, eine bis zu 30 %ige Gefäßerweiterung und eine Steigerung des BDNF (vom Gehirn stammender neurotropher Faktor) zwischen 18 % und 30 %. Die FDA hat das Neuro20 PRO-System für die folgenden Anwendungsgebiete zugelassen: Muskelrehabilitation, Steigerung der lokalen Durchblutung, Aufrechterhaltung oder Steigerung des Bewegungsbereichs, Entspannung von Muskelkrämpfen, Verringerung oder Vorbeugung von Muskelatrophie.
„Die FDA-Zulassung unseres Neuro20 PRO-Systems zur Behandlung neuromuskulärer Verletzungen und Erkrankungen ist ein bedeutender Meilenstein für Neuro20 Technologies, während wir uns darauf vorbereiten, den Markt über die Vorteile dieses technologischen Fortschritts aufzuklären“, sagte er Dennis M. Schmitt, Chief Executive Officer von Neuro20 Technologies. „Unser bahnbrechender Ansatz zur körperlichen Rehabilitation hat das Potenzial, den Patienten erheblichen Nutzen zu bringen. Wir freuen uns, die aktuellen Branchenpraktiken in der Elektrostimulationstherapie zu revolutionieren, indem wir sichere, erschwingliche und ergebnisorientierte Ergebnisse für Anbieter und Patienten bieten, die an neuromuskulären Verletzungen und Erkrankungen leiden. Das Neuro20 PRO-System ist die Neukonzeption der elektrischen Muskelstimulation, um sie sowohl für den Anbieter als auch für den Patienten effizienter zu machen. Die FDA-Zulassung wird die Elektromedizin im 21. Jahrhundert voranbringen, und wir freuen uns darauf, die Möglichkeiten in diesem Bereich neu zu gestalten, indem wir mit Anbietern zusammenarbeiten, um diese neue, effiziente Technologie zu demonstrieren.“
Über Neuro20 Technologies Corp.
Neuro20 Technologies wurde 2021 gegründet und ist eine registrierte Delaware Corp mit Sitz in Tampa, Florida. Neuro20 Technologies befindet sich im Gebäude „Forschung und Innovation“ der University of South Florida, USF CONNECT, und ist Mitglied des Tampa Bay Technology Incubator. Neuro20 Technologies konzentriert sich auf die Transformation der Gesundheit durch wissenschaftliche, forschungsbasierte Praktiken unter Verwendung der elektrischen Muskelstimulation (EMS). Wir sind stolz darauf, von einem Expertenteam geleitet zu werden, dessen Wissen sich über viele Disziplinen hinweg erweitert, mit dem gemeinsamen Ziel, die Art und Weise zu modernisieren, wie Technologie zur Förderung der Genesung und der menschlichen Leistungsfähigkeit eingesetzt wird.
Vorausschauende Aussagen
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen im Sinne der Safe-Harbor-Bestimmungen des Private Securities Litigation Reform Act von 1995. Aussagen in dieser Pressemitteilung zu den Erwartungen, Plänen, Geschäftsaussichten oder der zukünftigen Leistung des Unternehmens sowie alle anderen Aussagen zu getroffenen Annahmen oder Erwartungen in Bezug auf zukünftige Ereignisse, Bedingungen, Leistungen oder andere Angelegenheiten sind „zukunftsgerichtete Aussagen“. Zukunftsgerichtete Aussagen umfassen Aussagen über unsere Absichten, Überzeugungen, Prognosen, Ausblicke, Analysen oder aktuellen Erwartungen unter anderem in Bezug auf: unsere Forschungs-, Entwicklungs- und Regulierungsaktivitäten und Erwartungen in Bezug auf unser Neuro20 PRO-System; die Wirksamkeit dieser Programme bzw. der mögliche Anwendungsbereich und mögliche Heilwirkungen und Sicherheit bei der Behandlung von Verletzungen und Krankheiten; das Timing, die Durchführung und der Erfolg unserer klinischen Produkte, unsere Fähigkeit, unsere Produktionsanlagen zur Unterstützung der klinischen und kommerziellen Nachfrage zu nutzen; und unsere zukünftigen Betriebsausgaben und Investitionsanforderungen. Zukunftsgerichtete Aussagen unterliegen naturgemäß Risiken, Ungewissheiten und anderen Faktoren, die dazu führen können, dass die tatsächlichen Ergebnisse erheblich von den in solchen Aussagen genannten abweichen. Zu diesen Risiken, Ungewissheiten und Faktoren gehören unter anderem die Risiken, die in den neuesten Formularen 10-K, 10-Q und anderen SEC-Einreichungen des Unternehmens aufgeführt sind, die über EDGAR unter erhältlich sind https://www.sec.gov/. Das Unternehmen übernimmt keine Verpflichtung, unsere zukunftsgerichteten Aussagen nach dem Datum dieser Pressemitteilung zu aktualisieren, sei es aufgrund neuer Informationen, zukünftiger Ereignisse oder aus anderen Gründen.
Ansprechpartner für Investoren:
Alumni-Engel der Harvard Business School
Christian Schweizer
Presidentaa@hbssouthflorida.org
Pressekontakt:
Michael Finkelstein
Neuro20-Technologien
917-503-6876
354776@email4pr.com
![]() Anzeigen des Originalinhalts zum Herunterladen von Multimedia:https://www.prnewswire.com/news-releases/neuro20-technologies-announces-fda-clearance-of-the-neuro20-pro-system-for-treatment-of-neuromuscular-injury-and-disease-301760544.html
Anzeigen des Originalinhalts zum Herunterladen von Multimedia:https://www.prnewswire.com/news-releases/neuro20-technologies-announces-fda-clearance-of-the-neuro20-pro-system-for-treatment-of-neuromuscular-injury-and-disease-301760544.html
QUELLE Neuro20 Technologies Corp.
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- Platoblockkette. Web3-Metaverse-Intelligenz. Wissen verstärkt. Hier zugreifen.
- Quelle: https://www.biospace.com/article/releases/neuro20-technologies-announces-fda-clearance-of-the-neuro20-pro-system-for-treatment-of-neuromuscular-injury-and-disease/?s=93
- 1
- 10
- 2021
- a
- Fähigkeit
- Über uns
- Erreichen
- über
- Handlung
- Aktivierung
- Aktivitäten
- Verwaltung
- advanced
- Förderung
- Fortschritte
- Ranking
- Nach der
- erlaubt
- unter
- und
- angekündigt
- Kündigt an
- Anwendung
- Ansatz
- Genehmigung
- sportlich
- Versuche
- verfügbar
- Bucht
- wird
- Nutzen
- Vorteile
- zwischen
- Blut
- Building
- Geschäft
- Business School
- Hauptstadt
- Verursachen
- Jahrhundert
- Kette
- Chef
- Chief Executive Officer
- Die Durchblutung
- Auftraggeber
- Klinische
- Schließt
- Collective
- COM
- Kombination
- kommerziell
- Unternehmen
- Ligen
- Bedingungen
- Leiten
- Vernetz Dich
- Kontakt
- enthält
- Inhalt
- Vertrag
- Kontraktion
- Verträge
- Smartgeräte App
- Corp
- könnte
- Abdeckung
- erstellen
- Strom
- DC
- Datum
- Delaware
- Demand
- zeigen
- Abhängig
- Entwicklung
- Gerät
- abweichen
- Krankheit
- Krankheiten
- Störung
- herunterladen
- Medikament
- jeder
- erziehen
- Wirksamkeit
- Effekten
- effizient
- Eine Verbesserung der
- Äther (ETH)
- Veranstaltungen
- aufgeregt
- Exekutive
- Executive Officer
- Ausbau
- Erwartungen
- Kosten
- Experten
- Anlagen
- Faktoren
- FDA
- funktions
- Feld
- Vorname
- konzentriert
- Folgende
- Nahrung,
- Food and Drug Administration
- Food and Drug Administration (FDA)
- unten stehende Formular
- gebildet
- vorwärts
- vorausschau
- Gründung
- Freiheit
- für
- funktional
- Zukunft
- Kundenziele
- größte
- Gesundheit
- Ultraschall
- HTML
- HTTPS
- human
- in
- das
- Einschließlich
- Erhöhung
- zunehmend
- Inkubator
- unabhängig
- Anzeigen
- Energiegewinnung
- Information
- Innovation
- innovativ
- Absichten
- IT
- Wissen
- starten
- geführt
- Lebensdauer
- Limitiert
- Rechtsstreit
- aus einer regionalen
- located
- gemacht
- halten
- um
- Herstellung
- viele
- Markt
- wesentlich
- Angelegenheiten
- maximal
- sowie medizinische
- medizinisches Gerät
- Medizin
- Mitglied
- Meilenstein
- mehr
- effizienter
- vor allem warme
- Bewegung
- Motor
- Bewegung
- Multimedia
- Natur
- Neu
- News
- Pressemitteilung
- nächste Generation
- Offizier
- Alt
- die
- Betriebssystem
- optimal
- Original
- Andere
- Andernfalls
- Outlook
- Override
- Vertrauen bei Patienten
- Patienten
- Muster
- Leistung
- Persönlich
- physikalisch
- Pionierarbeit
- Pläne
- Plato
- Datenintelligenz von Plato
- PlatoData
- zufrieden
- Möglichkeiten
- möglich
- Potenzial
- Praxis
- Praktiken
- Danach
- Presse
- Pressemitteilung
- abwehr
- privat
- PRNewswire
- Pro
- produziert
- Produkte
- Programme
- Projektionen
- fördern
- Eigentums-
- stolz
- Versorger
- Anbieter
- Bereitstellung
- Zwecke
- Angebot
- Received
- kürzlich
- Erholung
- Reform
- in Bezug auf
- eingetragen
- Regulierungsbehörden
- Rehabilitation
- Entspannung
- Release
- Voraussetzungen:
- Forschungsprojekte
- Forschung und Innovation
- Antwort
- Folge
- Die Ergebnisse
- Risiken
- safe
- Sicherheit
- Said
- Schule
- SEK
- Securities
- kompensieren
- erklären
- signifikant
- bedeutend
- Software
- Lösungen
- Süd
- spezialisiert
- spezialisieren
- Spezifität
- angegeben
- angegeben
- Aussagen
- Aussagen bzgl
- Stärke
- Fach
- Erfolg
- so
- Leiden
- Anzug
- Support
- System
- Systeme und Techniken
- Team
- technologische
- Technologies
- Technologie
- Textilien
- Das
- ihr
- Therapie
- Durch
- während
- Zeit
- zeitliche Koordinierung
- zu
- heute
- Transformieren
- behandeln
- Behandlungen
- tv
- uns
- Unsicherheiten
- Aktualisierung
- -
- Verwendung
- Anzeigen
- W
- tragbar
- ob
- welche
- während
- werden wir
- kabellos
- ohne
- arbeiten,
- Youtube
- Zephyrnet