Sofern nicht anders angegeben, wurden alle Reagenzien wie erhalten verwendet. Mit Ausnahme der Zählperlen (CountBright Absolute Counting Beads, Invitrogen) wurden alle Chemikalien von Sigma Aldrich bezogen. ζ-Potential wurde mit einem Zetasizer NanoZS90 (Malvern Instruments) gemessen. Größe und Morphologie der Partikel wurden mittels REM in einem JEOL JSM 7800F Prime-Mikroskop mit integriertem EDS untersucht, um die Elementaranalyse bereitzustellen. Die Partikelgröße wurde durch Messung von 50 unabhängigen Partikeln bestimmt. Die Radio-Instant-Dünnschichtchromatographie (ITLC) wurde auf mit Kieselsäure imprägniertem Glasmikrofaser-Chromatographiepapier von Agilent Technologies entwickelt und mit einem Lablogic Flow-Count TLC-Scanner und einem BioScan B-FC-3200 Photomultiplier Tube (PMT)-Detektor mit Laura-Software analysiert. Die mobile ITLC-Phase bestand aus 0.175 M Zitronensäure und 0.325 M Trinatriumcitrat in Wasser, sofern nicht anders angegeben. Radioaktive Proben wurden mit einem Capintec CRC-25R (Capintec) oder einem LKB Wallac 1282 Compugamma CS (PerkinElmer) gemessen, wobei die Daten mit der EdenTerm-Software gesammelt wurden. Durchflusszytometrie-Experimente wurden in einem BD FACSMelody-Zellsortierer unter Verwendung der BD FACSChorus-Software durchgeführt. PET/CT-Bilder wurden mit einem NanoPET/CT-Scanner (Mediso) aufgenommen, mit der Software Nucline v.0.21 rekonstruiert und die Bilder mit der Software VivoQuant (Version 3.5, InviCRO) analysiert. Listmode-Daten wurden mit einem speziellen MATLAB-Softwaretool erhalten, das von Mediso entwickelt wurde. Die Autoradiographie wurde in einem GE Amersham Typhoon-Gerät durchgeführt.
Synthese von Siliciumdioxidpartikeln im Submikrometerbereich
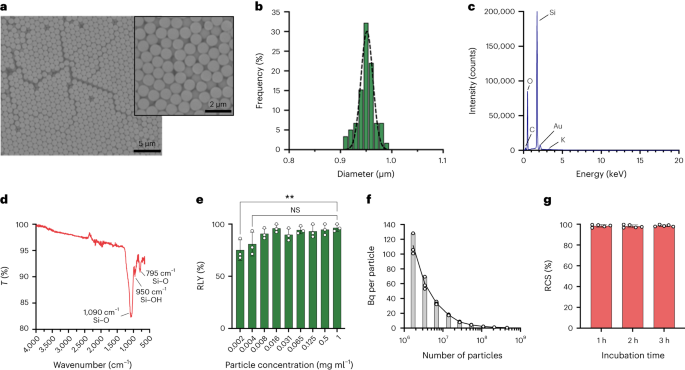
Die Partikel wurden nach der Stöber-Methode synthetisiert. Dieses Verfahren basiert auf der Hydrolyse und anschließenden Kondensation von Siliziumalkoxiden zur Herstellung monodisperser, kugelförmiger Siliziumoxidpartikel27. Als Siliziumquelle wurde Tetraethylorthosilikat (TEOS), als Basenkatalysator Ammoniak und als Elektrolyt Kaliumchlorid verwendet. Eine Lösung von TEOS in Ethanol wurde kontinuierlich zu einer Lösung hinzugefügt, die den Katalysator und den Elektrolyten enthielt. Eine Änderung der Ausgangsmenge oder Zugaberate des Reagenzes führt zu Unterschieden in der Partikelgröße, wie bereits berichtet28. Hier wurden vor der Synthese der Partikel zwei Lösungen hergestellt: Lösung 1 mit 19.0 mmol TEOS in 33.3 ml EtOH und Lösung 2 mit 0.23 mmol KCl in 9 ml Ammoniak, 65 ml EtOH und 6.75 ml H2O. Für die Synthese wurde Lösung 2 in einen 250-ml-Rundkolben gegeben, der 50 Minuten lang unter Rühren bei 300 U/min auf 15 °C erhitzt wurde. Dann wurde Lösung 1 tropfenweise zu Lösung 2 gegeben (Zufuhrrate 0.2 ml min).-1). Nach Zugabe von Lösung 1 wurden die erhaltenen Partikel durch Zentrifugation bei 18,300 gereinigtg für 3 min gewaschen und fünfmal mit EtOH gewaschen. Schließlich das SiO2 Mikropartikel wurden unter Vakuum getrocknet.
Pfropfung der submikrometergroßen Partikel mit Silan-PEG5k
Ein 20 mg ml-1 Lösung von Silan-PEG5k (Sigma Aldrich) in EtOH 98 % wurde über eine Lösung von smSiP mit 5 mg ml gegeben-1 in EtOH 98 % und 2.8 % Ammoniak. Die Mischung wurde über Nacht bei Raumtemperatur gerührt und die Partikel wurden durch Zentrifugation bei 18,300 °C gewonneng für 3 Min. Abschließend wurden die Partikel dreimal mit destilliertem Wasser gewaschen und über Nacht im Vakuum getrocknet. Die Waschlösungen wurden über Nacht gefriergetrocknet und die Menge an nicht gebundenem Silan-PEG bestimmt5k für die Berechnung der Reaktionsausbeute gewichtet. Eine 0.05 mg ml-1 Lösung von smSiP-PEG5k in destilliertem Wasser wurde für weitere radioaktive Markierungsreaktionen eingesetzt.
[68Ga]GaCl3
Gallium-68 wurde eluiert als [68Ga]GaCl3 von Eckert und Ziegler 68Ge /68Ga-Generator in hochreiner HCl (4 ml, 0.1 M), hergestellt nach den Anforderungen der guten Herstellungspraxis (ABX).
Konzentration der [68Ga]GaCl3 Elution durch Kationenaustausch
Die Konzentration der Elution erfolgte mit dem in der ergänzenden Abbildung beschriebenen Aufbau. 1. Zuerst werden die 4 ml des [68Ga]GaCl3 Die Elution wurde auf eine Strata-X-C 33u-Kartusche (Phenomenex) geladen und das Eluat verworfen. Anschließend wurde die Kartusche mit 5 ml einer Aceton/0.1 molaren HCl-Lösung (80:20) gewaschen und das Eluat verworfen. Schließlich wird die konzentrierte [68Ga]GaCl3 wurde durch Zugabe von 700 µl einer Aceton/0.05 M HCl (98:2)-Lösung gesammelt und unter N getrocknet2 fließen und in 50 µl 0.5 M HEPES-Puffer (pH 4.9) resuspendiert. Zur Qualitätskontrolle wurde in den verschiedenen Phasen eine Radio-TLC durchgeführt. Das Protokoll dauert etwa 20 Minuten und liefert eine Rückgewinnungsausbeute von 86.2 ± 8.5 %.
Radiomarkierung von Silicapartikeln in unterschiedlichen Konzentrationen mit 68Ga
Silicapartikel wurden in unterschiedlichen Konzentrationen (von 1 bis 0.002 mg ml) resuspendiert-1) in 0.5 M HEPES-Puffer (pH 4.9). Dann wurden 50 µl der Lösung in ein Reaktionsgefäß gegeben, bevor das konzentrierte [68Ga]GaCl3 Elution in 50 µl 0.5 M HEPES-Puffer (pH 4.9). Die Reaktionen wurden 90 Minuten lang bei 30 °C durchgeführt und zur Berechnung der radiochemischen Ausbeute wurde eine Radio-TLC durchgeführt.
Messung der Partikelkonzentration mittels Durchflusszytometrie
Die Partikelkonzentrationen wurden durch Durchflusszytometrie unter Verwendung von Zählperlen (CountBright Absolute Counting Beads, Invitrogen) gemäß den Anweisungen des Herstellers berechnet. Silicapartikel wurden bei 0.05 mg ml resuspendiert-1, 10 Minuten lang beschallt und durch einen 10 µm-Grenzfilter (KX-Spritzenfilter, Nylon, 25 mm, 10 µm) geleitet. Die CountBright Absolute Counting Beads wurden auf Raumtemperatur erwärmt und 30 Sekunden lang gevortext. Dann wurden 50 µl Perlen zu 300 µl Silicapartikeln gegeben und die Mischung 30 Minuten lang verwirbelt, um eine homogene Lösung zu erhalten. Die Probe wurde auf dem Durchflusszytometer untersucht und der Schwellenwert für die Vorwärtsstreuung (FSC) wurde so eingestellt, dass die Kügelchen und Partikel im linearen FSC-Diagramm im Vergleich zur linearen seitlichen Streuung berücksichtigt wurden. Anschließend wurde die Spannung des Fluoreszenzdetektors für die Zählkügelchen angepasst und eine Gating-Strategie durchgeführt, um die Siliciumdioxidpartikel und die Zählkügelchenpopulationen zu isolieren. Schließlich wurden Gates auf den Partikeln und die absoluten Zählperlen gezeichnet und 1,000 Perlenereignisse für jede Probe aufgezeichnet. Mit dieser Strategie wurde die Anzahl der gelösten Partikel anhand der folgenden Gleichung berechnet:
$$begin{array}{l}displaystyle{mathrm{Absolute}},{mathrm{count}},left(frac{mathrm{Particles}}{{{upmu l}}}right)=displaystylefrac{({mathrm{ Partikel}},{mathrm{count}},times,{mathrm{Counting}},{mathrm{beads}},{mathrm{volume}})}{({mathrm{Counting}},{mathrm{beads}} ,{mathrm{count}},times,{mathrm{Particles}},{mathrm{volume}})} times,{mathrm{Counting}},{mathrm{beads}},{mathrm{concentration}}left(frac {{mathrm{Beads}}}{{{upmu l}}}right)end{array}$$
Radiomarkierung von 500 smSiP
Fünfhundert smSiP wurden zu 50 µl der konzentrierten [68Ga]GaCl3 Elution in 0.5 M HEPES-Puffer pH 4.9. Dann wurden 5.6 µl Polysorbat 80 zugegeben und die Mischung 90 Minuten lang bei 30 U/min in einem Thermomischer auf 900 °C erhitzt. Anschließend wurde ein abschließendes mehrstufiges Reinigungsprotokoll entwickelt, um nicht umgesetztes/kolloidales Material zu entfernen 68Ga. Fünfzig Mikroliter 10 mM EDTA wurden zugegeben und die Mischung 5 Minuten lang bei Raumtemperatur inkubiert. Anschließend wurden die Partikel 3 Minuten lang bei 18,300 zentrifugiertg, resuspendiert in 500 µl PBS mit 1 mM EDTA + 0.1 % Polysorbat 80 und vorsichtig 10 Sekunden lang gevortext. Die Partikel wurden erneut zentrifugiert, mit einer Lösung aus 0.1 mM EDTA + 0.1 % Polysorbat 80 in PBS gewaschen und 10 Sekunden lang sanft gevortext. Abschließend wurden die Partikel zentrifugiert und fünf weitere Male mit PBS + 0.1 % Polysorbat 80 gewaschen und in 500 µl PBS resuspendiert. Die radioaktive Markierungsreaktion wurde während der aufeinanderfolgenden Reaktionsschritte mittels Radio-TLC überwacht, um das Vorhandensein von Kolloiden (die bei nicht ordnungsgemäßer Entfernung mit Partikeln verwechselt werden können), die radioaktive Markierung der Partikel und die Reinheit des Endprodukts zu bewerten. RLY wurde durch Vergleich zwischen der Menge an Radioaktivität in den Partikeln und den Überständen nach den Waschschritten berechnet.
Fraktionierung
Für die Fraktionierungsstrategie sind Volumina von 0.5 µl bis 20 µl erforderlich 68Ga-smSiP bei einer theoretischen Konzentration von 1 Partikel µl-1 wurden in 1 µl-Schritten (0.5, 1, 2, 3…) in verschiedene Probenröhrchen gegeben und PBS wurde hinzugefügt, um das Endvolumen auf 50 µl zu bringen. Anschließend wurden 37.5 µl aus dem ersten Röhrchen in ein zweites Probenröhrchen, 25 µl des zweiten Röhrchens in ein drittes Röhrchen und schließlich 12.5 µl des dritten Röhrchens in ein viertes Röhrchen pipettiert. Diese Strategie liefert vier Röhrchen pro Probe mit einem Endvolumen von 12.5 µl pro Röhrchen. Die Radioaktivität in jedem Röhrchen wurde in einem Gammazähler gemessen und die Werte zum weiteren Vergleich und zur Analyse mithilfe einer Kalibrierungskurve in kBq berechnet. Die Proben, die den größten Teil der Radioaktivität in nur einem Röhrchen enthielten, wurden 30 Sekunden lang bei Raumtemperatur beschallt und einem zweiten Fraktionierungsschritt unterzogen. Anschließend wurden die Proben, in denen die gesamte Radioaktivität in einem einzigen Röhrchen gefunden wurde (mit vernachlässigbarer Aktivität in den anderen drei Röhrchen), für weitere In-vivo-/Ex-vivo-Experimente verwendet.
PET/CT-Phantombildgebung
Mit einem wurde ein Phantombildexperiment durchgeführt 68Ga-smSiP. Mithilfe einer Kanüle wurde das Partikel in ein Probenröhrchen abgegeben, um zu beurteilen, ob ein einzelnes Partikel während der Verabreichung im Kanülenschlauch eingeschlossen bleiben konnte. Kurz gesagt wurde das Phantomrohr in den nanoPET/CT-Scanner eingesetzt, wobei das Ende der Kanülenspitze am Rohr befestigt war. Nach Beginn der PET-Aufnahme wurde das in 100 µl PBS resuspendierte Partikel mit einer am Anfang der Kanüle angebrachten Insulinspritze abgegeben. Anschließend wurde die Kanüle mit 50 µl PBS gewaschen, um die Abgabe des Partikels in das Phantomrohr sicherzustellen. Die PET-Aufnahme wurde 2 Stunden lang durchgeführt, gefolgt von einem Standard-CT-Scan.
In-vivo-PET/CT-Bildgebung
Bildgebende Untersuchungen an Tieren wurden ethisch geprüft und in Übereinstimmung mit den Vorschriften des britischen Innenministeriums für Tierversuche des Animals (Scientific Procedures) Act 1986 (ASPA) durchgeführt. Die In-vivo-Bildgebung wurde an gesunden 8 Wochen alten BALB/c-Mäusen durchgeführt. Die Tiere wurden mit Isofluran (2–3 % in Sauerstoff) anästhesiert, mit einer Kanüle versehen und unter Narkose auf das Scannerbett gelegt. Das Bett wurde durch einen internen Luftstrom auf 37 °C erhitzt, um das Tier auf normaler Körpertemperatur zu halten, und die Atemfrequenz wurde überwacht und bei 60–80 Atemzügen pro Minute gehalten-1 während des gesamten Scans. Es ist wichtig, die Temperatur des Tieres unter Kontrolle zu halten, da ein unerwarteter Temperaturabfall zu einer Verringerung der Geschwindigkeit der Partikel im Blut führen könnte. Eins 68Ga-smSiP (n = 4) oder 68Ga-smSiP–PEG5k Partikel (n = 2) wurde durch die Kanüle in 100 µl PBS verabreicht, gefolgt von einem Waschen mit 50 µl PBS nach Beginn der PET-Erfassung (1:5-Koinzidenzmodus; 5 ns-Koinzidenzzeitfenster). Die PET wurde 2 Stunden lang aufgezeichnet und anschließend wurde ein halbkreisförmiger CT-Scan durchgeführt. Während des gesamten Prozesses wurden die Körpertemperatur und die Atemfrequenz der Tiere überwacht. Dynamische PET/CT-Bilder wurden mithilfe der Tera-Tomo-3D-Rekonstruktion (400–600 keV-Energiefenster, 1:5-Koinzidenzmodus, 20 Iterationen und 1 Teilmenge) bei einer Voxelgröße von 0.4 × 0.4 × 0.4 mm rekonstruiert3 und hinsichtlich Dämpfung, Streuung und Abfall korrigiert. Im Listenmodus können Daten für alle PET/PEPT-Erfassungen gefunden werden 68Ga-smSiP bei Ref. 29 und für 68Ga-smSiP–PEG5k unter Ref. 30.
Echtzeit-Verfolgung
Zunächst wurden die Daten vom Scanner im Listmode-Format exportiert (also einem Format mit Zeitstempel und Kristallindex für erkannte Koinzidenzphotonen). Eine geometrische Transformation wurde angewendet, um die Kristallindizes in die Position in mm-Einheiten umzuwandeln. Die Birmingham-Methode berechnet den MDP iterativ aus einer Teilmenge aller LoRs. Dies geschieht durch das Verwerfen von LoRs, die weiter als eine festgelegte Entfernung vom MDP entfernt sind, da diese wahrscheinlich von falschen LoRs herrühren, beispielsweise von LoRs, die aus Streuung stammen könnten. Das MDP wird mit jeder Iteration verfeinert; Die Anzahl der Iterationen wird effektiv durch festgelegt f-Faktor und bezieht sich auf die Gesamtzahl der LoRs, die zur Schätzung der endgültigen Partikelposition innerhalb dieser Teilmenge verwendet werden (z. B. ein f-Faktor von 0.5 bedeutet, dass die Iterationsschleife beendet wird, wenn 50 % der LoRs in der Teilmenge übrig bleiben. Die Anzahl der in einer Teilmenge verwendeten LoRs kann reduziert werden, um die zeitliche Abtastung zu verbessern (die Teilmengen sind zeitlich aufeinanderfolgend und ohne Überlappung), auf Kosten einer Erhöhung der Positionsunsicherheit (weitere Einzelheiten des Algorithmus finden Sie bei Parker et al.5) Zur Analyse der Listenmodusdaten des PET-Scanners wurde die Birmingham-Methode verwendet. Eine adaptive Probengröße wurde verwendet, um die Partikel in den Mäusen zu verfolgen. Die Stichprobengröße wurde so festgelegt, dass ein Gleichgewicht zwischen ausreichender zeitlicher Abtastung und Minimierung von Positionierungsfehlern erreicht wird. In den frühen Stadien der Scans (<100 Sekunden ab Scan-Start) wurde eine Stichprobengröße zwischen 200 und 60 LoRs verwendet f = 0.1, was ungefähr 1–5 s-Intervalle ergibt. Bei Scanzeiten > 60 s wurden die Probengrößen zwischen 1,000 und 2,000 variiert, was je nach In-vivo-Experiment Zeitintervalle zwischen 30 s und 60 s ergab. Die Anzahl der Zählungen, die zur Berechnung des MDP (in der letzten Iteration) verwendet werden, kann durch Multiplikation der Stichprobengröße mit ermittelt werden f-Faktorwert. Diese Parameter basierten auf früheren Erfahrungen und stützten sich auf frühere Veröffentlichungen1.
Geschwindigkeit wurde erhalten als (sqrt{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) woher ({v}_{m}^{2}) ist die Geschwindigkeit in der x, y machen z Richtungen.
Ex-vivo-Organaufnahme
Die Aufnahme in verschiedene Organe wurde durch Gammazählung bewertet. Nach der In-vivo-PET/CT-Bildgebung wurden die Tiere durch Zervixluxation getötet und die Organe entnommen und zur Messung der Radioaktivität in einem Gammazähler (LKB Wallac 1282 Compugamma CS) gewogen. Die Daten wurden als Prozentsatz der injizierten Dosis (Dosis im Organ/injizierte Gesamtdosis) pro Gramm Gewebe (%ID g) ausgedrückt-1).
Autoradiographie
Die Radioaktivität in der Lunge wurde mit einem Strahlungsdetektor (EP15-Sonde, Morgan) verfolgt und die Lunge mit einem Skalpell in kleine Abschnitte geschnitten, bis ein kleiner Teil des Gewebes mit dem radioaktiven Signal erhalten wurde. Das Gewebe wurde in Isopropanol bei −80 °C schockgefroren. Unmittelbar nach dem Einfrieren wurde das Gewebe in ein Medium mit optimaler Schneidtemperatur eingebettet und in einem Kryostaten in 20-µm-Scheiben geschnitten. Jede Schicht wurde mit dem Detektor untersucht, bis die radioaktive Schicht gefunden wurde. Die vorherige (unter dem Hintergrund), die radioaktive und die nächste (unter dem Hintergrund) Schicht wurden auf einen Superfrost-Objektträger (Epredia) gelegt. Der Rest des verbleibenden Gewebes lag ebenfalls unter dem Hintergrund. Der Objektträger mit den drei Abschnitten wurde mit Frischhaltefolie abgedeckt und über Nacht auf eine GE-Autoradiographieplatte gelegt. Die Platte wurde mit GE Amersham Typhoon mit einer Auflösung von 25 µm und einer PMT-Einstellung von 4,000 analysiert. Das Autoradiographiebild wurde dem Bild des Gewebes überlagert und zeigte einen radioaktiven Punkt in der radioaktiven Schicht. Zur Quantifizierung wurden Standards in verschiedenen bekannten Verfahren hergestellt und jeweils als 1 µl-Quintett auf Papier aufgetragen. Die Spots wurden in demselben Speicherleuchtstoffschirm, BAS-IP MS (Multipurpose Standard) von GE, inkubiert, in dem auch die einzelnen Partikel quantifiziert wurden. Das Bild wurde mit dem Amersham Typhoon 5 mit der Control Software Version 2.0 im Phosphormodus mit einer Pixelgröße von 100 µm und einer Empfindlichkeit von 4,000 aufgenommen. Die Bilder wurden mit der Software ImageQantTL v10.0-261 unter Verwendung der Gel Quantification Toolbox quantifiziert. Die Flecken wurden korrigiert, indem eine Region unmittelbar vor oder nach dem Fleck als konstanter Hintergrund ausgewählt wurde. Das resultierende Volumen des Spots wurde zur Berechnung des Bq im Partikel auf Basis der Kalibrierungskurve verwendet.
Statistik und Reproduzierbarkeit
Für die quantitative Analyse wurden mindestens drei biologische Replikate analysiert, unter Ausschluss der In-vivo-Daten von 68Ga-smSiP–PEG5k (n = 2). Die Daten wurden mittels gewöhnlicher einseitiger Varianzanalyse (ANOVA) mit dem Mehrfachvergleichstest von Dunnett und dem Test von Student analysiert t-Prüfung. EIN P Ein Wert <0.05 wurde als statistisch signifikant angesehen.
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- Quelle: https://www.nature.com/articles/s41565-023-01589-8
- :Ist
- :nicht
- :Wo
- ][P
- 000
- 1
- 10
- 100
- 12
- 15%
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- Absolute
- Übereinstimmung
- Erreichen
- erworben
- Erwerb
- Akquisitionen
- Handlung
- Aktivitäten
- Aktivität
- adaptiv
- hinzugefügt
- Hinzufügen
- Zusatz
- Bereinigt
- verabreicht
- Verwaltung
- Vorschüsse
- Nach der
- danach
- aufs Neue
- LUFT
- AL
- Algorithmus
- Alle
- ebenfalls
- Ammoniak
- Betrag
- an
- analysieren
- Analyse
- Moderator
- machen
- Tier
- Tiere
- angewandt
- ca.
- SIND
- entstehen
- AS
- At
- b
- Hintergrund
- Balance
- Base
- basierend
- Grundlage
- BD
- BE
- Bevor
- Anfang
- unten
- zwischen
- Birmingham
- Blut
- Körper
- kurz
- bringen
- puffern
- by
- Berechnen
- berechnet
- berechnet
- Berechnung
- CAN
- durchgeführt
- Katalysator
- Zelle
- Chemikalien
- Auswahl
- klicken Sie auf
- Zufall
- Vergleich
- Vergleiche
- zusammengesetzt
- Konzentriert
- Konzentration
- durchgeführt
- verwirrt
- aufeinanderfolgenden
- betrachtet
- konstante
- ständig
- Smartgeräte App
- gesteuert
- verkaufen
- korrigiert
- Kosten
- könnte
- Counter
- Zählen
- bedeckt
- Kristall
- cs
- Kurve
- Schneiden
- Schneiden
- technische Daten
- Übergeben
- geliefert
- Lieferanten
- Abhängig
- beschrieben
- entworfen
- Details
- erkannt
- entschlossen
- entwickelt
- Unterschiede
- anders
- Richtungen
- Luxation
- Abstand
- die
- empfohlen
- gezogen
- Drop
- im
- dynamisch
- e
- E & T
- jeder
- Früh
- effektiv
- Elektrolyt
- eingebettet
- Emission
- beschäftigt
- Ende
- Energie
- Entwicklung
- gewährleisten
- Ausrüstung
- Fehler
- schätzen
- Äther (ETH)
- bewerten
- Bewerten
- Veranstaltungen
- Beispiel
- Außer
- ohne
- ERFAHRUNGEN
- Experiment
- Experimente
- zum Ausdruck gebracht
- falsch
- Feige
- Filme
- Filter
- Finale
- Endlich
- Vorname
- fünf
- Fluss
- gefolgt
- Folgende
- Aussichten für
- Format
- vorwärts
- gefunden
- vier
- Vierte
- Einfrieren
- für
- eingefroren
- FSC
- weiter
- Gates
- ge
- Generator
- Glas
- gut
- regieren
- Gramm
- Wachstum
- gesund
- hier
- Startseite
- Home Office
- HTTPS
- if
- Image
- Bilder
- Imaging
- sofort
- wichtig
- zu unterstützen,
- in
- das
- zunehmend
- inkubiert
- unabhängig
- Index
- Indizes
- informiert
- sofortig
- Anleitung
- Instrument
- Instrumente
- integriert
- Schnittstelle
- intern
- in
- IT
- Iteration
- Iterationen
- Behalten
- bekannt
- Kx
- führen
- wahrscheinlich
- LINK
- Lunge
- Aufrechterhaltung
- hergestellt
- Herstellung
- Ihres Materials
- Kann..
- Mittel
- gemessen
- Messen
- mittlere
- Methode
- Methoden
- Mäuse
- Mikron
- Mikroskop
- Min.
- minimieren
- Minimum
- Mischung
- Mischung
- ML
- Mobil
- Model
- überwacht
- mehr
- Morgan
- vor allem warme
- MS
- mehrere
- Multiplizieren
- Nanotechnologie
- Natur
- weiter
- nicht
- normal
- Anzahl
- erhalten
- erhalten
- of
- Office
- on
- EINEM
- einzige
- entgegengesetzt
- optimal
- or
- gewöhnlich
- Andere
- Andernfalls
- übrig
- über Nacht
- Sauerstoff
- Papier
- Parameter
- Teilchen
- Bestanden
- PBS
- für
- Prozentsatz
- durchgeführt
- pet
- Phantom
- Phase
- Photonen
- ein Bild
- Pixel
- platziert
- Plato
- Datenintelligenz von Plato
- PlatoData
- Populationen
- Teil
- Position
- Positionierung
- Positron
- Praxis
- bereit
- Präsenz
- früher
- vorher
- Prime
- Vor
- Sonde
- Verfahren
- Prozessdefinierung
- produziert
- Produkt
- richtig
- Protokoll
- die
- bietet
- Bereitstellung
- gekauft
- Qualität
- Quantifizierung
- quantitativ
- Menge
- R
- Strahlung
- Radio
- Angebot
- Bewerten
- Reaktion
- Reaktionen
- Echtzeit
- Received
- kürzlich
- aufgezeichnet
- Erholung
- Reduziert
- Reduktion
- Referenz
- raffiniert
- Region
- Vorschriften
- bezieht
- bleiben
- verbleibenden
- entfernen
- Entfernt
- repliziert
- Voraussetzungen:
- Auflösung
- REST
- was zu
- Überprüfen
- bewertet
- Zimmer
- Führen Sie
- s
- gleich
- Scan
- Scannen
- scannt
- SCI
- wissenschaftlich
- Bildschirm
- Zweite
- Sekunden
- Abschnitte
- SEM
- Sensitivität
- kompensieren
- Einstellung
- Setup
- zeigt
- Sigma
- Signal
- signifikant
- Silizium
- Single
- Größe
- Größen
- Slice
- Schlitten
- klein
- Schnappen
- Software
- Lösung
- Lösungen
- Quelle
- spezifisch
- Spot
- Flecken
- Stufen
- Standard
- Normen
- Anfang
- Beginnen Sie
- angegeben
- statistisch
- Schritt
- Shritte
- Lagerung
- Strategie
- Strom
- sucht
- Es wurden Studien
- Studieren
- ausreichend
- liefern
- befragten
- Synthese
- nimmt
- Technik
- Technologies
- Test
- als
- zur Verbesserung der Gesundheitsgerechtigkeit
- Das
- dann
- theoretisch
- Thermal-
- Diese
- Dritte
- fehlen uns die Worte.
- nach drei
- Schwelle
- Durch
- während
- Zeit
- mal
- Zeitstempel
- Tip
- Tissues
- zu
- Werkzeug
- Tools
- Gesamt
- verfolgen sind
- Tracking
- Transformation
- eingeschlossen
- XNUMX
- Uk
- Unsicherheit
- für
- Unerwartet
- Bereiche
- bis
- benutzt
- Verwendung von
- Vakuum
- Wert
- Werte
- Geschwindigkeit
- Version
- Gegen
- vivo
- Stromspannung
- Volumen
- Volumen
- Voxel
- W
- wurde
- Waschen
- Wasser
- waren
- wann
- ob
- welche
- während
- ganze
- werden wir
- Fenster
- mit
- .
- Ausbeute
- ergab
- nachgiebig
- Zephyrnet
- PLZ