Die Behandlung von Krebs mit Strahlung kann die Immunantwort des Körpers stimulieren und das Tumorwachstum hemmen, kann aber auch die Menge an Lymphozyten, den weißen Blutkörperchen, die mit der Immunantwort in Verbindung stehen, verringern, was zu einer beeinträchtigten Tumorkontrolle und einer schlechten Prognose führt. Der Schweregrad dieser strahleninduzierten Lymphopenie korreliert mit der Dosis, die an zirkulierende Blutzellen und Lymphozyten abgegeben wird. Daher könnte eine Minimierung der Dosis auf das Herz, das periphere Blut und die Lymphorgane dazu beitragen, diese schädliche Wirkung zu verringern.
Um diese Theorie weiter zu untersuchen, haben Antje Galts und Abdelkhalek Hammi von der TU Dortmund untersuchten, ob FLASH-Strahlentherapie – Strahlung mit ultrahohen Dosisraten – den Grad der Immunzellschwächung während der Protonentherapie von Hirntumorpatienten reduzieren kann.
„Der biologische Mechanismus hinter dem beobachteten FLASH-schonenden Effekt bei hohen Dosisraten ist noch nicht vollständig verstanden. Eine der vorgeschlagenen Theorien ist jedoch die Immunhypothese, die darauf hindeutet, dass die sofortige Dosisabgabe der FLASH-Bestrahlung die Erschöpfung zirkulierender Lymphozyten durch Minimierung der Expositionszeit deutlich reduziert“, erklärt Hammi. „In unserer Studie haben wir gezeigt, dass eine hypofraktionierte Behandlung und eine schnelle Dosisverabreichung Immunzellen im Vergleich zu einem herkömmlichen fraktionierten Protonen-Bleistiftstrahl-Scanning-Behandlungsplan um das bis zu 27-fache verschont.“
Galts und Hammi benutzten a Dosimetrisches Blutflussmodell um die Dosis auf zirkulierende Lymphozyten während der konventionellen und FLASH-basierten intensitätsmodulierten Protonentherapie (IMPT) eines Hirntumors zu simulieren. Das dynamische Strahlabgabemodell simuliert einen IMPT-fraktionierten Behandlungsplan und berücksichtigt dabei die räumlich-zeitliche Variation der Dosisleistung jedes einzelnen Protonenstiftstrahls. Hammi weist darauf hin, dass das Modell realistische Förderparameter von kommerziell erhältlichen Zyklotronen berücksichtigt.
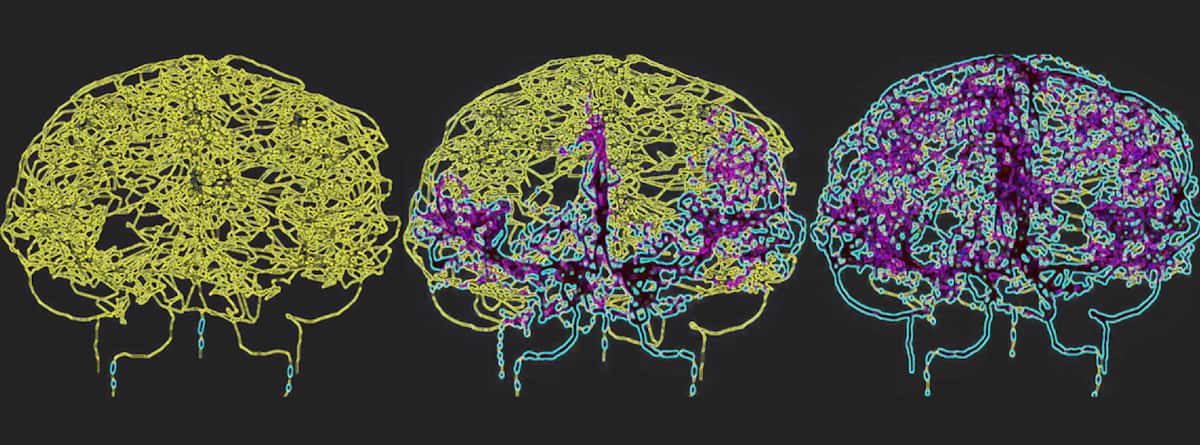
Um die Blutzirkulation im menschlichen Gehirn genau wiederzugeben, kartierten Galts und Hammi die Blutgefäße direkt aus MR-Angiographiebildern des Gehirns. Sie nutzten das resultierende zerebrovaskuläre Modell, das 465 Blutgefäße und 8841 einzelne Gefäßzweige umfasste, um die Zirkulation von Immunzellen im Blutkreislauf zu simulieren.
Die Forscher erstellten realistische IMPT-Behandlungspläne für einen Glioblastomtumor unter Verwendung von vier einfallenden Protonenstrahlen und klinisch relevanten Abgabeparametern. Anschließend berechneten sie die zeitlich variierenden Strahlungsfelder, denen das zirkulierende Blut während der Verabreichung der Protonentherapiepläne ausgesetzt ist, sowie die akkumulierte Dosis nach der Behandlung und berichteten über ihre Ergebnisse in Physik in Medizin & Biologie.
Das Glioblastom ist die tödlichste Form von Hirntumor und die Behandlung mit Strahlentherapie kann zu einer anhaltenden strahleninduzierten Lymphopenie führen. „Durch die Modellierung eines zerebrovaskulären Systems während der Bestrahlung hoffen wir, tiefere Erkenntnisse darüber zu gewinnen, wie sich die Strahlentherapie auf die Immunantwort dieser Patientengruppen auswirkt, was möglicherweise zu verbesserten Therapiestrategien führt“, sagt Hammi.
Planvergleiche
Galts und Hammi untersuchten vier Behandlungsszenarien: IMPT FLASH mit einer einzelnen 22.3 Gy-Fraktion; hypofraktioniertes FLASH mit zwei 14.6 Gy- und fünf 8 Gy-Fraktionen; und konventionelle IMPT unter Verwendung von zweiunddreißig 2-Gy-Fraktionen. Für jeden Behandlungsplan bewerteten sie die dosimetrische Auswirkung auf die zirkulierenden Lymphozyten und schätzten die daraus resultierende Radiotoxizität.
Dosis-Volumen-Histogramme zeigten, dass die FLASH-Strahlentherapie den Anteil der bestrahlten Zellen im Vergleich zur herkömmlichen IMPT mit Dosisleistung deutlich reduzierte. Während der ersten Behandlungsfraktion bestrahlten alle drei FLASH-Systeme etwa 1.52 % des zirkulierenden Blutvolumens, während die konventionelle IMPT 2.18 % bestrahlte. Hypofraktionierte FLASH-Pläne, die über zwei oder fünf Fraktionen verabreicht wurden, erhöhten dieses bestrahlte Volumen auf 3.01 % bzw. 7.35 %, während herkömmliche IMPT 42.41 % des peripheren Blutes der Strahlung aussetzte.
Als nächstes untersuchten die Forscher die Menge an zirkulierenden Lymphozyten, die während der gesamten Behandlung eine Dosis von mindestens 7 cGy erhielten – ein Schwellenwert, der zu einem Rückgang der Lymphozytenpopulation um 2 % führt. Nach Abschluss der konventionellen IMPT erhielten 25.65 % der zirkulierenden Lymphozyten eine Dosis von mindestens 7 cGy. Bei Einzel-, Zwei- und Fünf-Fraktions-FLASH-Behandlungen betrugen die Volumina, die mehr als diesen Dosisschwellenwert erhielten, 1.21 %, 2.30 % bzw. 5.14 %.
Die Volumina zirkulierender Lymphozyten, die Dosen von mehr als 100 cGy erhielten, was zu einer Depletion von 30 % führt, betrugen 0.77 %, 1.28 % bzw. 2.09 % für FLASH mit einer, zwei bzw. fünf Fraktionen und 0.10 % während der konventionellen IMPT.
Galts und Hammi untersuchten auch die Reaktion von CD4+- und CD8+-Lymphozyten, die im peripheren Blut unterschiedlich verteilt sind, auf die verschiedenen Bestrahlungsszenarien. Für beide Lymphozytentypen betrug die Zelltötung nach der ersten Fraktion 0.66 %, 0.62 %, 0.32 % bzw. 0.08 % für Einzel-, Zwei- und Fünf-Fraktion-FLASH bzw. konventionelles IMPT.
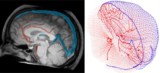
Computermodell bestimmt die Blutdosis während der Strahlentherapie
Nach der vollständigen Behandlung betrug die Depletion der Lymphozyten 1.02 % bzw. 1.56 % für die Fraktionen mit zwei bzw. fünf Behandlungen und 2.14 % für die konventionelle IMPT. Diese Ergebnisse zeigen, dass die FLASH-Protonentherapie zirkulierende Immunzellen während der intrakraniellen Behandlung schont, wobei einzelne FLASH-Fraktionen die Depletionsrate im Vergleich zur herkömmlichen IMPT um fast 70 % reduzieren.
Hammi erzählt Physik-Welt dass sie das Modell nun auf Kopf-Hals-Tumoren erweitern. „Darüber hinaus erforschen wir verschiedene FLASH-Verabreichungsmethoden und ihre Auswirkungen auf die Schwächung des Immunsystems, mit besonderem Schwerpunkt auf der konformen FLASH-Behandlung, die auf passiver, patientenspezifischer Energiemodulation basiert“, erklärt er. „Dieses Verabreichungsmodell hat das Potenzial, im Vergleich zur Shoot-through-FLASH-Verabreichung mehr zirkulierende Lymphozyten zu schonen.“
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoData.Network Vertikale generative KI. Motiviere dich selbst. Hier zugreifen.
- PlatoAiStream. Web3-Intelligenz. Wissen verstärkt. Hier zugreifen.
- PlatoESG. Kohlenstoff, CleanTech, Energie, Umwelt, Solar, Abfallwirtschaft. Hier zugreifen.
- PlatoHealth. Informationen zu Biotechnologie und klinischen Studien. Hier zugreifen.
- Quelle: https://physicsworld.com/a/flash-irradiation-spares-immune-cells-during-proton-therapy/
- :hast
- :Ist
- :nicht
- $UP
- 1
- 10
- 100
- 14
- 160
- 2%
- 22
- 25
- 27
- 35%
- 7
- 73
- 8
- a
- Angesammelt
- genau
- Nach der
- Alle
- fast
- ebenfalls
- an
- machen
- SIND
- um
- AS
- bewertet
- damit verbundenen
- At
- verfügbar
- basierend
- Strahl
- hinter
- Blut
- Blutgefäße
- beide
- Gehirn
- Hirntumor
- Geäst
- aber
- by
- berechnet
- CAN
- Krebs
- Krebspatienten
- Krebserkrankungen
- Verursachen
- Ursachen
- Zelle
- Die Zellen
- zirkulierende
- Die Durchblutung
- klicken Sie auf
- klinisch
- kommerziell
- verglichen
- Abschluss
- Berücksichtigung
- Smartgeräte App
- konventionellen
- könnte
- erstellt
- tiefer
- geliefert
- Lieferanten
- Lieferungsmethoden
- zeigen
- entschlossen
- nachteilig
- anders
- Direkt
- Verteilung
- Ausschüttungen
- empfohlen
- Dosen
- im
- dynamisch
- jeder
- bewirken
- Energie
- Ganz
- gleich
- Gleichgewicht
- geschätzt
- Äther (ETH)
- Ausbau
- Erklärt
- Erkundet
- Möglichkeiten sondieren
- ausgesetzt
- Belichtung
- FAST
- Felder
- Befund
- Vorname
- fünf
- Blinken (Flash)
- Fluss
- Setzen Sie mit Achtsamkeit
- Folgende
- Aussichten für
- unten stehende Formular
- vier
- Fraktion
- für
- voller
- voll
- weiter
- Gewinnen
- Gruppen
- Wachstum
- Haben
- he
- Herz
- Hilfe
- GUTE
- ein Geschenk
- Ultraschall
- aber
- HTTPS
- human
- Image
- Bilder
- die Gesundheit
- Immunsystem
- Impact der HXNUMXO Observatorien
- verbessert
- MWST
- in
- Zwischenfall
- das
- inklusive
- beinhaltet
- hat
- Krankengymnastik
- Information
- Einblicke
- in
- untersuchen
- Problem
- IT
- jpg
- Töten
- führenden
- am wenigsten
- links
- Niveau
- länger
- max-width
- Mechanismus
- Medizin
- Methoden
- minimieren
- Modell
- Modellieren
- Modellieren
- mehr
- vor allem warme
- mr
- Notizen
- jetzt an
- beobachtet
- of
- on
- EINEM
- XNUMXh geöffnet
- or
- UNSERE
- übrig
- Parameter
- besondere
- Passiv
- Patienten
- peripher
- Physik
- Physik-Welt
- Plan
- Pläne
- Plato
- Datenintelligenz von Plato
- PlatoData
- Arm
- Bevölkerung
- Potenzial
- möglicherweise
- Fortpflanzung
- Anteil
- vorgeschlage
- Strahlung
- Strahlentherapie
- Bewerten
- Honorar
- realistisch
- Received
- Empfang
- Veteran
- Reduziert
- reduziert
- Reduzierung
- reflektieren
- relevant
- Reporting
- Forscher
- beziehungsweise
- Antwort
- was zu
- Revealed
- Recht
- s
- sagt
- Scannen
- Szenarien
- Regelungen
- Schwere
- zeigte
- bedeutend
- Single
- Anfang
- stimulieren
- Strategien
- Strom
- sucht
- Studie
- so
- Schlägt vor
- System
- erzählt
- als
- zur Verbesserung der Gesundheitsgerechtigkeit
- Das
- ihr
- dann
- Theorie
- Therapeutisch
- Therapie
- Diese
- vom Nutzer definierten
- fehlen uns die Worte.
- nach drei
- Schwelle
- Durch
- Daumennagel
- Zeit
- mal
- zu
- Bearbeitung
- Behandlungen
- Behandlungen
- was immer dies auch sein sollte.
- Tumor
- XNUMX
- Typen
- verstanden
- Universität
- benutzt
- Verwendung von
- verschiedene
- Gefäße
- Schiffe
- Volumen
- Volumen
- wurde
- we
- waren
- wann
- ob
- welche
- während
- Weiß
- mit
- .
- weltweit wie ausgehandelt und gekauft ausgeführt wird.
- gelben
- noch
- Zephyrnet