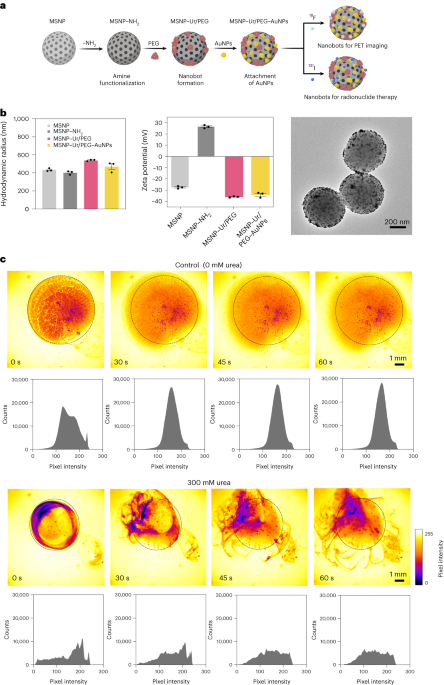
Nanobot syntese
Nanobots blev fremstillet som tidligere beskrevet33. Kort sagt blev MSNP'er syntetiseret ved hjælp af en modificeret Stöber-metode41, omsætning af triethanolamin (35 g), ultrarent vand (20 ml) og hexadecyltrimethylammoniumbromid (CTAB; 570 mg) ved 95 °C i 30 min under omrøring. Tetraethylorthosilicat (1.5 ml) blev efterfølgende tilsat dråbevis; blandingen fik lov til at reagere i 2 timer ved 95°C, og de resulterende MSNP'er blev opsamlet ved centrifugering og vasket i ethanol (tre gange, 2,500g5 min). For at fjerne CTAB-skabelonen blev MSNP'er anbragt under tilbagesvaling i sur methanol (1.8 ml HCl, 30 ml methanol) i 24 timer. Derefter blev MSNP'er opsamlet ved centrifugering og vasket tre gange i ethanol (2,500g, 5 min) før inkorporering af aminmodifikation ved at tilføje APTES (6 µl pr. mg MSNP) til MSNP'er (1 mg ml-1) i en 70% ethanolisk opløsning ved 70°C under kraftig omrøring i 1 time. MSNP'er-NH2 blev opsamlet og vasket tre gange i ethanol og tre gange i vand ved centrifugering (tre gange, 1,150g5 min). MSNP'er-NH2 blev resuspenderet i PBS i en koncentration på 1 mg ml-1 og totalvolumen på 900 µl og aktiveret med glutaraldehyd (100 µl) i 2.5 t ved stuetemperatur. De aktiverede MSNP'er-NH2 blev opsamlet og vasket i PBS tre gange ved centrifugering (1,150g, 5 min), resuspenderet i en opløsning af urease (3 mg ml-1) og heterobifunktionel PEG (1 μg PEG pr. mg 5 kDa HS-MSNPs-NH2) i PBS og omsatte i 24 timer ved stuetemperatur. De resulterende nanobots blev derefter opsamlet og vasket tre gange i PBS ved centrifugering (1,150g, 5 min) før de resuspenderes i en dispersion af AuNP'er, fremstillet som tidligere beskrevet51lader dem reagere i 10 min og vaskes grundigt ved centrifugering (tre gange, 1,150g5 min).
Hydrodynamisk størrelsesfordeling og overfladeladning af MSNP'erne, MSNP'er-NH2, blev nanobots og AuNP-dekorerede nanobots bestemt ved hjælp af henholdsvis et Wyatt Mobius dynamisk lysspredningssystem og en Malvern Zetasizer. I alle tilfælde var koncentrationen 20 µg ml-1 og optagelsestid 5 s, ved brug af tre kørsler pr. eksperiment. Der blev udført tre målinger pr. partikeltype.
Syntese af FITC MSNP'er
En blanding af FITC (2 mg), ethanol (5 ml) og APTES (400 µl) blev fremstillet og omrørt i 30 min. Derefter blev den tidligere beskrevne protokol for MSNP-syntese fulgt, bortset fra at vi tilsatte tetraethylorthosilicat (1.25 ml) dråbevis i kombination med FITC-APTES-blandingen (250 µl). Funktionaliseringstrinene for at opnå FITC-mærkede nanobots var som førnævnte.
Syntese af AuNP'er
AuNP'er blev syntetiseret ved hjælp af en rapporteret metode33. Kort fortalt blev alle materialer renset med frisklavet aqua regia, skyllet grundigt med vand og lufttørret. Efterfølgende blev en 1 mM AuCl4 opløsningen blev opvarmet til dets kogepunkt under omrøring i en rundbundet kolbe integreret i et tilbagesvalingssystem. Efter dette blev 10 ml natriumcitratopløsning (30.8 mM) tilsat, og opløsningen blev kogt i 20 minutter, hvilket resulterede i en rød farve. Opløsningen fik derefter lov til at afkøle til stuetemperatur under omrøring i 1 time. De resulterende AuNP'er blev opbevaret i mørke, og karakterisering blev udført ved anvendelse af transmissionselektronmikroskopi.
Enzymatisk aktivitet
Enzymatisk aktivitet af nanobots, 18F-nanobots og 131I-nanobots blev målt med phenolrød. For at gøre det, 2 µl nanobots (1 mg ml-1) blev tilsat til en plade med 96 brønde og blandet med 200 µl af forskellige urinstofopløsninger (0, 50, 100, 200 mM) i 1.1 mM phenolrød. Absorbans ved 560 nm blev målt over tid ved 37 °C.
Nanobot bevægelsesdynamik gennem optisk mikroskopi
Optiske videoer af nanobots blev erhvervet ved hjælp af et Leica Thunder-mikroskop, kombineret med et Hamamatsu højhastigheds CCD-kamera og et ×1.25 objektiv. Til dette blev nanobotterne centrifugeret og resuspenderet i 50 µl PBS (slutkoncentration på 20 mg ml-1). Derefter blev en petriskål fyldt med 3 ml af enten PBS eller en 300 mM opløsning af urinstof (i PBS) og observeret under mikroskop. En 5 µl dråbe med nanobots (20 mg ml-1) blev derefter tilføjet til den væskefyldte petriskål, og videoer blev optaget med 25 billeder i sekundet. Videopixelintensitetsfordelinger i ROI'er blev analyseret med 15 s intervaller ved hjælp af ImageJ-software.
Radiomærkning af nanobots med [18F]F-PyTFP
Syntese af [18F]F-PyTFP
[18F]F-PyTFP blev syntetiseret i et Neptis xSeed-modul (Optimized Radiochemical Applications) efter en tidligere rapporteret metode33.
Syntese af 18F-mærkede nanobots
Nanobots blev mærket med [18F]F-PyTFP, på baggrund af en tidligere fastlagt procedure med mindre ændringer33. Kort sagt, 200 µl nanobot-opløsning (1 mg ml-1) blev centrifugeret (10 min., 13,853g), resuspenderet i 10 µl PBS (1 mM, pH 8) og inkuberet med 4 µl [18F]F-PyTFP i acetonitril (ca. 37 MBq) i 35 min ved stuetemperatur. Efter inkubation blev reaktionsblandingen fortyndet med vand (200 µl) og renset ved centrifugering (5 min., 13,853g). Den resulterende pellet blev derefter skyllet tre gange med vand, før den blev målt i en dosiskalibrator (CPCRC-25R, Capintec). Radiokemisk udbytte blev beregnet som forholdet mellem mængden af radioaktivitet til stede i nanobotterne efter vask og den initiale mængde radioaktivitet. Radiokemisk renhed efter oprensning var ≥99 %, som bestemt ved radiotyndtlagskromatografi (radio-TLC) ved anvendelse af iTLC-SG kromatografipapir (Agilent Technologies) og dichlormethan og methanol (2:1) som henholdsvis stationære og mobile faser. TLC-plader blev analyseret under anvendelse af en TLC-læser (MiniGITA, Raytest).
Stabilitet af 18F-nanobots
Stabiliteten af 18F-mærkede nanobots blev bestemt under anvendelse af følgende medier: (1) 300 mM urinstof, (2) vand og (3) urin fra tumorbærende dyr. 18F-mærkede nanobots (10 µl) blev inkuberet med den tilsvarende opløsning (100 µl) i 1 time ved stuetemperatur. Derefter blev nanobots og supernatant adskilt ved centrifugering og opsamlet, og radioaktivitet målt i en dosiskalibrator (CPCRC-25R).
Radiomærkning af nanobots med 131I
Radiojodering af urease nanobots blev udført ved at inkubere nanobots med injicerbare [131I]NaI-opløsning (925 MBq ml-1; GE HealthCare). Kort sagt, 400 µl urease nanobot-opløsning (1 mg ml-1) blev centrifugeret (13,853g, 5 min), resuspenderet i 100 µl PBS (10 mM, pH 7.4) og inkuberet med 25 µl eller 185 µl injicerbar [131I]NaI (henholdsvis ca. 42.55 eller 277.5 MBq) i 30 min. afhængigt af den ønskede slutaktivitet. Efter inkubation blev reaktionsblandingen oprenset ved centrifugering (13,853g5 min). Det resulterende bundfald blev vasket tre gange med vand (100 µl). Radioaktivitet i supernatanten og bundfaldet blev bestemt ved anvendelse af en dosiskalibrator (CPCRC-25R), og begge fraktioner blev analyseret ved radio-TLC, som for 18F-nanobots.
Udvikling af dyremodeller
Mus blev vedligeholdt og håndteret i overensstemmelse med Det Europæiske Råds direktiv 2010/63/UE og interne retningslinjer. Alle eksperimentelle procedurer blev godkendt af CIC biomaGUNEs etiske komité og lokale myndigheder (Diputación Foral de Guipuzcoa, PRO-AE-SS-276). Billedanalyse (både PET og MRI) blev blindet mod gruppefordeling af dyrene.
Den ortotopiske murine model af blærekræft blev genereret ved intravesikal administration af MB49-celler (murin carcinom blærecellelinje) til C57BL/6JRj hunmus (8 uger gamle, Janvier). Til eksperimenter rettet mod at bestemme tumorakkumulering (fire grupper; detaljer nedenfor) blev seks dyr podet pr. gruppe, som bestemt ved anvendelse af præcisionsanalyse, med følgende antagelser: krævet præcision, 20 %; forventet s.d., ±20%; tillid, 95%; dyretab, 20%. Til eksperimenter med terapeutisk effekt (seks grupper; detaljer nedenfor) blev ti dyr inkluderet pr. gruppe, som beregnet ved hjælp af en en-halet Student t-test, forskel mellem to uafhængige midler, med følgende antagelser: nulhypotese, behandling påvirker ikke tumorvækst; α0.05; 1 - β0.95; s.d., ±50%; forventede forskelle mellem grupper, 50%; dyretab, 20%. Da eksperimentet blev udført i to batches af driftsmæssige årsager, blev en kontrolgruppe inkluderet i begge batches (tabel 2), og derefter blev alle dyr samlet. Til tumoretablering blev mus bedøvet ved inhalation af 3% isofluran i ren O2 og vedligeholdes af 1.0-1.5% isofluran i 100% O2. Derefter blev blæren tømt, og kemiske læsioner induceret på urothelium ved intravesisk instillation af 50 µl poly-l-lysin (Sigma-Aldrich) gennem et 24-gauge kateter i 15 min. Efterfølgende blev blæren tømt igen og MB49-celler (105 celler) i højglukose-DMEM (100 µl) blev inddryppet i 1 h, før kateteret blev fjernet og blæren tømt via mavemassage. Igennem eksperimenterne blev mus overvåget og vejet til sundheds- og velfærdsovervågning. Et humant endepunkt blev anvendt, hvis vægttab oversteg 20 % eller på basis af kliniske symptomer, i henhold til kriterierne for den ansvarlige dyrlæge.
Sporing af tumorstørrelse
MR-undersøgelser blev udført 7 og 14 dage efter tumorinduktion ved brug af en 7 T Bruker BioSpec USR 70/30 scanner (Bruker BioSpin) udstyret med en BGA-12S gradientindsats på 440 mT m-1 og en 112/086 QSN-resonator (T12053V3) til radiofrekvens14 transmission og en rottehjerneoverfladespole (T11205V3) til RF-modtagelse (begge opererer ved 300 MHz). Dyr blev bedøvet med isofluran (4 % til induktion og 1.5 % til vedligeholdelse i en 50 % O2/50 % N2 blanding) og anbragt på en MR-kompatibel vugge. Kropstemperatur og respirationshastighed blev kontinuerligt overvåget ved hjælp af en MR-kompatibel overvågningsenhed (model 1030 SA, Small Animal Instruments), koblet til et luftvarmesystem med små gnavere for at opretholde kropstemperaturen. Efter at have erhvervet referencebilleder blev en spin-ekko-baseret diffusionsvægtet billedsekvens brugt til at afbilde tumorer ved at bruge følgende parametre: ekkotid (TE) = 22.3 ms, gentagelsestid (TR) = 2,500 ms, n = 2 gennemsnit, et A0-billede (basalbillede med b = 0 s mm-2) og et DW-billede erhvervet ved hjælp af diffusionsgradienter i (1, 0, 0) retningen med en gradientvarighed δ = 4.5 ms og en gradientadskillelse Δ = 10.6 ms, hvilket giver b = 650 s mm-2, en 16 × 16 mm2 synsfelt, billedmatrixstørrelse på 160 × 160 punkter, 20 på hinanden følgende skiver med 0.5 mm tykkelse (ingen mellemrum, erhvervet i interleaved-tilstand) og en båndbredde på 192.9 Hz pr. pixel. For at visualisere tumorer blev billeder efterbehandlet med ImageJ-software, idet billederne blev opdelt med en diffusionsgradient (b = 650 s mm-2) af dem, der er erhvervet uden (b = 0 s mm-2), og anvende et 3D Gaussisk filter (σx = σy = σz = 0.7) til resultatet. Tumorer blev manuelt afgrænset for at bestemme deres volumen.
In vivo biodistribution
På dag 15 efter tumorinduktion blev mus randomiseret i fire grupper for at opnå homogene gennemsnitlige tumorvolumenfordelinger blandt grupper. PET-CT-scanninger (MOLECUBES β og X-CUBE scannere) blev erhvervet 3 timer efter intravesikal administration af 100 µl af 18F-BSA (gruppe 1 og 2) eller 18F-urease (gruppe 3 og 4) nanobots i en koncentration på 200 µg ml-1, ved at bruge enten vand (gruppe 1 og 3) eller 300 mM urinstof i vand (gruppe 2 og 4) som vehikel (tabel 1). Til billedoptagelse blev dyr induceret med anæstesi (5% isofluran i ren oxygen) og anbragt i rygliggende stilling før massage af maveregionen til blæreevakuering. Umiddelbart derefter, den tilsvarende 18F-mærkede nanobots (18F-BSA/18F-urease i vand/urinstof) blev instilleret i blæren gennem et 24-gauge kateter og inkuberet i 1 t, før kateteret blev fjernet, blæren blev tømt og musene blev overladt til at komme sig efter anæstesi. På t = 3 t efter administration blev dyrene bedøvet igen og 10 min. statiske PET-billeder af hele kroppen taget efterfulgt af CT-scanninger. PET-billeder blev rekonstrueret ved hjælp af den 3D-ordnede delmængdeforventningsmaksimeringsrekonstruktionsalgoritme med tilfældige, sprednings- og dæmpningskorrektioner. PET-CT-billeder af den samme mus blev co-registreret og analyseret ved hjælp af PMOD-billedbehandlingsværktøjet. Plots af koncentration af radioaktivitet versus tid blev opnået ved at skabe et volumen af interesse på den øvre blæreregion ved hjælp af et 3D-konturværktøj og måling af aktivitet (henfaldskorrigeret) i kilobecquerel pr. organ. Resultaterne blev korrigeret ved at anvende en kalibreringsfaktor og derefter normaliseret ved MRI-afledt tumorvolumen.
Ex vivo undersøgelser
Histopatologiske analyser
Efter at have gennemført al billeddannelse, valgte blærer (n = 3 pr. gruppe) fra tumorbærende og raske dyr blev fjernet under aseptiske forhold og straks fikseret i 4% formaldehyd. Derefter blev blærer indlejret i paraffin, før de tog 2-3 µm snit til hæmatoxylin-eosin-farvning. Repræsentative billeder blev opnået fra alle forhold til histopatologisk undersøgelse.
ICP-MS analyse
Målinger blev udført på en Thermo iCAP Q ICP-MS (Thermo Fisher Scientific) koblet med en ASX-560 autosampler (CETAC Tech). Efter at have gennemført al billeddannelse blev dyrene dræbt og udvalgte blærer (n = 2 pr. gruppe; fire grupper) opsamlet og fordøjet i 1 ml HNO3:HCI (4:1 blanding). Dispersionen blev kogt, indtil organerne var fuldstændigt opløst. Derefter blev opløsningen afkølet til stuetemperatur og analyseret ved hjælp af ICP-MS for at bestemme koncentrationen af Au i hver prøve, hvilket transformerede resultaterne til procenter af injiceret dosis pr. gram væv (%ID g-1).
Immunhistokemi og konfokal mikroskopi billeddannelse
Til immunhistokemiske analyser modtog tumorbærende dyr FITC-mærkede nanobots i vand eller 300 mM urinstof (n = 4 pr. gruppe), som beskrevet ovenfor, for PET-CT undersøgelser. Derudover fungerede tumorbærende dyr uden nanobots som kontrolgruppe (n = 2). I alle tilfælde blev blærer opsamlet, frosset og skåret i 10 µm sektioner, der straks blev fikseret i 10% formaldehyd i 15 min, vasket med 10 mM PBS og derefter inkuberet i 50 mM NH4Cl i PBS i 5 minutter, før der skylles igen med PBS. Permeabilisering blev udført med methanol:acetone (1:1) i 5 minutter ved stuetemperatur og 0.1 % Triton i PBS i 5 minutter. Efter PBS-vask blev prøverne mættet med en opløsning af 5% BSA-0.5% Tween i PBS i 15 minutter ved stuetemperatur og inkuberet i 1 time ved stuetemperatur med muse-anti-FITC (1:100, Abcam) i 5% BSA –0.5 % Tween. Sektioner blev vasket tre gange med 10 mM PBS i 5 min og inkuberet i 30 min ved stuetemperatur med sekundært antistof Alex Fluor 647 æsel-anti-muse-IgG (Molecular Probes, Life Technologies, 1:1,000) i 5% BSA-0.5% Tween i PBS, vasket igen i PBS (3 × 5 min) og monteret med et ProLong antifade-kit med 4,6-diamidino-2-phenylindol (DAPI; Molecular Probes, Life Technologies). Billeder blev erhvervet med et Leica STELLARIS 5 konfokalmikroskop (UPV/EHU Scientific Park) med identiske indstillinger for alle sektioner: ×10 forstørrelse med flisebilleddannelse og syning (typisk 4 × 5 synsfelt). Laserlinje og detektionsvinduer var 405 nm og 440–503 nm for DAPI, 489 nm og 494–602 nm for FITC hvid laser og 653 nm og 660–836 nm for Alexa647 hvid laser.
Optisk clearing
Efter perfusion med 4 % paraformaldehyd og PBS blev blæreprøver fjernet og yderligere fikseret i 4 % paraformaldehyd natten over ved 4 °C, derefter indlejret i en 5 ml sprøjte med 0.8 % lavsmeltende agarose for at danne en cylindrisk blok og muliggøre let montering i kvartskuvetten. Hele blokken blev progressivt dehydreret under anvendelse af methanol:H2O ved 4 °C (30 %:70 % i 1 t, 50 %:50 % i 1 t, 70 %:30 % i 1 t, 100 %:0 % i 1 t, derefter 100 % methanol natten over og igen i 4 h) og til sidst nedsænket i benzylalkohol-benzylbenzoat (BABB) som brydningsindeksmatchende opløsning til billeddannelse. Til in vitro sammenligninger af grønne FITC nanobots med kommercielle røde partikler brugte vi DiagNano (Creative Diagnostics) røde fluorescerende silica nanopartikler, 1 µm diameter, resistente over for BABB clearing.
Autofluorescens og polariseret sLS-billeddannelse
Light-sheet-billeddannelse blev udført på MacroSPIM, et brugerdefineret system til cleared helorgan-billeddannelse udviklet på IRB Barcelona44,45. Kort sagt, prøver er indlejret i en agaroseblok, renset sammen med prøven og afbildet inde i en kvartskuvette. Autofluorescensbilleddannelse brugte lasere ved 488, 561 eller 638 nm, der leverede belysning gennem en 50 mm akromatisk dublet cylindrisk linse (ACY254-050-A, Thorlabs). For at reducere stribeartefakter drejes lysarket med en resonansscanner SC-10 (EOPC) langs et 4f-teleskop med G322288322 100 mm akromatiske dubletlinser (QI Optic Photonics). Vævsautofluorescens opsamles gennem bånd- eller langpasfluorescensfiltre og optages med et ORCA Flash v2-kamera (Hamamatsu Photonics). Billeddannelse blev udført ved ×9.6 med en ×8 zoom, ×2 linse og ×0.6 rørlinse. Lysarket blev fladtrykt over synsfeltet, hvilket gav 5-6 µm aksial opløsning. 3D-billeddannelse blev udført i trin på 2.5 µm. Billeddannelse af hele blæren blev udført i 2 × 3 eller 3 × 4 XY fliser, afhængig af orgelstørrelse.
sLS-billeddannelse blev opnået ved at fjerne fluorescensfilteret eller bruge et hvilket som helst filter, der transmitterede laseren. Light-sheet-drejning reducerer laserspletterstøj, hvilket resulterer i tidsmæssig gennemsnit af laserkohærens som vist tidligere52. Orienteringen af lineær lysarkpolarisering i belysning blev kontrolleret ved at rotere en halvbølgeplade (AHWP05M-600, Thorlabs) før pivotscanneren. Det detekterede signal blev udvalgt i polarisering under anvendelse af en roterende lineær polarisator (LPVISC100, Thorlabs) før filterhjulet til detektion, hvilket introducerede >50% intensitetstab i fluorescensdetektion. Mens sLS-signalfordeling generelt ændres med polarisatorens orientering, forbliver vævsautofluorescenssignalet upåvirket af polarisatorens rotation. sLS giver en rumlig opløsning på 2.4 ± 0.3 µm i BABB, hvilket er sammenlignelig med opløsningen i fluorescenslysarkbilleddannelse (bekræftet ved at tilpasse en Gauss-funktion til XY billedrespons af en enkelt partikel, Supplerende Fig. 8 l-m) og tæt på den teoretiske opløsning i luft (1.53 µm med numerisk blænde (NA) = 0.2 ved maksimal makrozoom ×8).
Billedbehandling og 3D-analyse
Billedbehandling, segmentering og analyse af lysarkdatasæt blev udført med ImageJ/Fiji, mens fig. 3 , 4 blev genereret med Imaris Viewer 9.9 (https://imaris.oxinst.com/imaris-viewer) og supplerende video 3 blev genereret med Imaris 9 (https://imaris.oxinst.com/) (Bitplane, Oxford Instruments). Flisebelagte lysarkdatasæt blev syet med MosaicExplorerJ53. Blærevæv 3D-segmentering blev udført ved hjælp af brugerdefinerede ImageJ/Fiji-makroer til semi-automatisk 3D-annotering af store volumener i virtuel tilstand. Kort sagt, et første script, 'Macro1', indlæser 3D-billedstabler, muliggør brugerannotering af ROI'er i flere planer og interpolerer automatisk ROI'erne for at generere og eksportere 3D-masker. ROI'er blev tegnet for hver 15. planer (hver 37.5 µm) for at lette god segmenteringskontinuitet, mens annoteringer blev holdt på et rimeligt minimum. Et andet script, 'Macro2', udfører de matematiske eller boolske operationer, plan for plan uden at indlæse hele stakkene i hukommelsen, enten mellem 3D-masker eller mellem en 3D-maske og de originale data, og gemmer resultatet som en ny stak. Alle masker blev genereret ved at annotere autofluorescensbilleder.
Både tumor- og sunde vævsoverfladelag (fig. 3) blev afgrænset ved hjælp af Fijis tryllestav og lassoværktøjer på blærehulen i en maske. Ved at kalde denne første iteration BC1, udvider efterfølgende kørsler af Macro1 automatisk denne 3D-kontur med en defineret pixelmængde for at give nye maskeiterationer, BC2, BC3 og så videre, med stigende udvidelser. Det første lag, der indeholder både tumor og sundt væv, maske L1, opnås ved at trække maske BC1 fra BC2 og så videre, hvilket giver L2 og L3 som koncentriske lag. Tumorvolumenet tættest på hulrummet blev opnået ved at annotere tumoren med stav og lassoværktøjer for at skabe en maske T1, mens det sunde urothelium 3D-lag blev detekteret separat i maske U1. Subtrahering af U1 fra L1 giver tumorens overfladelag og så videre: L2 − U1, L3 − U1. Omvendt opnås det første lag af urothelium ved at trække T1 fra L1. Alle lag i fig. 3 blev defineret til at have en tykkelse på 33 µm.
Den samme suite af makroer og procedurer (ImageJ-stavværktøj, digital erosion på 500 µm og så videre) blev brugt til at afgrænse og segmentere den indre del af blærevævet og derefter estimere blærens indre vævsvolumen (fig. 4, se ovenfor for detaljer). Histogrammer af den spredte signalintensitet blev skabt i Fiji ved at kombinere det spredte signal og maske.
RNT ved hjælp af 131I-nanobots
Mellem dag 8 og 15 efter tumorimplantation blev dyr opdelt i seks grupper (gruppe 1-6), der forsøgte at opnå lignende gennemsnitlige tumorvolumener på tværs af grupper (tabel) 2). Til forsøgene blev dyr induceret med anæstesi (5% isofluran i ren O2) og placeres rygliggende før tømning af blæren ved at massere maveregionen. Umiddelbart derefter, 100 µl af den passende behandling i en koncentration på 400 µg ml-1 (Bord 2) blev instilleret i blæren ved hjælp af et 24-gauge kateter. Behandling og vehikel (vand eller urinstof) forblev i blæren i 1 time, før kateteret blev fjernet. Blæren blev tømt igen ved mavemassage, og mus, der blev bedøvet i deres bure, erstattede savsmuld fra dyrebure 24 timer efter behandling for at fjerne radioaktiv kontaminering.
Terapeutisk effekt bestemt ved MR
To MRI-undersøgelser blev udført på hver mus: (1) mellem dag 7 og 14 efter tumorpodning for at randomisere dyr blandt grupper og måle initiale (forbehandling) tumorvolumener; (2) mellem dag 16 og 21 efter tumorinokulering (efterbehandling) for at evaluere terapeutisk effektivitet. MR blev udført ved hjælp af 7 T Bruker BioSpec og 11.7 T Bruker BioSpec scannere (begge med ParaVision 7 software), afhængigt af tilgængelighed. Dette påvirkede ikke resultaterne, da det eksterne felt ikke er kritisk for anatomisk billeddannelse14. Billeddannelseseksperimenter blev udført under anvendelse af de samme billeddannelsesparametre og behandling som forklaret ovenfor (Sporing af tumorstørrelse). I tilfældet med 11.7 T-scanneren bestod opsætningen af en musehjerteoverfladespole til modtagelse og en volumetrisk spole til transmission. Tumorvolumener i hver skive blev bestemt ud fra manuelt udtrukne volumener af interesse, der dækkede tumorområdet.
Statistisk analyse
I PET-billeddannelsesundersøgelser, procentdel af injiceret dosis (% ID) og injiceret dosis pr. tumorvolumen (% ID cm-3) blev sammenlignet under anvendelse af envejs ANOVA. Forskelle mellem grupper blev bestemt ved hjælp af Tukeys multiple sammenligningstest. NTV i RNT-sektionen blev hentet fra en t-test af uparrede værdier. Datafordelingen blev antaget at være normal, men dette blev ikke formelt testet. Statistiske analyser blev udført med GraphPad Prism v.8.
Rapporteringsoversigt
Yderligere information om forskningsdesign er tilgængelig i Nature Portfolio Reporting Summary knyttet til denne artikel.
- SEO Powered Content & PR Distribution. Bliv forstærket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk dig selv. Adgang her.
- PlatoAiStream. Web3 intelligens. Viden forstærket. Adgang her.
- PlatoESG. Kulstof, CleanTech, Energi, Miljø, Solenergi, Affaldshåndtering. Adgang her.
- PlatoHealth. Bioteknologiske og kliniske forsøgs intelligens. Adgang her.
- Kilde: https://www.nature.com/articles/s41565-023-01577-y
- :er
- :ikke
- ][s
- 000
- 1
- 10
- 100
- 11
- 13
- 14
- 15 %
- 16
- 160
- 20
- 200
- 2015
- 2017
- 2018
- 2019
- 2020
- 2021
- 22
- 23
- 24
- 25
- 250
- 30
- 300
- 33
- 35 %
- 3d
- 400
- 41
- 50
- 500
- 51
- 52
- 53
- 7
- 70
- 8
- 9
- 95 %
- a
- Om
- over
- overensstemmelse
- akkumulering
- opnå
- opnået
- erhvervede
- erhverve
- erhvervelse
- tværs
- aktiveret
- aktiv
- aktivitet
- tilføjet
- tilføje
- Derudover
- administration
- påvirke
- Efter
- bagefter
- igen
- Rettet
- LUFT
- AL
- alex
- algoritme
- Alle
- tilladt
- sammen
- Alzheimers
- blandt
- beløb
- amyloid
- an
- analyser
- analyse
- Anchor
- ,
- dyr
- dyr
- antistof
- enhver
- applikationer
- anvendt
- Anvendelse
- passende
- godkendt
- aqua
- ER
- OMRÅDE
- artikel
- AS
- antaget
- antagelser
- At
- Myndigheder
- automatisk
- tilgængelighed
- til rådighed
- gennemsnit
- gennemsnit
- b
- Babb
- båndbredde
- grundlag
- BE
- før
- adfærd
- være
- jf. nedenstående
- mellem
- Bloker
- krop
- kogt
- både
- Brain
- byrde
- men
- by
- bure
- beregnet
- ringer
- værelse
- Kræft
- tilfælde
- tilfælde
- CCD
- celle
- Celler
- Ændringer
- afgift
- kemikalie
- Rydning
- klik
- Klinisk
- Luk
- spole
- kombination
- kombinerer
- kommerciel
- udvalg
- sammenlignelig
- sammenlignet
- sammenligninger
- fuldstændig
- færdiggøre
- koncentration
- betingelse
- betingelser
- gennemført
- tillid
- BEKRÆFTET
- træk
- kontinuitet
- kontinuerligt
- kontrol
- kontrolleret
- omvendt
- Cool
- korrigeret
- Rettelser
- Tilsvarende
- Rådet
- koblede
- dækker
- skabe
- oprettet
- Oprettelse af
- Kreativ
- kriterier
- kritisk
- CT scanninger
- skik
- Klip
- mørk
- data
- datasæt
- dag
- Dage
- de
- definerede
- leverer
- Afhængigt
- beskrevet
- Design
- ønskes
- detaljer
- opdaget
- Detektion
- Bestem
- bestemmes
- bestemmelse
- udviklet
- enhed
- diagnostik
- DID
- forskel
- forskelle
- forskellige
- Broadcasting
- digital
- fortyndet
- retning
- Sygdom
- fad
- Spredning
- fordeling
- Distributioner
- Divided
- do
- gør
- færdig
- dosis
- trukket
- Drop
- varighed
- dynamisk
- dynamik
- e
- E&T
- hver
- let
- ekko
- virkningsfuldhed
- enten
- indlejret
- muliggøre
- muliggør
- Endpoint
- forbedret
- Hele
- enzymatisk
- udstyret
- etableret
- etablering
- skøn
- Ether (ETH)
- etik
- europæisk
- evaluere
- Hver
- undersøgelse
- overskredet
- Undtagen
- forventning
- forventet
- eksperiment
- eksperimenterende
- eksperimenter
- forklarede
- eksport
- ekstern
- lette
- faktor
- kvinde
- felt
- Fig
- Figur
- fyldt
- filtrere
- Filtre
- endelige
- Endelig
- Fornavn
- montering
- fast
- Blink
- efterfulgt
- efter
- Til
- formular
- formaldehyd
- Formelt
- frem
- fire
- fra
- frosset
- funktion
- yderligere
- kløft
- ge
- GE Healthcare
- Generelt
- generere
- genereret
- Give
- godt
- gradienter
- Gram
- Grøn
- gruppe
- Gruppens
- Vækst
- retningslinjer
- Have
- he
- Helse
- sundhedspleje
- sund
- Hjerte
- HTTPS
- Huang
- menneskelig
- ICAP
- ID
- identisk
- if
- billede
- billedanalyse
- billeder
- Imaging
- straks
- nedsænket
- forbedrer
- in
- medtaget
- inkorporering
- stigende
- inkuberet
- Inkubering
- INKUBATION
- uafhængig
- indeks
- induktion
- oplysninger
- initial
- indre
- indvendig
- instrumenter
- integreret
- interaktiv
- interesse
- interne
- ind
- indføre
- iteration
- iterationer
- ITS
- KDA
- holde
- kit
- l2
- stor
- laser
- lasere
- lag
- lag
- forlader
- til venstre
- Linse
- linser
- Livet
- lys
- Line (linje)
- LINK
- forbundet
- lastning
- belastninger
- lokale
- off
- Makro
- makroer
- vedligeholde
- vedligeholdelse
- manuelt
- maske
- Masker
- matchende
- materiale
- materialer
- matematiske
- Matrix
- maksimal
- midler
- måle
- målt
- målinger
- måling
- Medier
- Hukommelse
- merino
- methanol
- metoder
- mus
- Mikroskop
- Mikroskopi
- minut
- minimum
- mindre
- blandet
- blanding
- ML
- Mobil
- tilstand
- model
- modeller
- modificeret
- modul
- molekylær
- overvåges
- overvågning
- bevægelse
- mus
- MRI
- MS
- MT
- flere
- nanoteknologi
- Natur
- net
- Neutral
- Ny
- ingen
- Støj
- normal
- objektiv
- observeret
- opnå
- opnået
- of
- Gammel
- on
- ONE
- drift
- operationelle
- Produktion
- optimeret
- or
- Orca
- original
- i løbet af
- overnight
- Oxford
- Oxygen
- Papir
- parametre
- Park
- del
- partikel
- PBS
- Peg
- trænge ind
- per
- udføres
- udfører
- PET
- Petri
- faser
- Pivot
- pixel
- placeret
- fly
- Planes
- plato
- Platon Data Intelligence
- PlatoData
- Punkt
- punkter
- portefølje
- position
- positionerede
- Precision
- forberedt
- præsentere
- tidligere
- procedure
- procedurer
- forarbejdning
- gradvist
- protokol
- Qi
- kvantitativ
- Radio
- tilfældig
- Tilfældigt
- ROTTE
- Sats
- forholdet
- Reagerer
- reaktion
- Læser
- rimelige
- årsager
- modtaget
- modtagelse
- registreres
- Recover
- Rød
- reducere
- Reduceret
- reducerer
- henvisningen
- region
- forblevet
- resterne
- Fjern
- fjernet
- fjernelse
- rapporteret
- Rapportering
- repræsentativt
- påkrævet
- forskning
- resistent
- Løsning
- henholdsvis
- svar
- resultere
- resulterer
- Resultater
- robot
- Værelse
- løber
- s
- SA
- samme
- besparelse
- scanninger
- spredt
- SCI
- videnskabelig
- script
- Anden
- sekundær
- Sektion
- sektioner
- se
- segment
- segmentering
- valgt
- Sequence
- serveret
- indstillinger
- flere
- ark
- vist
- Signal
- Signalfordeling
- lignende
- siden
- enkelt
- SIX
- Størrelse
- Slice
- lille
- So
- natrium
- Software
- løsninger
- Løsninger
- rumlige
- Stabilitet
- stable
- Stakke
- statistiske
- starris
- Steps
- opbevaret
- stribe
- studerende
- undersøgelser
- efterfølgende
- Efterfølgende
- suite
- overflade
- Symptomer
- syntese
- systemet
- T
- T1
- bord
- tager
- tech
- Teknologier
- teleskop
- skabelon
- ti
- prøve
- afprøvet
- at
- deres
- Them
- derefter
- teoretisk
- Terapeutisk
- terapi
- denne
- grundigt
- dem
- tre
- tredimensionale
- Gennem
- hele
- tid
- gange
- væv
- til
- sammen
- værktøj
- værktøjer
- I alt
- mod
- mod
- omdanne
- behandling
- Triton
- forsøger
- tumorer
- to
- typen
- typisk
- upåvirket
- under
- indtil
- på
- anvendte
- Bruger
- ved brug af
- Værdier
- køretøj
- versus
- via
- video
- Videoer
- Specifikation
- Virtual
- Visualiser
- vivo
- bind
- mængder
- volumetrisk
- gåvogn
- Wand
- var
- vask
- Vand
- we
- uger
- vægt
- Velfærd
- var
- Hjul
- som
- mens
- hvid
- vinduer
- med
- inden for
- uden
- X
- Udbytte
- hvilket giver
- udbytter
- zephyrnet
- zoom