16. januar 2024
(Nanowerk nyheder) En vigtig kemisk reaktion - hvor bevægelsen af protoner mellem overfladen af en elektrode og en elektrolyt driver en elektrisk strøm - er et kritisk trin i mange energiteknologier, herunder brændselsceller og de elektrolysatorer, der bruges til at producere brintgas. For første gang har MIT-kemikere kortlagt i detaljer, hvordan disse protonkoblede elektronoverførsler sker ved en elektrodeoverflade. Deres resultater kan hjælpe forskere med at designe mere effektive brændselsceller, batterier eller andre energiteknologier. "Vores fremskridt i denne artikel var at studere og forstå arten af, hvordan disse elektroner og protoner kobles på et overfladested, hvilket er relevant for katalytiske reaktioner, der er vigtige i forbindelse med energikonverteringsanordninger eller katalytiske reaktioner," siger Yogesh Surendranath, en professor i kemi og kemiteknik ved MIT og seniorforfatter til undersøgelsen. Blandt deres resultater var forskerne i stand til at spore præcis, hvordan ændringer i pH-værdien af elektrolytopløsningen, der omgiver en elektrode, påvirker hastigheden af protonbevægelse og elektronstrøm i elektroden. MIT kandidatstuderende Noah Lewis er hovedforfatter af papiret, som vises i dag i Naturkemi ("En mekanistisk ramme på molekylært niveau for grænsefladeprotonkoblet elektronoverførselskinetik"). Ryan Bisbey, en tidligere MIT postdoc; Karl Westendorff, en MIT kandidatstuderende; og Alexander Soudackov, en forsker ved Yale University, er også forfattere til papiret.
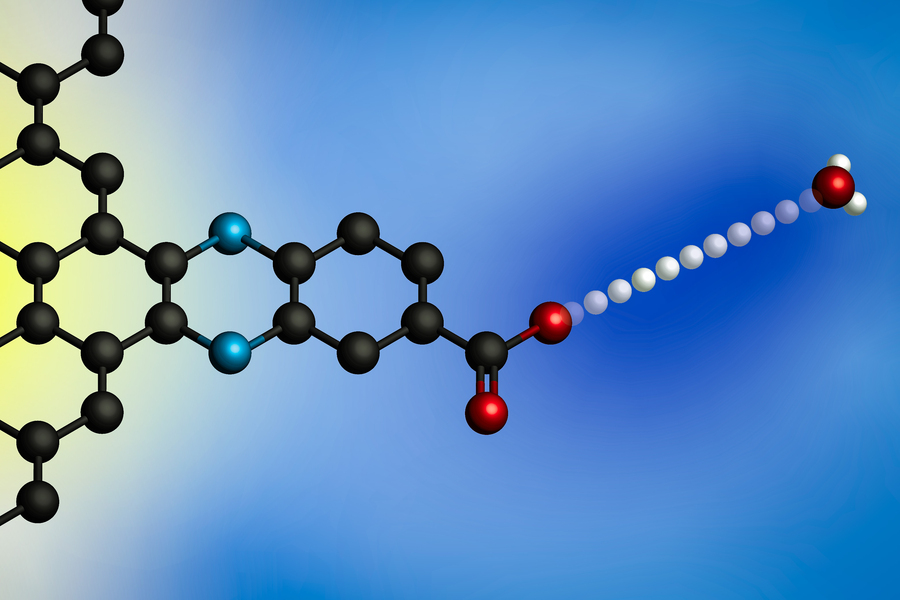 Påføring af et elektrisk potentiale får en proton til at overføre fra en hydroniumion (til højre) til en elektrodes overflade. Ved at bruge elektroder med molekylært definerede protonbindingssteder udviklede MIT-forskere en generel model for disse grænsefladeprotonkoblede elektronoverførselsreaktioner. (Billede: Udlånt af forskerne)
Påføring af et elektrisk potentiale får en proton til at overføre fra en hydroniumion (til højre) til en elektrodes overflade. Ved at bruge elektroder med molekylært definerede protonbindingssteder udviklede MIT-forskere en generel model for disse grænsefladeprotonkoblede elektronoverførselsreaktioner. (Billede: Udlånt af forskerne)
 Påføring af et elektrisk potentiale får en proton til at overføre fra en hydroniumion (til højre) til en elektrodes overflade. Ved at bruge elektroder med molekylært definerede protonbindingssteder udviklede MIT-forskere en generel model for disse grænsefladeprotonkoblede elektronoverførselsreaktioner. (Billede: Udlånt af forskerne)
Påføring af et elektrisk potentiale får en proton til at overføre fra en hydroniumion (til højre) til en elektrodes overflade. Ved at bruge elektroder med molekylært definerede protonbindingssteder udviklede MIT-forskere en generel model for disse grænsefladeprotonkoblede elektronoverførselsreaktioner. (Billede: Udlånt af forskerne)
Passerende protoner
Protonkoblet elektronoverførsel opstår, når et molekyle, ofte vand eller en syre, overfører en proton til et andet molekyle eller til en elektrodeoverflade, hvilket stimulerer protonacceptoren til også at optage en elektron. Denne form for reaktion er blevet udnyttet til mange energianvendelser. "Disse protonkoblede elektronoverførselsreaktioner er allestedsnærværende. De er ofte nøgletrin i katalytiske mekanismer og er særligt vigtige for energiomdannelsesprocesser som brintgenerering eller brændselscellekatalyse,” siger Surendranath. I en hydrogen-genererende elektrolysator bruges denne tilgang til at fjerne protoner fra vand og tilføje elektroner til protonerne for at danne brintgas. I en brændselscelle genereres elektricitet, når protoner og elektroner fjernes fra brintgas og tilsættes ilt for at danne vand. Protonkoblet elektronoverførsel er almindelig i mange andre typer kemiske reaktioner, for eksempel kuldioxidreduktion (konvertering af kuldioxid til kemiske brændstoffer ved at tilføje elektroner og protoner). Forskere har lært meget om, hvordan disse reaktioner opstår, når protonacceptorerne er molekyler, fordi de præcist kan kontrollere strukturen af hvert molekyle og observere, hvordan elektroner og protoner passerer mellem dem. Men når protonkoblet elektronoverførsel sker ved overfladen af en elektrode, er processen meget sværere at studere, fordi elektrodeoverflader normalt er meget heterogene med mange forskellige steder, som en proton potentielt kan binde til. For at overvinde denne forhindring udviklede MIT-teamet en måde at designe elektrodeoverflader på, der giver dem meget mere præcis kontrol over sammensætningen af elektrodeoverfladen. Deres elektroder består af plader af grafen med organiske, ringholdige forbindelser fastgjort til overfladen. For enden af hvert af disse organiske molekyler er en negativt ladet oxygenion, der kan acceptere protoner fra den omgivende opløsning, hvilket får en elektron til at strømme fra kredsløbet ind i den grafitiske overflade. "Vi kan skabe en elektrode, der ikke består af en bred mangfoldighed af steder, men er en ensartet række af en enkelt type meget veldefinerede steder, der hver især kan binde en proton med den samme affinitet," siger Surendranath. "Da vi har disse meget veldefinerede websteder, var det, det gjorde, at vi virkelig kunne optrevle kinetikken i disse processer." Ved hjælp af dette system var forskerne i stand til at måle strømmen af elektrisk strøm til elektroderne, hvilket gjorde det muligt for dem at beregne hastigheden af protonoverførsel til iltionen ved overfladen ved ligevægt - tilstanden hvor hastighederne for protondonation til overfladen og protonoverførsel tilbage til opløsning fra overfladen er lige store. De fandt ud af, at pH-værdien af den omgivende opløsning har en signifikant effekt på denne hastighed: De højeste hastigheder fandt sted i de ekstreme ender af pH-skalaen - pH 0, den mest sure, og pH 14, den mest basale. For at forklare disse resultater udviklede forskere en model baseret på to mulige reaktioner, der kan forekomme ved elektroden. 3O+), som er i høj koncentration i stærkt sure opløsninger, leverer protoner til overfladens oxygenioner og genererer vand. I den anden leverer vand protoner til overfladens oxygenioner, hvilket genererer hydroxidioner (OH-), som er i høj koncentration i stærkt basiske opløsninger. Imidlertid er hastigheden ved pH 0 omkring fire gange hurtigere end hastigheden ved pH 14, delvis fordi hydronium afgiver protoner hurtigere end vand.En reaktion at genoverveje
Forskerne opdagede også, til deres overraskelse, at de to reaktioner har ens hastigheder ikke ved neutral pH 7, hvor hydronium- og hydroxidkoncentrationer er ens, men ved pH 10, hvor koncentrationen af hydroxidioner er 1 million gange koncentrationen af hydronium. Modellen antyder, at dette skyldes, at den fremadrettede reaktion, der involverer protondonation fra hydronium eller vand, bidrager mere til den samlede hastighed end den tilbagegående reaktion, der involverer protonfjernelse med vand eller hydroxid. Eksisterende modeller af, hvordan disse reaktioner opstår ved elektrodeoverflader, antager, at de fremadrettede og bagudgående reaktioner bidrager lige meget til den samlede hastighed, så de nye resultater tyder på, at disse modeller muligvis skal genovervejes, siger forskerne. "Det er standardantagelsen, at de fremadrettede og omvendte reaktioner bidrager lige meget til reaktionshastigheden," siger Surendranath. "Vores fund er virkelig øjenåbnende, fordi det betyder, at den antagelse, som folk bruger til at analysere alt fra brændselscellekatalyse til brintudvikling, kan være noget, vi skal genoverveje." Forskerne bruger nu deres eksperimentelle opsætning til at undersøge, hvordan tilsætning af forskellige typer ioner til elektrolytopløsningen, der omgiver elektroden, kan fremskynde eller sænke hastigheden af protonkoblet elektronstrøm. "Med vores system ved vi, at vores websteder er konstante og ikke påvirker hinanden, så vi kan læse, hvad ændringen i løsningen gør ved reaktionen ved overfladen," siger Lewis.- SEO Powered Content & PR Distribution. Bliv forstærket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk dig selv. Adgang her.
- PlatoAiStream. Web3 intelligens. Viden forstærket. Adgang her.
- PlatoESG. Kulstof, CleanTech, Energi, Miljø, Solenergi, Affaldshåndtering. Adgang her.
- PlatoHealth. Bioteknologiske og kliniske forsøgs intelligens. Adgang her.
- Kilde: https://www.nanowerk.com/news2/green/newsid=64425.php
- :har
- :er
- :ikke
- :hvor
- $OP
- 1
- 10
- 11
- 13
- 14
- 16
- 7
- 8
- a
- I stand
- Om
- Acceptere
- tilføje
- tilføjet
- tilføje
- fremme
- påvirke
- påvirker
- Alexander
- tilladt
- også
- blandt
- an
- analysere
- ,
- En anden
- kommer til syne
- applikationer
- Anvendelse
- tilgang
- ER
- Array
- AS
- antage
- antagelse
- At
- forfatter
- forfattere
- tilbage
- baseret
- grundlæggende
- batterier
- BE
- fordi
- været
- mellem
- binde
- binding
- men
- by
- beregne
- CAN
- kulstof
- carbondioxid
- årsager
- celle
- Celler
- center
- lave om
- Ændringer
- opladet
- kemikalie
- kemi
- kemikere
- Fælles
- sammensætning
- koncentration
- konstant
- sammenhæng
- bidrage
- bidrager
- kontrol
- Konvertering
- kunne
- Par
- skabe
- kritisk
- Nuværende
- Dato
- deal
- Standard
- definerede
- levere
- leverer
- Design
- detail
- udviklet
- Enheder
- forskellige
- svært
- opdaget
- Mangfoldighed
- do
- Er ikke
- gør
- donation
- ned
- drev
- hver
- effekt
- effektiv
- Elektrisk
- elektricitet
- elektrolyt
- elektroner
- ende
- ender
- energi
- Engineering
- lige
- lige
- Equilibrium
- Ether (ETH)
- at alt
- evolution
- præcist nok
- eksempel
- eksisterende
- eksperimenterende
- Forklar
- ekstrem
- hurtigere
- finde
- fund
- Fornavn
- første gang
- flow
- Til
- formular
- Tidligere
- Videresend
- fundet
- fire
- Framework
- fra
- Brændstof
- brændstofceller
- brændstoffer
- GAS
- Generelt
- genereret
- generere
- generation
- giver
- eksamen
- Graphene
- stor
- ske
- udnyttet
- Have
- Hjerte
- hjælpe
- Høj
- højeste
- Hvordan
- Men
- HTTPS
- Hydrogenering
- billede
- vigtigt
- in
- Herunder
- ind
- involverer
- IT
- jpg
- karl
- Nøgle
- Venlig
- Kend
- føre
- lærte
- Lewis
- mange
- Kan..
- midler
- måle
- mekanismer
- Mellemøsten
- million
- MIT
- MIT kandidat
- model
- modeller
- molekyle
- mere
- mere effektiv
- mest
- bevægelse
- bevægelse
- meget
- Natur
- Behov
- negativt
- Neutral
- Ny
- Noah
- nu
- observere
- hindring
- forekomme
- forekom
- of
- tit
- on
- or
- organisk
- Andet
- vores
- ud
- i løbet af
- samlet
- Overvind
- Oxygen
- Papir
- del
- især
- passerer
- Mennesker
- plato
- Platon Data Intelligence
- PlatoData
- mulig
- potentiale
- potentielt
- brug
- præcist
- behandle
- Processer
- producere
- Professor
- protoner
- Sats
- priser
- reaktion
- reaktioner
- Læs
- virkelig
- reduktion
- relevant
- fjernelse
- Fjern
- fjernet
- Vedvarende
- vedvarende energi
- forskning
- forskere
- Resultater
- afslører
- vende
- højre
- Ryan
- s
- samme
- siger
- siger
- Scale
- Videnskabsmand
- forskere
- Anden
- senior
- setup
- signifikant
- enkelt
- websted
- Websteder
- langsom
- So
- løsninger
- Løsninger
- noget
- hastighed
- Tilstand
- Trin
- Steps
- stimulerer
- kraftigt
- struktur
- studerende
- Studere
- studere
- sådan
- tyder
- foreslår
- overflade
- overraskelse
- Omkringliggende
- systemet
- Tag
- hold
- Teknologier
- end
- at
- Staten
- deres
- Them
- Disse
- de
- denne
- dem
- tid
- gange
- til
- i dag
- spore
- overførsel
- overførsler
- to
- typen
- typer
- allestedsnærværende
- forståelse
- universitet
- trævle
- us
- anvendte
- ved brug af
- sædvanligvis
- meget
- var
- Vand
- Vej..
- we
- veldefinerede
- var
- Hvad
- hvornår
- som
- bred
- med
- inden for
- zephyrnet