Materiale forberedelse og karakterisering
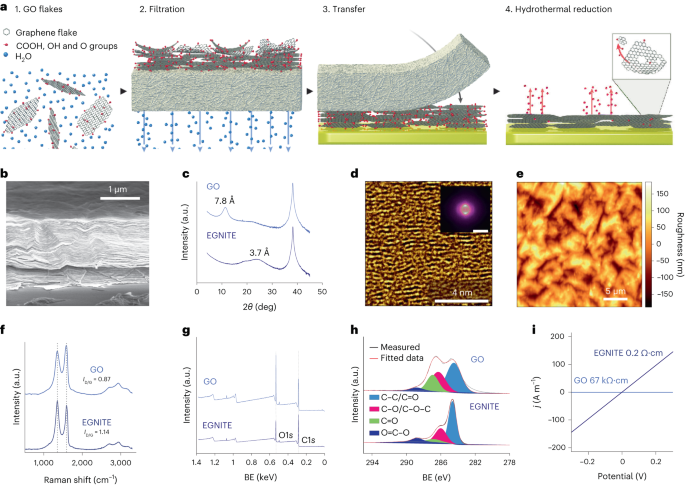
Vandig GO-opløsning blev fortyndet i deioniseret vand for at opnå en 0.15 mg ml-1 opløsning og vakuumfiltreret gennem en nitrocellulosemembran med porer på 0.025 µm, hvilket danner en tynd film af GO. Den tynde film blev derefter overført til målsubstratet under anvendelse af våd overførsel i deioniseret vand og yderligere termisk udglødning ved 100 °C i 2 min. GO film-substrat stakken blev hydrotermisk reduceret ved 134 °C i en standard autoklave i 3 timer for at danne EGNITE. Basissubstratet for alle karakteriseringsundersøgelser af EGNITE var et kvadrat (1 × 1 cm2) af Si/SiO2 (400 μm/1 μm).
XPS
XPS-målinger blev udført med en Phoibos 150 analysator (SPECS) under ultrahøjvakuumforhold (basistryk, 5 × 10-10 mbar) med en monokromatisk Al Ka røntgenkilde (1,486.74 eV). Oversigtsspektre blev erhvervet med en passenergi på 50 eV og trinstørrelse på 1 eV, og højopløsningsspektre blev erhvervet med passenergi på 20 eV og trinstørrelse på 0.05 eV. Den overordnede opløsning i de sidste forhold er 0.58 eV, som bestemt ved at måle den fulde bredde ved det halve maksimum af Ag 3d5/2 top af sputtered sølv. XPS-analysen viser et stærkt fald efter den hydrotermiske behandling af C–O-toppen (associeret med epoxidgrupper), men et lille bidrag af C–OH, C=O og C(O)OH på grund af hydroxyler, carbonyler og carboxyler, der forblive efter reduktion. Dekonvolutionen af O1s peak bekræfter en sådan adfærd. Det vigtigste bidrag til C1s signal efter den hydrotermiske reduktion kommer dog fra sp2 hybridiserede C-C orbitaler34,57.
Røntgenstrålediffraktion
Røntgendiffraktionsmålinger (θ-2θ scanning) blev udført i et Materials Research Diffractometer (Malvern PANalytical). Dette diffraktometer har en vandret ω-2θ goniometer (320 mm radius) i en fire-cirkel geometri og arbejdet med et keramisk røntgenrør med Cu Kα anode (λ = 1.540598 Å). Den anvendte detektor er en Pixcel som er en hurtig røntgendetektor baseret på Medipix2 teknologi.
Raman-spektroskopi
Raman-spektroskopimålinger blev udført ved hjælp af en Witec-spektrograf udstyret med en 488 nm laserexcitationslinje. Til målingerne blev Raman-spektre erhvervet ved hjælp af et 50× objektiv og et 600 riller pr. nm gitter; lasereffekten blev holdt under 1.5 mW for at undgå prøveopvarmning.
TEM
En fokuseret ionstrålelamel blev forberedt med en Helios NanoLab DualBeam (LMA-INA) til tværsnitsundersøgelsen af EGNITE-prøven. Strukturelle analyser blev udført ved hjælp af TEM under anvendelse af et Tecnai F20-mikroskop opereret ved 200 kV, inklusive HRTEM og højvinklet ringformet mørkfelt STEM-teknikker. STEM-EELS-eksperimentet blev udført i et Tecnai F20-mikroskop, der arbejdede ved 200 KeV, med 5 mm blænde, 30 mm kameralængde, en konvergensvinkel på 12.7 mrad og en opsamlingsvinkel på 87.6 mrad. Da vi brugte 0.5 eV pr. pixel og 250 eV som startenergi i core-tab-opsamlingen, erhvervede vi ikke Si K-kanten forventet ved 1,839 eV, Pt M-edge ved 2,122 eV og Au M-edge ved 2,206 eV. Den relative C-O-atomsammensætning er opnået ved at fokusere vores opmærksomhed i det reducerede GO-lag og antage, at de analyserede kanter (C og O i vores tilfælde) summer til 100%. Denne antagelse er gyldig i vores tilfælde, som det fremgår af Yderligere information Kort. Energidifferentieret tværsnit blev beregnet ved hjælp af Hartree-Slater-modellen og baggrunden ved hjælp af en strøm-lav model.
Elektrisk ledningsevne
Elektrisk ledningsevnemålinger blev udført under anvendelse af et Keithley 2400 sourcemeter i topunktskonfiguration. De målte prøver bestod af EGNITE-film på 1 × 1 cm2 oven på en SiO2 substrat.
Dataanalyse
Røntgendiffraktion, Raman og XPS-data blev analyseret ved hjælp af Python 3.7-pakker (Numpy, Pandas, Scipy, Xrdtools, Lmfit, Rampy, Peakutils, Matplotlib). Afstanden mellem planer blev beregnet ud fra røntgendiffraktionsmålingerne i henhold til Snells lov. Når først dataene blev flyttet ind i det rumlige domæne, blev det maksimale af toppene tilpasset. Den tilsvarende afstand gav en middelværdi af afstanden mellem planer. Afvigelser fra disse middelværdier blev beregnet ud fra den fulde bredde ved det halve maksimum af de Lorentzianske fittings af toppene på det rumlige domæne. XPS- og Raman-spektroskopimålinger blev analyseret ved at tilpasse en foldning af toppe på forventede steder for de tilsvarende funktioner. Konduktivitetsværdierne for GO og EGNITE blev opnået ved at montere I-V kurver målt i de elektriske ledningsevnemålinger efter Ohms lov. Data er n = 1 for hver måling.
Fleksibel array-fremstilling
Fremstillingen af enhederne er vist i Supplerende Fig. 4. Enheder blev fremstillet på 4" Si/SiO2 (400 μm/1 μm) wafers. Først blev et 10 µm tykt lag PI (PI-2611, HD MicroSystems) spincoatet på waferen og bagt i en atmosfære rig på nitrogen ved 350 °C i 30 min. Metalliske spor blev mønstret under anvendelse af optisk litografi af billedreverseringsfotoresisten (AZ5214, Microchemicals). Elektronstrålefordampning blev brugt til at afsætte 20 nm titanium og 200 nm guld, og løftet blev udført. Vi brugte en EGNITE-film med en tykkelse på omkring 1 μm som en afvejning mellem elektrokemisk ydeevne og array-fleksibilitet. Efter overførsel af GO-filmen blev aluminium e-beam fordampet, og områder på toppen af de fremtidige mikroelektroder blev defineret ved at bruge en negativ fotoresist (nLOF 2070, Microchemicals) og løfte. Derefter blev GO-filmen ætset overalt bortset fra de fremtidige mikroelektroder ved hjælp af en oxygen-reaktiv ionætsning (RIE) i 5 minutter ved 500 W, og de beskyttende aluminiumsøjler blev ætset med en fortyndet opløsning af fosfor- og salpetersyre. Derefter blev et 3 µm tykt lag af PI-2611 afsat på waferen og bagt som tidligere beskrevet. PI-2611-åbninger på mikroelektroden blev derefter defineret ved hjælp af en positiv tyk fotoresist (AZ9260, Microchemicals), der fungerede som en maske for en efterfølgende oxygen-RIE. Senere blev enhederne mønstret på PI-laget, igen ved brug af AZ9260 fotoresist og RIE. Fotoresistlaget blev derefter fjernet i acetone, og waferen renset i isopropylalkohol og tørret ud. Til sidst blev anordningerne pillet af waferen og var klar til at blive anbragt i sterilisationsposer for at blive hydrotermisk behandlet ved 134 °C i en standardautoklave i 3 timer.
Mikroelektrode elektrokemisk karakterisering
Elektrokemisk karakterisering af mikroelektroderne blev udført med en Metrohm Autolab PGSTAT128N potentiostat i 1× PBS (Sigma-Aldrich, P4417) indeholdende 10 mM phosphatbuffer, 137 mM NaCl og 2.7 mM K-konfiguration ved pH-værdi på 7.4lect og ved pH-værdi 45093-XNUMXlect. En Ag/AgCl-elektrode (FlexRef, WPI) blev brugt som reference, og en platintråd (Alfa Aesar, XNUMX) blev brugt som modelektrode.
Før præstationsevaluering blev elektroderne pulseret med 10,000 ladningsbalancerede pulser (1 ms, 15 µA). Eksponering af elektroder for kontinuerlige pulserende protokoller forløb med 100 cykliske voltammetri-cyklusser (-0.9 til +0.8 V) ved 50 mV s-1, 20 gentagelser af 5,000 pulser (1 ms) og genbestemmelse af åbent kredsløbspotentiale.
Dataanalyse
Elektrokemisk karakteriseringsdata blev analyseret ved hjælp af Python 3.7-pakker (Numpy, Pandas, Scipy, Pyeis, Lmfit, Matplotlib). Impedansspektroskopidata blev tilpasset til en tilsvarende elektrisk model bestående af en modstand (R) i serie med et konstantfaseelement (CPE). Derfra blev CPE-værdien tilnærmet til en kapacitans og divideret med mikroelektrodens geometriske areal for at opnå en ækvivalent værdi for grænsefladekapacitansen af EGNITE. Microelectrode charge storage capacitance (CSC) blev beregnet ud fra cykliske voltammetrimålinger ved at integrere de katodiske og anodiske regimer af den målte strøm og normalisere med scanningshastigheden. Den katodiske og anodiske ladningslagringskapacitans (cCSC og aCSC) ved 100 mV scanningshastighed for EGNITE er 45.9 ± 2.4 og 34.6 ± 2.8 mC cm-2, henholdsvis (n = 3). Som rapporteret for andre materialer58, de opnåede CSC'er afhænger af scanningshastigheden (Supplerende Fig. 5). For at vurdere tilstedeværelsen af iltreduktionsreaktioner målte vi CV-bølgeformen under nitrogen-renset elektrolyt59 og observerede ikke væsentlige forskelle i bølgeform (Supplerende Fig. 6). Vores resultater adresserer imidlertid ikke fuldt ud virkningen af iltreduktionsreaktioner i ladningsinjektionskapaciteten af EGNITE, og der skal gøres yderligere arbejde for at undersøge dette korrekt. Mikroelektrodeladningsinjektionskapacitet (CIC) blev etableret ved at bestemme den aktuelle pulsamplitude, der fremkaldte en spændingsforskel (efter fjernelse af det ohmske fald), der matchede elektrodeelektrokemiske vandvindue (-0.9 V for katodisk og +0.8 V for anodisk versus Ag/AgCl ) (Supplerende Fig. 17)60.
Statistisk analyse
Data er middel ± s.d., n = 18 for EIS og n = 3 for kronopotentiometrier. Data fra kortet over katodisk kapacitive spændingsudsving er gennemsnittet af katodisk kapacitive spændingsudsving for en hændelse for hver pulsform af n = 3 elektroder.
Mekanisk stabilitetsvurdering
Ultralyd sonikering
EGNITE elektrodearrays blev placeret inde i et bæger fyldt med vand i et ultralydsvandbad (Elmasonic P 180H). Sonikering blev påført ved 37 kHz i 15 min ved 200 W og efterfulgt af yderligere 15 min. sonikering ved 37 kHz med effekten forhøjet til 300 W. Billeder af elektroder blev erhvervet før og efter sonikeringstrinene.
Bøjningstest
Bøjningsopstillingen (fig. 2k) bestod af tre cylindriske stænger; den midterste (diameter, 700 µm) blev sænket ned, hvilket gav bøjningsvinkler på 131°. Tre fleksible mikroelektrodearrays blev brugt til bøjningstesten. Hvert array indeholdt 18 mikroelektroder med en diameter på 50 µm. To arrays blev målt efter 10 og 20 cyklusser, mens en enhed kun blev målt i 10 cyklusser, da den blev beskadiget under håndtering efter måling. Bøjningstestcyklussen bestod af en 10 s lang belastningspåføring plus 10 s uden belastning. Enheder blev elektrokemisk karakteriseret (EIS og CV) før og efter 10 og 20 bøjningscyklusser.
Epikortisk neural optagelse
Epikortisk implantation
Alle forsøgsprocedurer blev udført i overensstemmelse med anbefalingerne fra Det Europæiske Fællesskabs Råd og fransk lovgivning for pleje og brug af forsøgsdyr. Protokollerne blev godkendt af Grenobles etiske komité (ComEth) og godkendt af det franske ministerium (nummer 04815.02). Sprague-Dawley rotter (han, 4 måneder gammel, vejer -600 g) blev bedøvet intramuskulært med ketamin (50 mg pr. kg (kropsvægt)) og xylazin (10 mg pr. kg (kropsvægt)) og derefter fikseret til en stereotaktisk holder. Fjernelse af det temporale kranium blottede den auditive cortex. Dura mater blev bevaret for at undgå at beskadige det kortikale væv. Et hul blev boret i toppunktet for at indsætte referenceelektroden, og et andet hul, 7 mm mod fronten fra den første, blev boret for at indsætte jordelektroden. Elektroderne var 0.5 mm tykke ben, der blev brugt til integrerede kredsløbsstik. De blev placeret for at få elektrisk kontakt med dura mater og fikseret til kraniet med dental cement. Vi monterede derefter overflademikroelektrodebåndet på den auditive cortex som vist i fig. 3b. Venemønstrene identificerer den auditive cortex i område 41 af Kriegs rottehjernekort. Kortikale signaler blev samtidigt forstærket med en forstærkning på 1,000 og digitaliseret ved en samplingshastighed på 33 kHz. En højttaler 20 cm foran en rottes øre, kontralateralt til den blottede cortex, leverede akustiske stimuli. De afgivne stimuli blev overvåget af en 0.25" mikrofon (Brüel & Kjaer, 4939) placeret nær øret og præsenteret i lydtryksniveau (dB SPL re 20 μPa). Vi undersøger de toppunktspositive (negative op) responser med middel latens fremkaldt af skiftende klik ved 80 dB SPL og toneburststimuli ved 70 dB SPL med frekvenser fra 5 til 40 kHz, en stige- og faldtid på 5 ms og en varighed på 200 ms.
Dataanalyse
Elektrofysiologiske data blev analyseret ved hjælp af Python 3.7-pakker (Numpy, Pandas, Scipy, Neo, Elephant, Sklearn Matplotlib) og det brugerdefinerede bibliotek PhyREC (https://github.com/aguimera/PhyREC). r.m.s. værdier blev beregnet med et glidende vindue på 20 ms ved frekvenser over 200 Hz. Spektrogrammer blev beregnet for et område mellem 70 Hz og 1.1 kHz. PSD blev beregnet over 60 s kontinuerlige optagelser. For et givet elektrodearray blev to PSD'er beregnet: in vivo (IV) og post-mortem (PM). SNR er udtrykt i dB (20 × ln(r.m.s.(IV)/r.m.s.(PM))) og interpoleret for 20 punkter logaritmisk fordelt mellem 10 Hz og 1 kHz.
Statistisk analyse
Epikortiske neurale data præsenteret i fig. 3 er taget fra individuelle målinger på et enkelt dyr. I fig. 3c, præsenteres data fra 64 elektroder. I fig. 3d, præsenteres data fra to udvalgte elektroder. I fig. 3f, er PSD og SNR beregnet ud fra 64 EGNITE-elektroder og er vist som middel ± s.d. I supplerende fig. 12c,d median data er præsenteret for 192 EGNITE elektroder fra n = 3 eksperimenter og 60 platinelektroder fra n = 1 eksperiment.
Intrakortikal neural optagelse
Intrakortikal implantation
Dyrene blev bedøvet med en blanding af ketamin/xylazin (75:1, 0.35 ml/28 g i.p.), og denne tilstand blev opretholdt med en inhalationsmaske, der gav 1.5 % isofluran. Adskillige mikroskruer blev placeret i kraniet for at stabilisere implantatet, og den på toppen af lillehjernen blev brugt som en generel grund. Proben blev implanteret i den præfrontale cortex (koordinater: AP, 1.5 mm; ML, ±0.5 mm; DV, -1.7 mm fra bregma). Implantationen blev udført ved at overtrække proben med maltose (se protokol nedenfor) for at give midlertidig probestivhed og lette probeindsættelse. Sonden blev forseglet med dental cement. TDT-ZifClip-stik blev brugt til at forbinde proben til det elektrofysiologiske system via et miniaturiseret kabel. Efter operationen gennemgik musen en restitutionsperiode på 1 uge og modtog analgesi (buprenorphin) og antiinflammatoriske (meloxicam) behandlinger. Neural aktivitet blev registreret med flerkanals Open Ephys-systemet ved en samplingshastighed på 30 kHz med en Intan RHD2132-forstærker. De auditive opgaveeksperimenter blev udført i en lydisoleret boks med to højttalere indeni ved hjælp af protokoller baseret på tidligere beskrevet arbejde61. Lydstimulusen bestod af et 15 ms langt hvidt støjklik, gentaget 100 gange (cyklusser), hver adskilt af 5 s (interstimulusinterval). Under opgaven kunne dyret bevæge sig frit.
Maltoseafstivningsprotokol
En vandig opløsning af maltose opvarmes til glasovergangspunktet (Tg), mellem 130 og 160 °C ved hjælp af en kogeplade eller en mikrobølgeovn. Når maltosen er tyktflydende, bringes bagsiden af sonden kun i kontakt med maltosen. Når maltosen afkøles, stivner og stivner den sonden.
Dataanalyse
Neurale signaler fra hver elektrode blev filtreret offline for at udtrække SUA og LFP'er. SUA blev estimeret ved at filtrere signalet mellem 450 og 6,000 Hz, og spidserne fra individuelle neuroner blev sorteret ved hjælp af principal-komponentanalyse med Offline Sorter v.4 (Plexon). For at opnå LFP'er blev signaler nedsamplet til 1 kHz, detrended og notch-filtreret for at fjerne støjlinjeartefakter (50 Hz og dens harmoniske) med specialskrevne scripts i Python. AEP SNR blev beregnet som forholdet mellem top N1 amplituden og s.d. af en periode på 20 ms før stimulus.
Statistisk analyse
Data vist i fig. 3h,i er middel ± s.d., n = 30 som antallet af gennemsnitlige forsøg. Data optaget fra den samme elektrode er vist på dag 30, 60 og 90. Data fra et enkelt dyr præsenteres.
Kronisk epikortikal biokompatibilitet
Kirurgisk implantation af enheder
I alt 27 voksne Sprague-Dawley-hanrotter blev brugt til denne undersøgelse (Charles River). Dyrene blev anbragt ved en omgivelsestemperatur på 21 ± 2 °C og en luftfugtighed på 40-50%, i en 12 t lys/12 t mørke cyklus. Rotter blev anbragt i grupper og fik fri adgang til kost og vand gennem hele forsøgsperioden. Eksperimentelle procedurer blev udført i overensstemmelse med Animal Welfare Act (1998), under godkendelse af UK Home Office og det lokale dyrevelfærdsetiske revisionsorgan (AWERB). Dyr blev bedøvet med isofluran (2-3%) i hele operationens varighed, og dybden af anæstesien blev overvåget ved tåklemreflekstesten. Dyr blev anbragt i en stereotaksisk ramme (Kopf, 900LS), placeret over et termisk tæppe for at opretholde kropstemperaturen. Et kraniotomihul (-5 mm ×4 mm) blev lavet 1 mm væk fra midterlinjen ved hjælp af et tandbor med et 0.9 mm gratbor, duraen blev fjernet, og den epikortikale anordning blev placeret på den kortikale overflade af hjernen. Kraniotomihullet blev forseglet med Kwik-sil efterfulgt af dental cement for at sikre, og huden blev sutureret lukket. Subkutane injektioner af saltvand (1 ml pr. kg (legemsvægt)) og buprenorphin (0.03 mg pr. kg (kropsvægt)) blev givet for at erstatte tabte væsker og reducere postoperative smerter, og anæstesien blev trukket tilbage.
Vævsopsamling og -behandling
Dyrene blev afsluttet 2, 6 eller 12 uger efter implantation ved en passende metode til den type analyse, der skulle udføres.
Histologi og immunhistokemi
2, 6 eller 12 uger efter implantation blev rotter afsluttet via hjerteperfusion med hepariniseret (10 U ml-1Sigma-Aldrich) PBS, efterfulgt af 4% paraformaldehyd (PFA, Sigma-Aldrich) i PBS. Hjerner blev postfikseret i 4 % PFA i 24 timer, derefter overført til 30 % saccharose i PBS i mindst 48 timer før frysning i isopentan. Hjernerne blev derefter opbevaret ved -80 °C indtil kryosektion ved 25 µm. Vævet blev derefter farvet for ioniseret calciumbindende adaptermolekyle 1 (Iba-1) for at bestemme niveauet af mikroglial aktivering. Kort fortalt blev vævssnit blokeret med 5 % gedeserum i PBS med 0.1 % Triton-X i 1 t før inkubation natten over ved 4 °C med det primære antistof anti-Iba-1 (1:1,000, 019-19741; Wako). Sektioner blev derefter farvet med sekundært antistof, anti-kanin Alexa Fluor 594 (1:400, A-11012; Thermo Fisher) i 1 time ved stuetemperatur. Objektglassene blev monteret med dækglas under anvendelse af Prolong Gold anti-fade monteringsmedie med 4,6-diamidino-2-phenylindol (Thermo Fisher). Sonden dækkede et område på 3 × 3.7 mm2 på den kortikale overflade af hjernen; vævssnit udvalgt til farvning dækkede 3.2 mm i længden af denne region. Objektglassene blev afbildet ved hjælp af en 3DHistech Pannoramic-250 objektglasskanner ved 20×, og billederne blev analyseret ved hjælp af CaseViewer v.2.4 (3DHistech). For at vurdere mikroglia-aktivering blev et 3.2 mm område dækket, med ét billede analyseret for hver 100 µm. Billeder blev taget ved 8.5 x forstørrelse, som detaljerede et udsnit af det epikortikale probested, 3 mm fra hjernens midtlinje, omfattende området direkte under probestedet.
Billedbehandling
Mikroskopidataene blev billedbehandlet ved hjælp af en algoritme til mikroglia-fænotypekarakterisering (Supplerende Fig. 13). Mikroglial aktivering blev analyseret ved hjælp af en tilpasset CellProfiler* (Broad Institute, v.3.1.9 fra https://cellprofiler.org/) rørledning. For det første blev EnhanceOrSuppressFeatures-modulet brugt til at forbedre filamentøse strukturer som neuritter ved at anvende tubeness-forbedringsmetoden. Fra de forbedrede billeder blev celler segmenteret ved hjælp af IdentifyPrimaryObjects-modulet. Foreløbige målinger af cellerne antydede, at det passende objektdiameterområde var 3-40 pixels. Objekter uden for dette diameterområde eller rørende ved kanten af billedet blev kasseret. Cellerne blev segmenteret ved hjælp af en to-klasses Otsu adaptiv tærskelstrategi med en adaptiv vinduesstørrelse på 50 pixels. Objekterne identificeret af IdentifyPrimaryObjects-modulet blev input til MeasureObjectSizeShape-modulet for at beregne de nødvendige egenskaber til celleklassificering. I ClassifyObjects-modulet blev kategorien, som klassifikationerne skulle baseres på, angivet til at være AreaShape, og Extent blev valgt som den tilsvarende måling. Cellerne blev klassificeret som 'aktiveret' eller 'ikke-aktiveret' baseret på deres Extent-egenskab, som er forholdet mellem det område, der er optaget af cellen, og det område, der er optaget af dens afgrænsningsramme. Denne klassificeringstilgang blev rationaliseret af det faktum, at aktiverede mikroglia har store cellelegemer og ingen processer og dermed optager en langt større del af deres afgrænsningskasser end deres ikke-aktiverede modstykker. Endelig blev modulerne CalculateMath og ExportToSpreadsheet brugt til at beregne og udlæse den ønskede statistik.
Statistisk analyse
Datasæt er n = 3 for hver enhedstype (PI-kun implantat (PI); PI med eksponeret mikrofabrikeret guld (guld); og PI med mikrofabrikeret guld og EGNITE (EGNITE) på alle tidspunkter) med undtagelse af 6 ugers guld, som er n = 2 for ELISA-data. Kontralaterale halvkugler blev kombineret på hvert tidspunkt for at give n = 9 ved 2 og 12 uger efter implantation og n = 8 ved 6 uger efter implantation. Analyse af dataene blev udført ved hjælp af GraphPad Prism v.8 software. Statistisk analyse blev afsluttet ved hjælp af en to-vejs variansanalyse (ANOVA) med Tukeys multiple-sammenligningstest, hvor det var relevant; P < 0.05 blev anset for at være signifikant.
ELISA
Efter implantationsperioden blev dyrene afsluttet ved cervikal dislokation. Hjernevæv blev ekstraheret fra både højre og venstre hjernehalvdel, snapfrosset i flydende nitrogen og opbevaret ved -80 °C indtil videre brug. Væv blev lyseret under anvendelse af NP-40-lysebuffer (150 mM NaCl, 50 mM Tris-Cl, 1% Nonidet P40-erstatning, Fluka, pH-justeret til 7.4) indeholdende protease og fosfataseinhibitor (Halt Protease og Phosphatase-inhibitor Fisher, Thermoocker Fishertail), efterfulgt af mekanisk afbrydelse af vævet (TissueLyser LT, Qiagen). Prøver blev derefter centrifugeret i 10 minutter ved 5,000 r.p.m., og supernatanten opbevaret ved 4 °C indtil videre brug. LEGENDplex rotteinflammationspanelet (katalognummer 740401, BioLegend), et perlebaseret multiplex ELISA-kit, blev kørt for at kvantificere følgende cytokiner; IL-1α, IL-1β, IL-6, IL-10, IL-12p70, IL-17A, IL-18, IL-33, CXCL1 (KC), CCL2 (MCP-1), granulocyt-makrofag kolonistimulerende faktor, interferon-y og tumornekrosefaktor. Sættet blev kørt i overensstemmelse med producentens instruktioner med protein påfyldt ved et fast volumen på 15 µl. Efter inkubation med supernatant blev perlerne kørt på et BD FACSVerse flowcytometer, og dataene blev analyseret ved hjælp af LEGENDplex dataanalysesoftware.
Neural stimulation
Intrafascikulær implantation
Alle dyreforsøg blev godkendt af den etiske komité under Universitat Autònoma de Barcelona i overensstemmelse med EU-rådets direktiv 2010/63/EU. Dyrene blev anbragt ved 22 ± 2 °C under en 12 h lys/12 h mørkecyklus med mad og vand frit tilgængeligt. Iskiasnerven hos bedøvede Sprague-Dawley hunrotter (250-300 g, -18 uger gammel) blev kirurgisk eksponeret, og TIME-elektroderne blev implanteret transversalt hen over iskiasnerven ved hjælp af en lige nål fastgjort til en 10-0 loop-tråd46. Processen blev overvåget under et dissektionsmikroskop for at sikre den korrekte position af de aktive steder inde i nerve fasciklerne (fig. 4b). Under forsøgene blev dyrets kropstemperatur opretholdt med en varmepude.
Nervestimulation blev udført ved at påføre tog af bifasiske strømimpulser med en fast varighed på 100 µs pr. fase og øge amplitude fra 0 til 150 µA i trin på 1 eller 3 µA ved 3 Hz i 33 s (Stimulator DS4) mikroelektroder. Samtidig blev CMAP'erne registreret fra GM-, TA- og PL-muskler ved hjælp af små nåleelektroder (13 mm lange, 0.4 mm diameter, rustfri stålnåleelektroder A-03-14BEP, Bionic) placeret i hver muskel62. Den aktive elektrode blev placeret på muskelmaven og referencen i niveau med senen. Elektromyografioptagelser blev forstærket (×100 for GM og TA, ×1,000 for PL; P511AC forstærkere, Grass), båndpasfiltreret (3 Hz til 3 kHz) og digitaliseret med et PowerLab-optagelsessystem (PowerLab16SP, ADInstruments) ved kH20 .
Dataanalyse
Amplituden af hver CMAP blev målt fra baseline til den maksimale negative top. Spændingsspidsmålingerne blev normaliseret til den maksimale CMAP-amplitude opnået for hver muskel i eksperimentet. Et selektivitetsindeks (SI) blev beregnet for hvert aktivt sted som forholdet mellem den normaliserede CMAP-amplitude for en muskel, CMAPi, og summen af de normaliserede CMAP-amplituder i de tre muskler, efter formlen SIi = nWCPAi/∑nWCPAj, ved den minimale stimuleringsstrømamplitude, der fremkaldte en minimal funktionelt relevant muskulær respons (defineret som mindst 5 % CMAP-amplitude for en af musklerne i forhold til den maksimale CMAP-amplitude af den muskel, som tidligere var blevet bestemt). Derefter blev de aktive steder med højeste SI for hver af de tre muskler udvalgt som SI'er for hver muskel i et givet eksperiment.
Kronisk intraneural biokompatibilitet
Efter en tidligere rapporteret procedure50,63, iskiasnerven hos bedøvede Sprague-Dawley hunrotter (250-300 g, -18 uger gammel) blev eksponeret, og anordningerne til in vivo biokompatibilitet med og uden EGNITE blev implanteret på langs i den tibiale gren af ischiasnerven (n = 6-8 pr. gruppe). Kort fortalt gennembores nerven ved trifurkationen med en lige nål fastgjort til en 10-0 løkketråd (STC-6, Ethicon); tråden trækker den pilformede spids af den bøjede elektrodestrimmel. Spidsen er skåret for at fjerne tråden, og spidserne af hver arm er let bøjet for at undgå tilbagetrækning af enheden. Et longitudinalt implantat blev valgt, fordi det giver mulighed for en bedre undersøgelse af fremmedlegemeresponsen inde i nerven50.
Nerve- og dyrefunktionsvurdering
Dyr blev evalueret under opfølgende postimplantation ved hjælp af nervelednings-, algesimetri- og gangsti-bevægelsestest62. Til ledningstests blev ischiasnerven i de implanterede og kontralaterale poter stimuleret af nåleelektroder ved ischias-hakket, og CMAP af PL-musklen blev registreret som ovenfor. Latensen og amplituden af CMAP blev målt. Til algesimetritesten blev rotter anbragt på en trådnetplatform, og en mekanisk ikke-skadelig stimulus blev påført med en metalspids forbundet til et elektronisk Von Frey-algesimeter (Bioseb). Den nociceptive tærskel (kraft i gram, ved hvilken dyrene trak poten tilbage) for implanterede versus kontralaterale poter blev målt. Til gangstitesten blev bagpoternes plantar overflade malet med sort blæk, og hver rotte fik lov til at gå langs en korridor. Fodsporene blev indsamlet, og iskiasfunktionsindekset blev beregnet62.
Histologi
Efter 2 eller 8 uger blev dyrene perfunderet med PFA (4%), og iskiasnerverne blev høstet, postfikseret, kryokonserveret og behandlet til histologisk analyse. Til evaluering af FBR blev iskiasnerver skåret i 15 μm tykke tværsnit med en kryostat (Leica CM190). Prøver blev farvet med primære antistoffer for myeliniserede axoner (anti-RT97 til mærkning af Neurofilament 200K, 1:200; Developmental Studies Hybridoma Bank) og makrofager (anti-Iba-1, 1:500; Wako). Derefter blev sektioner inkuberet i 1 time ved stuetemperatur med sekundære antistoffer æsel-anti-mus Alexa Fluor 488 og æsel-anti-kanin Alexa Fluor 555 (1:200, Invitrogen). Repræsentative snit fra den centrale del af implantatet i tibialnerven blev udvalgt, billeder taget med et epifluorescensmikroskop (Eclipse Ni, Nikon) fastgjort til et digitalkamera (DS-Ri2, Nikon) og billedanalyse udført med ImageJ-software (National Institutes af sundhed). Mængden af Iba-1-positive celler i hele området af tibialnerven blev kvantificeret, og tykkelsen af vævskapslen blev målt som middelafstanden af hver side af implantatet til de nærmeste axoner.
Statistisk analyse
Til statistisk analyse af data brugte vi en- eller tovejs ANOVA efterfulgt af Bonferroni post hoc test for forskelle mellem grupper eller tidspunkter. GraphPad Prism software blev brugt til grafisk repræsentation og analyse. Statistisk signifikans blev overvejet hvornår P <0.05.
Rapporteringsoversigt
Yderligere information om forskningsdesign er tilgængelig i Nature Portfolio Reporting Summary knyttet til denne artikel.
- SEO Powered Content & PR Distribution. Bliv forstærket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk dig selv. Adgang her.
- PlatoAiStream. Web3 intelligens. Viden forstærket. Adgang her.
- PlatoESG. Kulstof, CleanTech, Energi, Miljø, Solenergi, Affaldshåndtering. Adgang her.
- PlatoHealth. Bioteknologiske og kliniske forsøgs intelligens. Adgang her.
- Kilde: https://www.nature.com/articles/s41565-023-01570-5
- :har
- :er
- :ikke
- :hvor
- ][s
- $OP
- 000
- 1
- 10
- 100
- 12
- 13
- 130
- 15 %
- 150
- 160
- 19
- 1998
- 20
- 200
- 2010
- 2011
- 2014
- 2016
- 2018
- 2020
- 2022
- 22
- 24
- 25
- 250
- 26
- 27
- 28
- 30
- 300
- 320
- 33
- 35 %
- 350
- 40
- 400
- 41
- 43
- 46
- 50
- 500
- 54
- 58
- 60
- 600
- 7
- 70
- 700
- 75
- 8
- 80
- 87
- 9
- 90
- a
- I stand
- over
- adgang
- overensstemmelse
- Ifølge
- akustisk
- erhverve
- erhvervede
- erhvervelse
- tværs
- Lov
- aktiveret
- Aktivering
- aktiv
- aktivitet
- adaptive
- Yderligere
- adresse
- Justeret
- Voksen
- Efter
- AG
- igen
- AL
- Procenter
- Alexa
- algoritme
- Alle
- tillader
- sammen
- am
- Ambient
- beløb
- Amplified
- an
- analyser
- analyse
- Anchor
- ,
- dyr
- dyr
- Antistoffer
- antistof
- fra hinanden
- Anvendelse
- anvendt
- Anvendelse
- tilgang
- passende
- godkendelse
- godkendt
- ER
- OMRÅDE
- områder
- ARM
- omkring
- Array
- artikel
- AS
- vurdere
- vurdering
- forbundet
- antagelse
- At
- Atmosfære
- atomare
- opmærksomhed
- autoriseret
- til rådighed
- undgå
- væk
- baggrund
- Bank
- Barcelona
- bund
- baseret
- Baseline
- BD
- BE
- Beam
- fordi
- været
- før
- adfærd
- jf. nedenstående
- Bedre
- mellem
- binding
- biomedicinsk
- Bit
- Sort
- blokeret
- organer
- krop
- både
- Boks
- kasser
- Brain
- hjerner
- Branch
- kortvarigt
- bred
- bragte
- buffer
- men
- by
- kabel
- beregne
- beregnet
- værelse
- kapacitiv
- Kapacitet
- hvilken
- gennemføres
- tilfælde
- Boligtype
- ccl2
- celle
- Celler
- cement
- central
- udfordringer
- kendetegnet
- afgift
- Charles
- kemikalie
- valgt
- klassificering
- klassificeret
- klik
- lukket
- cocktail
- samling
- Kolonner
- kombineret
- kommer
- udvalg
- Fællesskaber
- samfund
- Afsluttet
- sammensætning
- betingelser
- gennemført
- ledningsevne
- Konfiguration
- Tilslut
- tilsluttet
- betragtes
- Bestående
- konstant
- kontakt
- indeholdt
- kontinuerlig
- bidrag
- Konvergens
- korrigere
- Tilsvarende
- korridor
- cortex
- Rådet
- modparter
- kursus
- dækket
- kritisk
- Cross
- kryokonserveret
- Nuværende
- skik
- Klip
- cyklus
- cykler
- cytokiner
- beskadige
- mørk
- data
- dataanalyse
- Dage
- de
- falde
- anses
- definerede
- den
- leveret
- afhænge
- depositum
- deponeret
- dybde
- beskrevet
- Design
- ønskes
- detaljeret
- Bestem
- bestemmes
- bestemmelse
- udviklingsmæssige
- enhed
- Enheder
- DID
- Kost
- forskel
- forskelle
- forskellige
- digital
- digitaliseret
- fortyndet
- direkte
- direkte
- dislokation
- Forstyrrelse
- afstand
- Divided
- do
- domæne
- færdig
- ned
- Drop
- grund
- varighed
- i løbet af
- E&T
- hver
- Edge
- Elektrisk
- elektronisk
- element
- elefant
- forhøjet
- omfatter
- energi
- forbedre
- forbedret
- ekstraudstyr
- sikre
- udstyret
- Ækvivalent
- etableret
- anslået
- Ether (ETH)
- etisk
- EUR
- europæisk
- EV
- evalueret
- evaluering
- begivenhed
- Hver
- overalt
- dokumenteret
- undersøge
- undtagelse
- forventet
- eksperiment
- eksperimenterende
- eksperimenter
- udsat
- Eksponering
- udtrykt
- udstrækning
- ekstrakt
- lette
- Faktisk
- faktor
- Fall
- langt
- FAST
- Funktionalitet
- kvinde
- Fig
- Figur
- fyldt
- Film
- film
- filtrering
- Endelig
- Fornavn
- montering
- fast
- Fleksibilitet
- fleksibel
- flow
- fokuserede
- fokusering
- efterfulgt
- efter
- mad
- Til
- Tving
- udenlandsk
- formular
- Formula
- FRAME
- Gratis
- frit
- Frysning
- Fransk
- fra
- forsiden
- frosset
- fuld
- fuldt ud
- funktionel
- funktionelt
- yderligere
- fremtiden
- Gevinst
- gav
- Generelt
- geometri
- Giv
- given
- glas
- GM
- Go
- Guld
- Graphene
- græs
- Ground
- gruppe
- Gruppens
- retningslinjer
- havde
- Halvdelen
- Håndtering
- Have
- Helse
- hjælpe
- halvkugler
- høj opløsning
- højeste
- holder
- Hole
- Home
- Home Office
- Vandret
- HOT
- Men
- HTTPS
- Huang
- i
- identificeret
- identificere
- IEEE
- billede
- billedanalyse
- billeder
- KIMOs Succeshistorier
- in
- Herunder
- stigende
- inkuberet
- INKUBATION
- indeks
- individuel
- inflammation
- oplysninger
- indgang
- indvendig
- Institut
- anvisninger
- integreret
- Integration
- beregnet
- grænseflade
- grænseflader
- ind
- undersøge
- IT
- ITS
- holdt
- kit
- Koch
- etiket
- laboratorium
- stor
- større
- laser
- Efternavn
- Latency
- senere
- Lov
- lag
- mindst
- til venstre
- Lovgivning
- Længde
- Niveau
- Bibliotek
- ligesom
- begrænsninger
- Line (linje)
- LINK
- forbundet
- Flydende
- belastning
- lokale
- placeret
- placeringer
- Lang
- langsigtet
- tabte
- sænket
- makrofager
- lavet
- Main
- vedligeholde
- lave
- kort
- Maps
- maske
- matchede
- materiale
- materialer
- matplotlib
- maksimal
- mc
- betyde
- midler
- målt
- måling
- målinger
- måling
- mekanisk
- Medier
- metal
- metode
- mikroglia
- mikrofon
- Mikroskop
- Mikroskopi
- Mellemøsten
- minut
- mindste
- minimum
- ministerium
- blanding
- ML
- model
- modeller
- modul
- Moduler
- molekyle
- overvåges
- måned
- mus
- bevæge sig
- flyttet
- MS
- multikanal
- muskel
- nanoteknologi
- national
- National Institutes of Health
- Natur
- I nærheden af
- nødvendig
- nekrose
- behov
- negativ
- NEO
- netto
- netværk
- Neural
- neurofilament
- Neuroner
- næste
- ingen
- Støj
- nummer
- bedøvet
- objekt
- objektiv
- objekter
- observere
- opnå
- opnået
- of
- off
- Office
- offline
- Gammel
- on
- engang
- ONE
- kun
- åbent
- åbninger
- betjenes
- or
- Andet
- vores
- ud
- output
- uden for
- i løbet af
- samlet
- overnight
- oversigt
- Oxygen
- pakker
- pad
- Smerte
- pandaer
- panel
- del
- passerer
- mønstre
- PAWS
- PBS
- Peak
- per
- ydeevne
- udføres
- periode
- perifere
- fase
- fænotype
- fyr
- pipeline
- pixel
- placeret
- Planes
- perron
- platin
- plato
- Platon Data Intelligence
- PlatoData
- plus
- pm
- Punkt
- punkter
- portefølje
- position
- positiv
- Indlæg
- potentiale
- magt
- indledende
- forberedelse
- forberedt
- tilstedeværelse
- forelagt
- bevaret
- tryk
- tidligere
- primære
- Forud
- sonde
- procedurer
- behandle
- bearbejdet
- Processer
- producerer
- Produkter
- korrekt
- egenskaber
- ejendom
- andel
- beskyttelse
- Protein
- protokol
- protokoller
- give
- leverer
- Sweatre & trøjer
- puls
- Python
- R
- rækkevidde
- spænder
- ROTTE
- Sats
- forholdet
- RE
- reaktion
- reaktioner
- klar
- modtagende
- anbefalinger
- registreres
- optagelse
- opsving
- reducere
- Reduceret
- reduktion
- henvisningen
- regenerering
- regimer
- region
- relative
- relevant
- forblive
- Fjern
- fjernet
- fjernelse
- gentaget
- erstatte
- rapporteret
- Rapportering
- repræsentation
- repræsentativt
- forskning
- Modstand
- Løsning
- respekt
- henholdsvis
- svar
- reaktioner
- Resultater
- Tilbageførsel
- gennemgå
- Bånd
- Rich
- højre
- Rise
- River
- Værelse
- Kør
- s
- samme
- scanne
- scripts
- Anden
- sekundær
- Sektion
- sektioner
- sikker
- se
- valgt
- Series
- Serum
- sæt
- flere
- Shape
- vist
- Shows
- side
- Signal
- signaler
- betydning
- signifikant
- Sølv
- samtidigt
- enkelt
- websted
- Websteder
- Størrelse
- hud
- Skub
- Slides
- glidende
- lille
- Snap
- Software
- løsninger
- Lyd
- Kilde
- rumlige
- Højttaler
- højttalere
- specificeret
- specs
- Spektroskopi
- spikes
- Spin
- firkant
- Stabilitet
- stabilisere
- stable
- Rustfrit stål
- standard
- standardiseret
- Starter
- Tilstand
- statistiske
- statistik
- Damp
- stål
- Stem
- Trin
- Steps
- stimulus
- opbevaring
- opbevaret
- lige
- Strategi
- Strip
- stærk
- strukturel
- strukturer
- undersøgelser
- Studere
- subkutan
- efterfølgende
- væsentlig
- sådan
- sum
- overflade
- Kirurgi
- systemet
- T
- Tag
- taget
- mål
- Opgaver
- teknikker
- Teknologier
- midlertidig
- prøve
- tests
- end
- at
- Området
- Fremtiden
- UK
- deres
- derefter
- Der.
- termisk
- de
- denne
- dem
- tre
- tærskel
- Gennem
- hele
- Dermed
- tid
- gange
- tip
- tips
- væv
- Titanium
- til
- TONE
- top
- I alt
- rører
- mod
- spor
- tog
- trans
- overførsel
- overført
- Overførsel
- overgang
- behandlet
- behandling
- behandlinger
- forsøg
- tutorial
- to
- typen
- Uk
- ultralyd
- under
- forståelse
- gennemgik
- indtil
- brug
- anvendte
- ved brug af
- Vacuum
- gyldig
- værdi
- Værdier
- versus
- via
- vivo
- Spænding
- bind
- af
- W
- gå
- gå
- var
- Vand
- we
- uge
- uger
- vejning
- vægt
- Velfærd
- var
- hvornår
- som
- mens
- hvid
- Hele
- vindue
- Tråd
- med
- tilbagetrækning
- uden
- Arbejde
- arbejdede
- arbejder
- X
- røntgen
- zephyrnet