国家药品监督管理局于15年2024月28日发布了《医疗器械真实世界研究设计与统计分析指南》定稿文件。草案版本于2023年XNUMX月XNUMX日发布。
指南的意义
该指南将有利于境外制造商进一步探索海南真实世界数据试点。
海南博鳌试验区允许境外未经批准的具有临床紧急状态的医疗器械、体外诊断器械、药品在国内使用。 制造商在商业化和销售其产品的同时,可以通过海南的RWS收集RWD作为中国当地的临床证据,以支持其国家NMPA注册批准。 这项特别计划可能会将他们的中国市场准入期限缩短至4个月。
海南省政府发布《海南自由贸易港博鳌乐城国际医疗旅游先行区紧急使用进口药品医疗器械管理规定”于28年2023月XNUMX日。该文件称,不需要像国家批准那样进行当地型式试验或重大举证责任。
指南要点
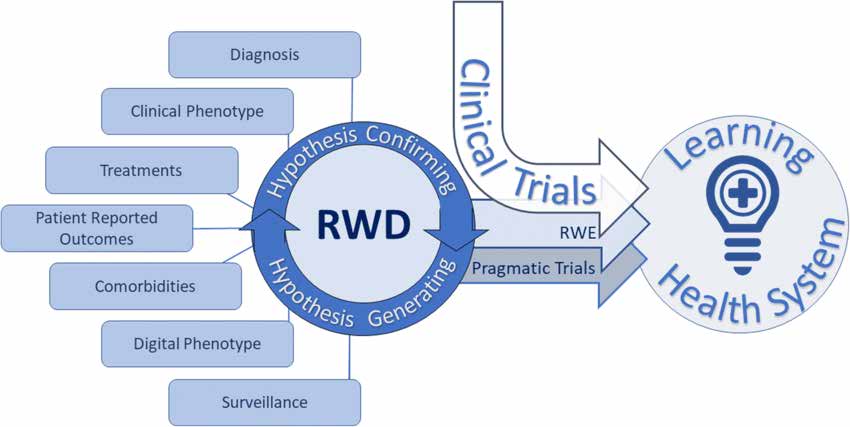
研究设计和统计分析文件描述了不同类型的现实世界研究如下:
实用随机对照试验 (pRCT) 旨在评估真实医疗保健环境中的治疗结果。他们采用随机化和对照组来评估干预效果。 pRCT 提供了高质量的真实世界证据,适用于不同的患者群体和临床场景。
观察性现实世界研究包括各种研究设计:
- 描述性研究设计 描述患者特征或健康状况而不推断因果关系。
- 同类群组设计 根据设备使用情况跟踪不同患者组的结果,并提供前瞻性和回顾性选项。
- 病例对照和衍生设计 比较使用和不使用设备的患者,并包括巢式病例对照和病例队列研究。
- 真实世界数据作为外部控制 尽管缺乏详细的指导方针,但涉及使用真实世界的数据作为对照组。
该文件概述了设计现实世界研究方案的注意事项:
- 背景和目标:根据现有数据确定研究背景、目标以及安全性和有效性问题。
- 可行性评估:评估进行现实世界研究的可行性,考虑数据可用性、质量和混杂变量。
- 选择适当的研究设计:根据目标选择设计,无论是实验性的还是观察性的。
- 研究流程图:创建详细说明研究过程的流程图,包括患者选择、干预和检查。
- 定义研究人群:明确定义研究人群的纳入和排除标准。
- 设备暴露:评估患者如何接触该设备,考虑潜在的偏差。
- 控制组: 确定观察性研究的合适对照组以平衡混杂变量。
- 结果指标:定义结果测量,包括其目的、定义和测量方法。
- 数据收集:开发数据收集表格和词典,明确数据来源、质量信息和链接方法。
- 混杂变量的调整s:识别混杂变量并包含/排除它们并说明原因。
- 随访时间:定义患者随访或观察时间以充分回答研究问题。
- 样本量和功效计算:考虑各种因素,计算样本量和统计功效。
它还强调了质量控制的重要性:
- 数据质量:从代表性、完整性、准确性等方面评估数据质量。
- 偏见风险:描述各个阶段控制偏差风险的措施,包括选择、信息和混杂偏差。
- 偏差评估: 识别不同的偏见类型并评估其方向和程度。
- 伦理审查:确保伦理审查和知情同意符合法规。
两个版本的比较
与草案版本相比,最终文件在统计分析部分提到了“确定需要修改的混杂变量”。
在非随机的现实世界研究设计中,识别混杂变量对于控制偏差至关重要。使用三个标准来识别它们:变量与结果具有因果关系,与分组变量(暴露)相关,并且不是因果路径中的中间变量。推荐的方法涉及基于专业知识和临床经验并与临床和统计专家合作的合理变量选择过程。对于不确定变量,建议进行敏感性分析,提供纳入/排除的原因和支持数据。建议采用保守的变量选择方法,避免不相关的变量,并考虑多重共线性和交互效应等问题,通过有向无环图 (DAG) 可视化。
如需指南的英文版本,请发送电子邮件至 info@ChinaMedDvice.com. 我们收取象征性的翻译费用。
查看 最新消息 海南真实世界数据计划。
查看 沟通指引 与监管机构合作。
查看我们的 录制的网络研讨会 关于海南政策。
- :具有
- :是
- :不是
- 15%
- 2023
- 2024
- 28
- a
- ACCESS
- 无环
- 充分
- 管理
- 建议
- 允许
- 还
- an
- 分析
- 和
- 回答
- 的途径
- 适当
- 批准
- 保健
- AS
- 评估
- 相关
- At
- 当局
- 可用性
- 避免
- 背景
- 当前余额
- 基于
- BE
- 偏见
- 偏见
- 负担
- 计算
- CAN
- 特点
- 充
- 中国
- 明确地
- 临床资料
- 合作
- 收集
- 采集
- COM的
- 执行
- 条件
- 开展
- 同意
- 保守的
- 注意事项
- 考虑
- 控制
- 受控
- 控制
- 控制
- 创建信息图
- 标准
- 关键
- data
- 数据质量
- 定义
- 定义
- 派生
- 描述
- 介绍
- 设计
- 设计
- 设计
- 设计
- 详细
- 详图
- 确定
- 开发
- 设备
- 设备
- 不同
- 针对
- 方向
- 不同
- 文件
- 不
- 草案
- 毒品
- 效用
- 影响
- 邮箱地址
- 强调
- 英语
- 确保
- 伦理
- 评估
- 证据
- 现有
- 体验
- 试验
- 专家
- 探索
- 裸露
- 曝光
- 外部
- 促进
- 因素
- 可行性
- 费用
- 最后
- 敲定
- 以下
- 针对
- 形式
- Free
- 进一步
- 政府
- 图表
- 团队
- 组的
- 方针
- 健康管理
- 医疗保健
- 高品质
- 创新中心
- HTTPS
- 鉴定
- 确定
- 重要性
- in
- 包括
- 包括
- 包含
- 包容
- 信息
- 通知
- 相互作用
- 中级
- 国际
- 介入
- 干预
- 涉及
- 问题
- IT
- 一月
- JPG
- 知识
- 不足
- 领导者
- 喜欢
- 本地
- 制造商
- 三月
- 市场
- 数据监测
- 措施
- 医生
- 医疗装置
- 医疗器械
- 提到
- 方法
- 可能
- 个月
- 更多
- National
- 需求
- 目标
- 观察
- 观察
- of
- on
- 附加选项
- or
- 我们的
- 成果
- 结果
- 大纲
- 海外
- 径
- 病人
- 患者
- 飞行员
- 柏拉图
- 柏拉图数据智能
- 柏拉图数据
- 请
- 政策
- 人口
- 人群
- 潜力
- 功率
- 过程
- 核心产品
- 所以专业
- 曲目
- 证明
- 预期
- 协议
- 提供
- 优
- 出版
- 目的
- 质量
- 有疑问吗?
- 随机化
- 合理的
- 真实
- 真实的世界
- 原因
- 建议
- 注册
- 法规
- 监管
- 关系
- 发布
- 要求
- 研究
- 评论
- 风险
- 实现安全
- 说
- 情景
- 部分
- 选择
- 卖房
- 灵敏度
- 九月
- 设置
- 显著
- 尺寸
- 来源
- 特别
- 实习
- 统计
- Status
- 研究
- 学习
- 合适的
- SUPPORT
- 支持
- 条款
- 测试
- 这
- 其
- 他们
- 他们
- 虽然?
- 三
- 通过
- 时
- 至
- 旅游业
- 跟踪时
- 贸易
- 翻译
- 治疗
- 试验
- 二
- 类型
- 类型
- 不确定
- 急
- 紧急
- 使用
- 用过的
- 运用
- 变量
- 各个
- 版本
- 是
- we
- 是否
- 而
- 将
- 也完全不需要
- 加工
- 世界
- 和风网