16 maj 2023 (Nanowerk Nyheter) En ny studie lägger till en framväxande, radikalt ny bild av hur bakterieceller ständigt reparerar felaktiga delar av sitt DNA. Publicerad i tidskriften Cell (“RNA Polymerase Drives Ribonucleotide Excision DNA Repair in E.coli"), beskriver rapporten den molekylära mekanismen bakom en DNA-reparationsväg som motverkar den felaktiga inkluderingen av en viss typ av molekylär byggsten, ribonukleotider, i genetiska koder. Sådana misstag är vanliga i kodkopieringsprocessen hos bakterier och andra organismer. Med tanke på att felaktig inkorporering av ribonukleotider kan resultera i skadliga DNA-kodförändringar (mutationer) och DNA-avbrott, har alla organismer utvecklats till att ha en DNA-reparationsväg som kallas ribonukleotidexcisionsreparation (RER) som snabbt fixar sådana fel.
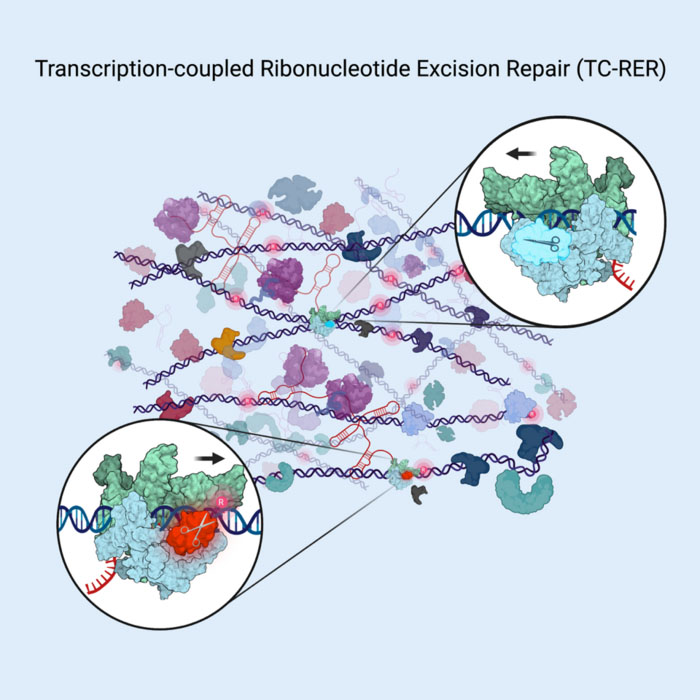 Studieenzymet RNAseHII reparerar DNA genom att åka med på enzymet som läser den genetiska koden, RNA-polymeras, och klippa ut (se sax) felplacerade kodbokstäver när det "ser" dem i bakteriellt genetiskt material. (© Cell Press) Förra året publicerade ett team under ledning av Evgeny Nudler, PhD, Julie Wilson Anderson professor vid institutionen för biokemi och molekylär farmakologi vid NYU Langone Health, två analyser av DNA-reparation i levande E.coli celler. De fann att det mesta av reparationen av vissa typer av DNA-skador (bulkiga lesioner), som de som orsakas av UV-bestrålning, kan inträffa eftersom skadade kodsektioner först har identifierats av en proteinmaskin som kallas RNA-polymeras. RNA-polymeras driver ner DNA-kedjan och läser koden för DNA-”bokstäver” när det transkriberar instruktioner till RNA-molekyler, som sedan styr proteinuppbyggnaden. Nudler och medarbetare fann att under denna transkriptionsprocess hittar RNA-polymeras också DNA-lesioner och fungerar sedan som en plattform för montering av en DNA-reparationsmaskin som kallas nukleotidexcisionsreparationskomplex (NER). NER klipper sedan ut felaktigt DNA som hittats och ersätter det med en korrekt kopia. Utan verkan av RNA-polymeras förekommer lite NER, om någon, i levande bakterier. Nu ger den nya studien i Cell det första beviset på att RER, liksom i NER-vägen, är tätt kopplat till transkription. Studieförfattarna fann bevis för att nyckelenzymet som är involverat i RER, RNaseHII, också samarbetar med RNA-polymeras när det söker efter felinkorporerade ribonukleotider i DNA-kedjorna i levande bakterieceller. "Våra resultat fortsätter att inspirera till ett omtänkande av vissa grundläggande principer inom DNA-reparationsområdet", säger Nudler, även utredare vid Howard Hughes Medical Institute. "Framåt planerar vårt team att undersöka om RNA-polymeras skannar DNA efter alla typer av problem och utlöser reparationer över hela genomet, inte bara i bakterier utan också i mänskliga celler."
Studieenzymet RNAseHII reparerar DNA genom att åka med på enzymet som läser den genetiska koden, RNA-polymeras, och klippa ut (se sax) felplacerade kodbokstäver när det "ser" dem i bakteriellt genetiskt material. (© Cell Press) Förra året publicerade ett team under ledning av Evgeny Nudler, PhD, Julie Wilson Anderson professor vid institutionen för biokemi och molekylär farmakologi vid NYU Langone Health, två analyser av DNA-reparation i levande E.coli celler. De fann att det mesta av reparationen av vissa typer av DNA-skador (bulkiga lesioner), som de som orsakas av UV-bestrålning, kan inträffa eftersom skadade kodsektioner först har identifierats av en proteinmaskin som kallas RNA-polymeras. RNA-polymeras driver ner DNA-kedjan och läser koden för DNA-”bokstäver” när det transkriberar instruktioner till RNA-molekyler, som sedan styr proteinuppbyggnaden. Nudler och medarbetare fann att under denna transkriptionsprocess hittar RNA-polymeras också DNA-lesioner och fungerar sedan som en plattform för montering av en DNA-reparationsmaskin som kallas nukleotidexcisionsreparationskomplex (NER). NER klipper sedan ut felaktigt DNA som hittats och ersätter det med en korrekt kopia. Utan verkan av RNA-polymeras förekommer lite NER, om någon, i levande bakterier. Nu ger den nya studien i Cell det första beviset på att RER, liksom i NER-vägen, är tätt kopplat till transkription. Studieförfattarna fann bevis för att nyckelenzymet som är involverat i RER, RNaseHII, också samarbetar med RNA-polymeras när det söker efter felinkorporerade ribonukleotider i DNA-kedjorna i levande bakterieceller. "Våra resultat fortsätter att inspirera till ett omtänkande av vissa grundläggande principer inom DNA-reparationsområdet", säger Nudler, även utredare vid Howard Hughes Medical Institute. "Framåt planerar vårt team att undersöka om RNA-polymeras skannar DNA efter alla typer av problem och utlöser reparationer över hela genomet, inte bara i bakterier utan också i mänskliga celler."
 Studieenzymet RNAseHII reparerar DNA genom att åka med på enzymet som läser den genetiska koden, RNA-polymeras, och klippa ut (se sax) felplacerade kodbokstäver när det "ser" dem i bakteriellt genetiskt material. (© Cell Press) Förra året publicerade ett team under ledning av Evgeny Nudler, PhD, Julie Wilson Anderson professor vid institutionen för biokemi och molekylär farmakologi vid NYU Langone Health, två analyser av DNA-reparation i levande E.coli celler. De fann att det mesta av reparationen av vissa typer av DNA-skador (bulkiga lesioner), som de som orsakas av UV-bestrålning, kan inträffa eftersom skadade kodsektioner först har identifierats av en proteinmaskin som kallas RNA-polymeras. RNA-polymeras driver ner DNA-kedjan och läser koden för DNA-”bokstäver” när det transkriberar instruktioner till RNA-molekyler, som sedan styr proteinuppbyggnaden. Nudler och medarbetare fann att under denna transkriptionsprocess hittar RNA-polymeras också DNA-lesioner och fungerar sedan som en plattform för montering av en DNA-reparationsmaskin som kallas nukleotidexcisionsreparationskomplex (NER). NER klipper sedan ut felaktigt DNA som hittats och ersätter det med en korrekt kopia. Utan verkan av RNA-polymeras förekommer lite NER, om någon, i levande bakterier. Nu ger den nya studien i Cell det första beviset på att RER, liksom i NER-vägen, är tätt kopplat till transkription. Studieförfattarna fann bevis för att nyckelenzymet som är involverat i RER, RNaseHII, också samarbetar med RNA-polymeras när det söker efter felinkorporerade ribonukleotider i DNA-kedjorna i levande bakterieceller. "Våra resultat fortsätter att inspirera till ett omtänkande av vissa grundläggande principer inom DNA-reparationsområdet", säger Nudler, även utredare vid Howard Hughes Medical Institute. "Framåt planerar vårt team att undersöka om RNA-polymeras skannar DNA efter alla typer av problem och utlöser reparationer över hela genomet, inte bara i bakterier utan också i mänskliga celler."
Studieenzymet RNAseHII reparerar DNA genom att åka med på enzymet som läser den genetiska koden, RNA-polymeras, och klippa ut (se sax) felplacerade kodbokstäver när det "ser" dem i bakteriellt genetiskt material. (© Cell Press) Förra året publicerade ett team under ledning av Evgeny Nudler, PhD, Julie Wilson Anderson professor vid institutionen för biokemi och molekylär farmakologi vid NYU Langone Health, två analyser av DNA-reparation i levande E.coli celler. De fann att det mesta av reparationen av vissa typer av DNA-skador (bulkiga lesioner), som de som orsakas av UV-bestrålning, kan inträffa eftersom skadade kodsektioner först har identifierats av en proteinmaskin som kallas RNA-polymeras. RNA-polymeras driver ner DNA-kedjan och läser koden för DNA-”bokstäver” när det transkriberar instruktioner till RNA-molekyler, som sedan styr proteinuppbyggnaden. Nudler och medarbetare fann att under denna transkriptionsprocess hittar RNA-polymeras också DNA-lesioner och fungerar sedan som en plattform för montering av en DNA-reparationsmaskin som kallas nukleotidexcisionsreparationskomplex (NER). NER klipper sedan ut felaktigt DNA som hittats och ersätter det med en korrekt kopia. Utan verkan av RNA-polymeras förekommer lite NER, om någon, i levande bakterier. Nu ger den nya studien i Cell det första beviset på att RER, liksom i NER-vägen, är tätt kopplat till transkription. Studieförfattarna fann bevis för att nyckelenzymet som är involverat i RER, RNaseHII, också samarbetar med RNA-polymeras när det söker efter felinkorporerade ribonukleotider i DNA-kedjorna i levande bakterieceller. "Våra resultat fortsätter att inspirera till ett omtänkande av vissa grundläggande principer inom DNA-reparationsområdet", säger Nudler, även utredare vid Howard Hughes Medical Institute. "Framåt planerar vårt team att undersöka om RNA-polymeras skannar DNA efter alla typer av problem och utlöser reparationer över hela genomet, inte bara i bakterier utan också i mänskliga celler."
Spjutspetstekniker
Ribonukleotider (byggstenarna i RNA) och deoxiribonukleotider (DNA-komponenter) är besläktade föreningar. När celler kopierar och bygger DNA-kedjor i bakterieceller, införlivar de ofta av misstag ribonukleotider i DNA-kedjor i stället för deoxiribonukleotider eftersom de skiljer sig åt med endast en enda syreatom, säger studieförfattarna. I bakterieceller är det känt att DNA-polymeras III gör cirka 2,000 2022 av dessa misstag varje gång det kopierar en cells genetiska material. För att upprätthålla genomets integritet avlägsnas huvuddelen av felplacerade ribonukleotider av RER-vägen, men en nyckelfråga hade handlat om hur RNaseHII hittar relativt sällsynta ribonukleotidlesioner mitt i ett "hav" av intakta cellulära DNA-koder så snabbt. Som de gjorde i sina XNUMX-studier använde forskarna kvantitativ masspektrometri och in vivo protein-protein-tvärbindning för att kartlägga avstånden mellan kemiskt länkade proteiner, och så bestämde de nyckelytorna för RNaseHII och RNA-polymeras när de interagerar i levande bakterieceller. På detta sätt bestämde de att de flesta RNaseHII-molekyler kopplar ihop med RNA-polymeras. Dessutom använde de kryogen elektronmikroskopi (CryoEM) för att fånga högupplösta strukturer av RNaseHII bundet till RNA-polymeras för att avslöja protein-protein-interaktionerna som definierar RER-komplexet. Vidare äventyrade strukturstyrda genetiska experiment som försvagade RNA-polymeras/RNaseHII-interaktionen RER. "Detta arbete stöder en modell där RNaseHII skannar DNA efter felplacerade ribonukleotider genom att rida på RNA-polymeras medan det rör sig längs DNA," säger första studieförfattaren Zhitai Hao, en postdoktor vid Nudlers labb. "Detta arbete är avgörande för vår grundläggande förståelse av DNA-reparationsprocessen och har långtgående kliniska implikationer."- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoAiStream. Web3 Data Intelligence. Kunskap förstärkt. Tillgång här.
- Minting the Future med Adryenn Ashley. Tillgång här.
- Köp och sälj aktier i PRE-IPO-företag med PREIPO®. Tillgång här.
- Källa: https://www.nanowerk.com/news2/biotech/newsid=63002.php
- : har
- :är
- :inte
- :var
- 000
- 10
- 11
- 12
- 2022
- 2023
- 7
- 9
- a
- Om Oss
- exakt
- Handling
- Dessutom
- Lägger
- Alla
- längs
- också
- mitt i
- an
- och
- vilken som helst
- ÄR
- AS
- Montage
- At
- atomen
- Författaren
- Författarna
- Bakterier
- grundläggande
- därför att
- varit
- bakom
- mellan
- Blockera
- Block
- bunden
- raster
- SLUTRESULTAT
- Byggnad
- men
- by
- kallas
- KAN
- fånga
- orsakas
- Celler
- Centrum
- vissa
- kedja
- kedjor
- Förändringar
- Klinisk
- koda
- komplex
- komponenter
- Äventyras
- kontinuerligt
- fortsätta
- kopior
- räknare
- Par
- kopplad
- kryogen
- skärning
- Datum
- Avdelning
- bestämd
- DID
- skilja sig
- rikta
- DNA-
- ner
- under
- kant
- smärgel
- fel
- Varje
- bevis
- utvecklats
- experiment
- långtgående
- defekt
- fält
- fynd
- Förnamn
- För
- Framåt
- hittade
- frekvent
- ytterligare
- Genome
- ges
- hade
- Har
- Hälsa
- hög upplösning
- Hur ser din drömresa ut
- HTTPS
- humant
- identifierade
- if
- bild
- implikationer
- in
- integration
- införliva
- inspirerar
- Institute
- instruktioner
- integritet
- interagera
- interaktion
- interaktioner
- in
- undersöka
- involverade
- IT
- tidskriften
- jpg
- Nyckel
- känd
- lab
- Efternamn
- Förra året
- Led
- tycka om
- kopplade
- liten
- levande
- Maskinen
- bibehålla
- göra
- karta
- Massa
- Materialet
- mekanism
- medicinsk
- Mikroskopi
- Mitten
- felplacerad
- misstag
- modell
- molekylär
- mest
- Motorer
- förflyttar
- Nya
- nu
- NYU
- of
- Ofta
- on
- endast
- Övriga
- vår
- ut
- Syrgas
- partner
- Bild
- Plats
- planer
- plattform
- plato
- Platon Data Intelligence
- PlatonData
- tryck
- Principerna
- problem
- process
- Professor
- Protein
- Proteiner
- ger
- publicerade
- kvantitativ
- fråga
- snabbt
- radikalt
- SÄLLSYNT
- Läsning
- relaterad
- relativt
- avlägsnas
- reparation
- rapport
- forskare
- resultera
- Resultat
- avslöjar
- rider
- RNA
- säga
- säger
- sektioner
- se
- serverar
- enda
- So
- studier
- Läsa på
- sådana
- Stöder
- grupp
- den där
- Smakämnen
- deras
- Dem
- sedan
- Dessa
- de
- detta
- de
- tätt
- tid
- till
- två
- Typ
- typer
- förståelse
- Begagnade
- avgörande
- lever
- Sätt..
- VÄL
- när
- om
- som
- medan
- Wilson
- med
- utan
- Arbete
- år
- zephyrnet