16. januar 2024
(Nanowerk novice) Ključna kemična reakcija – pri kateri gibanje protonov med površino elektrode in elektrolita poganja električni tok – je kritičen korak v številnih energetskih tehnologijah, vključno z gorivnimi celicami in elektrolizerji, ki se uporabljajo za proizvodnjo vodikovega plina. Prvič so kemiki MIT podrobno začrtali, kako se ti s protonom sklopljeni prenosi elektronov zgodijo na površini elektrode. Njihovi rezultati bi lahko raziskovalcem pomagali oblikovati učinkovitejše gorivne celice, baterije ali druge energetske tehnologije. "Naš napredek v tem dokumentu je bil preučevanje in razumevanje narave, kako se ti elektroni in protoni spajajo na površini, kar je pomembno za katalitične reakcije, ki so pomembne v kontekstu naprav za pretvorbo energije ali katalitskih reakcij," pravi Yogesh Surendranath, profesor kemije in kemijskega inženirstva na MIT in višji avtor študije. Med njihovimi ugotovitvami so raziskovalci lahko natančno izsledili, kako spremembe v pH raztopine elektrolita, ki obdaja elektrodo, vplivajo na hitrost gibanja protonov in pretok elektronov znotraj elektrode. Podiplomski študent MIT Noah Lewis je glavni avtor prispevka, ki je danes objavljen v Naravna kemija ("Mehanistični okvir na molekularni ravni za medfazno kinetiko prenosa protonov sklopljenih elektronov"). Ryan Bisbey, nekdanji podoktor MIT; Karl Westendorff, podiplomski študent MIT; in Alexander Soudackov, raziskovalec na univerzi Yale, sta tudi avtorja prispevka.
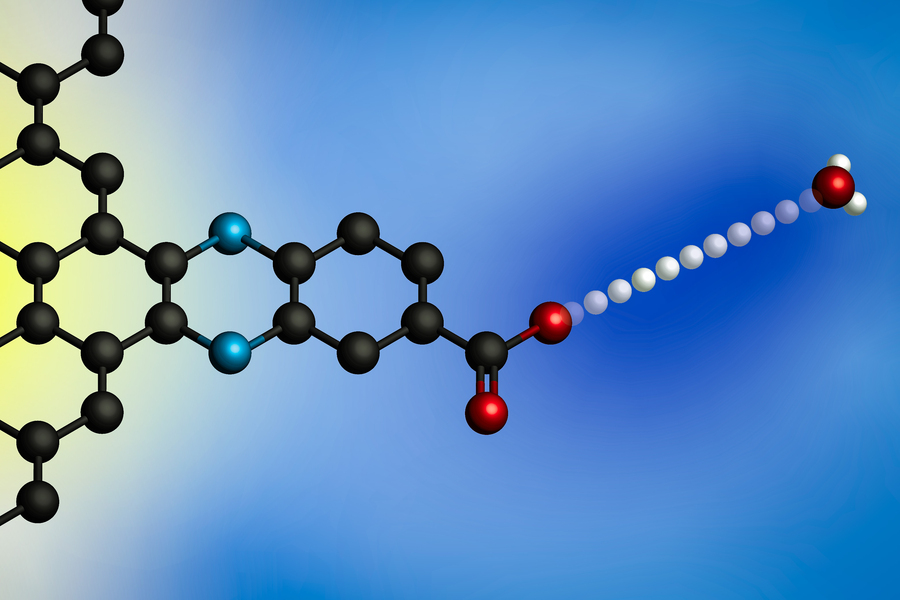 Uporaba električnega potenciala povzroči prenos protona iz hidronijevega iona (na desni) na površino elektrode. Z uporabo elektrod z molekularno definiranimi mesti za vezavo protonov so raziskovalci MIT razvili splošen model za te medfazne reakcije prenosa elektronov, povezanih s protonom. (Slika: z dovoljenjem raziskovalcev)
Uporaba električnega potenciala povzroči prenos protona iz hidronijevega iona (na desni) na površino elektrode. Z uporabo elektrod z molekularno definiranimi mesti za vezavo protonov so raziskovalci MIT razvili splošen model za te medfazne reakcije prenosa elektronov, povezanih s protonom. (Slika: z dovoljenjem raziskovalcev)
 Uporaba električnega potenciala povzroči prenos protona iz hidronijevega iona (na desni) na površino elektrode. Z uporabo elektrod z molekularno definiranimi mesti za vezavo protonov so raziskovalci MIT razvili splošen model za te medfazne reakcije prenosa elektronov, povezanih s protonom. (Slika: z dovoljenjem raziskovalcev)
Uporaba električnega potenciala povzroči prenos protona iz hidronijevega iona (na desni) na površino elektrode. Z uporabo elektrod z molekularno definiranimi mesti za vezavo protonov so raziskovalci MIT razvili splošen model za te medfazne reakcije prenosa elektronov, povezanih s protonom. (Slika: z dovoljenjem raziskovalcev)
Prehajajoči protoni
S protonom sklopljeni prenos elektronov se zgodi, ko molekula, pogosto voda ali kislina, prenese proton na drugo molekulo ali na površino elektrode, kar spodbudi akceptor protona, da prav tako prevzame elektron. Ta vrsta reakcije je bila uporabljena za številne energetske aplikacije. »Te protonsko sklopljene reakcije prenosa elektronov so vseprisotne. Pogosto so ključni koraki v katalitičnih mehanizmih in so še posebej pomembni za procese pretvorbe energije, kot je proizvodnja vodika ali kataliza gorivnih celic,« pravi Surendranath. V elektrolizerju za proizvodnjo vodika se ta pristop uporablja za odstranjevanje protonov iz vode in dodajanje elektronov protonom, da nastane vodikov plin. V gorivni celici električna energija nastane, ko se protoni in elektroni odstranijo iz vodikovega plina in dodajo kisiku, da nastane voda. Protonsko sklopljeni prenos elektronov je običajen pri mnogih drugih vrstah kemičnih reakcij, na primer pri redukciji ogljikovega dioksida (pretvorba ogljikovega dioksida v kemična goriva z dodajanjem elektronov in protonov). Znanstveniki so se naučili veliko o tem, kako te reakcije potekajo, ko so akceptorji protonov molekule, saj lahko natančno nadzorujejo strukturo vsake molekule in opazujejo, kako elektroni in protoni prehajajo med njimi. Vendar, ko pride do protonsko sklopljenega prenosa elektronov na površini elektrode, je proces veliko težje preučiti, ker so površine elektrod običajno zelo heterogene, z veliko različnimi mesti, na katera bi se proton lahko vezal. Da bi premagali to oviro, je skupina MIT razvila način za oblikovanje površin elektrod, ki jim daje veliko natančnejši nadzor nad sestavo površine elektrod. Njihove elektrode so sestavljene iz listov grafena z organskimi spojinami, ki vsebujejo obroče, pritrjenimi na površino. Na koncu vsake od teh organskih molekul je negativno nabit kisikov ion, ki lahko sprejme protone iz okoliške raztopine, kar povzroči, da elektron teče iz vezja v grafitno površino. "Ustvarimo lahko elektrodo, ki ni sestavljena iz velike raznolikosti mest, temveč je enoten niz ene same vrste zelo dobro definiranih mest, ki lahko vsako vežejo proton z enako afiniteto," pravi Surendranath. "Ker imamo ta zelo dobro definirana mesta, nam je to omogočilo, da smo resnično razvozlali kinetiko teh procesov." Z uporabo tega sistema so raziskovalci lahko izmerili pretok električnega toka do elektrod, kar jim je omogočilo izračun hitrosti prenosa protona do kisikovega iona na površini v ravnovesju – stanju, ko je stopnja darovanja protonov površini in prenos protona nazaj v raztopino s površine sta enaka. Ugotovili so, da pH okoliške raztopine pomembno vpliva na to stopnjo: najvišje stopnje so se pojavile na skrajnih koncih lestvice pH - pH 0, najbolj kisel, in pH 14, najbolj bazičen. Za razlago teh rezultatov so raziskovalci razvili model, ki temelji na dveh možnih reakcijah, ki se lahko pojavita na elektrodi. 3O+), ki so v visoki koncentraciji v močno kislih raztopinah, prenašajo protone na površinske kisikove ione, pri čemer nastane voda. V drugem primeru voda prenaša protone na površinske kisikove ione, pri čemer nastajajo hidroksidni ioni (OH-), ki so v visoki koncentraciji v močno bazičnih raztopinah. Vendar pa je hitrost pri pH 0 približno štirikrat hitrejša od hitrosti pri pH 14, deloma zato, ker hidronij oddaja protone hitreje kot voda.Reakcija za premislek
Raziskovalci so na svoje presenečenje tudi odkrili, da imata reakciji enaki hitrosti, ne pri nevtralnem pH 7, kjer sta koncentraciji hidronija in hidroksida enaki, ampak pri pH 10, kjer je koncentracija hidroksidnih ionov 1 milijonkrat večja od koncentracije hidronija. Model nakazuje, da je to zato, ker napredna reakcija, ki vključuje darovanje protona iz hidronija ali vode, prispeva več k skupni hitrosti kot povratna reakcija, ki vključuje odstranitev protona z vodo ali hidroksidom. Obstoječi modeli o tem, kako te reakcije potekajo na površinah elektrod, predpostavljajo, da reakcije naprej in nazaj enako prispevajo k skupni hitrosti, zato nove ugotovitve kažejo, da bo te modele morda treba ponovno preučiti, pravijo raziskovalci. "To je privzeta predpostavka, da reakcija naprej in nazaj enako prispevata k hitrosti reakcije," pravi Surendranath. "Naša ugotovitev je resnično zanimiva, ker pomeni, da je predpostavka, ki jo ljudje uporabljajo za analizo vsega, od katalize gorivnih celic do razvoja vodika, morda nekaj, kar moramo ponovno pregledati." Raziskovalci zdaj uporabljajo svoje eksperimentalne nastavitve, da bi preučili, kako lahko dodajanje različnih vrst ionov v raztopino elektrolita, ki obdaja elektrodo, pospeši ali upočasni hitrost pretoka elektronov, povezanih s protonom. »Z našim sistemom vemo, da so naša mesta stalna in ne vplivajo druga na drugo, zato lahko preberemo, kaj sprememba rešitve vpliva na reakcijo na površini,« pravi Lewis.- Distribucija vsebine in PR s pomočjo SEO. Okrepite se še danes.
- PlatoData.Network Vertical Generative Ai. Opolnomočite se. Dostopite tukaj.
- PlatoAiStream. Web3 Intelligence. Razširjeno znanje. Dostopite tukaj.
- PlatoESG. Ogljik, CleanTech, Energija, Okolje, sončna energija, Ravnanje z odpadki. Dostopite tukaj.
- PlatoHealth. Obveščanje o biotehnologiji in kliničnih preskušanjih. Dostopite tukaj.
- vir: https://www.nanowerk.com/news2/green/newsid=64425.php
- :ima
- : je
- :ne
- :kje
- $GOR
- 1
- 10
- 11
- 13
- 14
- 16
- 7
- 8
- a
- Sposobna
- O meni
- Sprejmi
- dodajte
- dodano
- dodajanje
- napredovanje
- vplivajo
- vplivajo
- Alexander
- dovoljene
- Prav tako
- med
- an
- analizirati
- in
- Še ena
- se prikaže
- aplikacije
- Uporaba
- pristop
- SE
- Array
- AS
- domnevati
- predpostavka
- At
- Avtor
- Avtorji
- nazaj
- temeljijo
- Osnovni
- baterije
- BE
- ker
- bilo
- med
- vežejo
- zavezujoče
- vendar
- by
- izračun
- CAN
- ogljika
- ogljikov dioksid
- vzroki
- celica
- Celice
- center
- spremenite
- Spremembe
- zaračuna
- kemijske
- kemija
- Kemiki
- Skupno
- sestava
- koncentracija
- stalna
- ozadje
- prispevajo
- prispeva
- nadzor
- Pretvorba
- bi
- par
- ustvarjajo
- kritično
- Trenutna
- Datum
- ponudba
- privzeto
- opredeljen
- poda
- daje
- Oblikovanje
- Podatki
- razvili
- naprave
- drugačen
- težko
- odkril
- raznolikost
- do
- Ne
- tem
- darovanje
- navzdol
- diski
- vsak
- učinek
- učinkovite
- električni
- elektrika
- elektrolit
- elektronov
- konec
- konča
- energija
- Inženiring
- enako
- enako
- Equilibrium
- Eter (ETH)
- vse
- evolucija
- točno
- Primer
- obstoječih
- eksperimentalni
- Pojasnite
- ekstremna
- hitreje
- iskanje
- Ugotovitve
- prva
- prvič
- Pretok
- za
- obrazec
- Nekdanji
- Naprej
- je pokazala,
- štiri
- Okvirni
- iz
- gorivo
- gorivne celice
- goriv
- GAS
- splošno
- ustvarila
- ustvarjajo
- generacija
- daje
- diplomiral
- Grafen
- veliko
- se zgodi
- izkoriščen
- Imajo
- Srce
- pomoč
- visoka
- najvišja
- Kako
- Vendar
- HTTPS
- vodik
- slika
- Pomembno
- in
- Vključno
- v
- vključujejo
- IT
- jpg
- karl
- Ključne
- Otrok
- Vedite
- vodi
- naučili
- Lewis
- več
- Maj ..
- pomeni
- merjenje
- Mehanizmi
- Bližnji
- milijonov
- MIT
- Diplomiral na MIT
- Model
- modeli
- molekula
- več
- učinkovitejše
- Najbolj
- motion
- Gibanje
- veliko
- Narava
- Nimate
- negativno
- Nevtralna
- Novo
- Noah
- zdaj
- opazujejo
- ovira
- pojavijo
- zgodilo
- of
- pogosto
- on
- or
- organsko
- Ostalo
- naši
- ven
- več
- Splošni
- Premagajte
- Kisik
- Papir
- del
- zlasti
- mimo
- ljudje
- platon
- Platonova podatkovna inteligenca
- PlatoData
- mogoče
- potencial
- potencialno
- natančna
- Ravno
- Postopek
- Procesi
- proizvodnjo
- Učitelj
- protoni
- Oceniti
- Cene
- reakcija
- reakcije
- Preberi
- res
- Zmanjšanje
- pomembno
- odstranitev
- odstrani
- Odstranjeno
- Obnovljivi viri
- obnovljiva energija
- Raziskave
- raziskovalci
- Rezultati
- Razkrije
- nazaj
- Pravica
- Ryan
- s
- Enako
- pravijo,
- pravi
- Lestvica
- Znanstvenik
- Znanstveniki
- drugi
- višji
- nastavitev
- pomemben
- sam
- spletna stran
- Spletna mesta
- počasi
- So
- Rešitev
- rešitve
- Nekaj
- hitrost
- Država
- Korak
- Koraki
- spodbuja
- Močno
- Struktura
- študent
- študija
- Študij
- taka
- predlagajte
- Predlaga
- Površina
- presenečenje
- Okolica
- sistem
- Bodite
- skupina
- Tehnologije
- kot
- da
- O
- Država
- njihove
- Njih
- te
- jih
- ta
- tisti,
- čas
- krat
- do
- danes
- sledenje
- prenos
- transferji
- dva
- tip
- Vrste
- povsod
- razumevanje
- univerza
- razpletla
- us
- Rabljeni
- uporabo
- navadno
- zelo
- je
- Voda
- način..
- we
- dobro opredeljen
- so bili
- Kaj
- kdaj
- ki
- široka
- z
- v
- zefirnet