NMPA je 15. januarja 2024 objavila končni dokument »Guideline on Medical Device Real-world Study Design and Statistical Analysis« 28. januarja 2023. Osnutek različice je bil objavljen XNUMX. septembra XNUMX.
Pomen smernice
Smernice bodo čezmorskim proizvajalcem olajšale nadaljnje raziskovanje pilotnega programa Hainan Real-world Data.
Pilotno območje Hainan Boao dovoljuje uporabo čezmorskih neodobrenih medicinskih pripomočkov, IVD-jev, zdravil s statusom klinične nujnosti na Kitajskem. Medtem ko komercializirajo in prodajajo svoje izdelke, lahko proizvajalci zbirajo RWD prek RWS v Hainanu kot lokalne klinične dokaze na Kitajskem v podporo svoji nacionalni odobritvi registracije NMPA. Poseben program bi jim lahko skrajšal dostop do kitajskega trga na 4 mesece.
Vlada Hainana je izdala "Predpisi o upravljanju uvoženih zdravil in medicinskih pripomočkov za nujno uporabo v mednarodnem pilotnem območju medicinskega turizma Boao Lecheng v prostotrgovinskem pristanišču Hainan” dne 28. marca 2023. Dokument pravi, da NE zahteva lokalnega tipskega testiranja ali pomembnega dokaznega bremena kot nacionalna odobritev.
Poudarki smernice
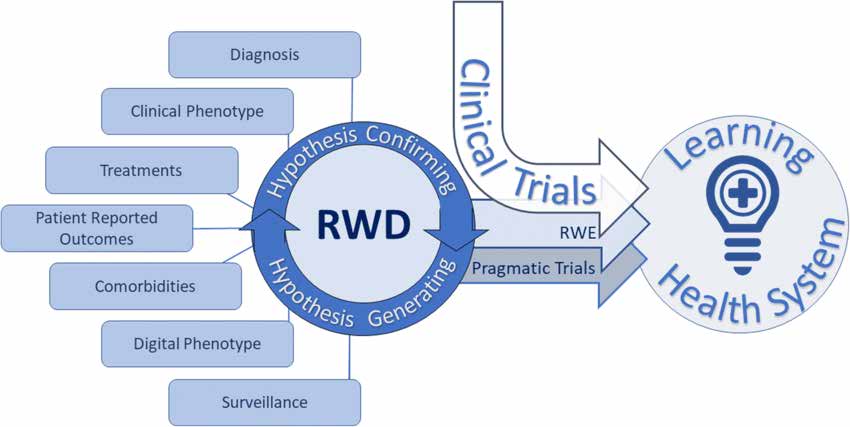
Dokument o zasnovi študije in statistični analizi opisuje različne vrste raziskav v resničnem svetu, kot sledi:
Pragmatična randomizirana kontrolirana preskušanja (pRCT) so zasnovana za ocenjevanje rezultatov zdravljenja v resničnem zdravstvenem okolju. Za ocenjevanje učinkovitosti intervencije uporabljajo randomizacijo in kontrolne skupine. PRCT zagotavljajo visokokakovostne dokaze iz resničnega sveta in so primerni za različne populacije bolnikov in klinične scenarije.
Opazovalne raziskave resničnega sveta vključujejo različne načrte študij:
- Opisni študijski načrti opisujejo pacientove značilnosti ali zdravstveno stanje brez sklepanja o vzročnosti.
- Kohortni modeli spremljanje rezultatov v različnih skupinah bolnikov glede na uporabo pripomočka, s prospektivnimi in retrospektivnimi možnostmi.
- Case-Control in izpeljane zasnove primerjati bolnike z in brez uporabe pripomočka ter vključiti ugnezdene študije primerov in kohort.
- Podatki iz resničnega sveta kot zunanji nadzor vključujejo uporabo podatkov iz resničnega sveta kot kontrolne skupine, čeprav manjkajo podrobne smernice.
Dokument opisuje premisleke pri oblikovanju raziskovalnih protokolov v resničnem svetu:
- Ozadje in cilji: Določite ozadje raziskave, cilje ter vprašanja varnosti in učinkovitosti na podlagi obstoječih podatkov.
- Ocena izvedljivosti: Ocenite izvedljivost izvajanja raziskav v resničnem svetu ob upoštevanju razpoložljivosti podatkov, kakovosti in zmedenih spremenljivk.
- Izberite ustrezno raziskovalno zasnovo: Izberite načrt na podlagi ciljev, bodisi eksperimentalnih ali opazovalnih.
- Diagram poteka študija: Ustvarite diagram poteka, ki podrobno opisuje študijski proces, vključno z izbiro pacientov, posegi in pregledi.
- Opredelitev študijske populacije: Jasno opredelite vključitvena in izključitvena merila za študijsko populacijo.
- Izpostavljenost naprave: Ocenite, kako so bolniki izpostavljeni napravi, ob upoštevanju možnih pristranskosti.
- Nadzorna skupina: Določite ustrezne kontrolne skupine za opazovalne študije, da uravnotežite moteče spremenljivke.
- Izidni ukrepi: Opredelitev meril rezultatov, vključno z njihovim namenom, opredelitvijo in metodami merjenja.
- Zbiranje podatkov: Razviti obrazce za zbiranje podatkov in slovarje, ki določajo vire podatkov, informacije o kakovosti in metode povezovanja.
- Prilagoditev za motečo spremenljivkos: Identificirajte moteče spremenljivke in jih vključite/izključite z razlogi.
- Čas spremljanja: Določite čas spremljanja pacienta ali opazovanja, da boste ustrezno odgovorili na raziskovalna vprašanja.
- Velikost vzorca in izračun moči: Izračunajte velikost vzorca in statistično moč ob upoštevanju različnih dejavnikov.
Poudarja tudi pomen nadzora kakovosti:
- Kakovost podatkov: Ocenite kakovost podatkov v smislu reprezentativnosti, popolnosti, točnosti itd.
- Tveganje pristranskosti: Opišite ukrepe za nadzor tveganj pristranskosti na različnih stopnjah, vključno z izbiro, informacijami in zmedenimi pristranskostmi.
- Ocena pristranskosti: Prepoznajte različne vrste pristranskosti ter ocenite njihovo smer in velikost.
- Etični pregled: Zagotovite, da so etični pregledi in informirano soglasje v skladu s predpisi.
Primerjava dveh različic
V primerjavi z osnutkom različice končni dokument omenja "Določanje zmedenih spremenljivk, ki jih je treba spremeniti" v razdelku Statistična analiza.
Pri nerandomiziranih načrtih raziskav v resničnem svetu je prepoznavanje zmedenih spremenljivk ključnega pomena za nadzor pristranskosti. Za njihovo identifikacijo se uporabljajo trije kriteriji: spremenljivka je vzročno povezana z izidom, je povezana s spremenljivko združevanja (izpostavljenost) in ni vmesna spremenljivka na vzročni poti. Priporočeni pristop vključuje racionalen postopek izbire spremenljivk, ki temelji na strokovnem znanju in kliničnih izkušnjah, v sodelovanju s kliničnimi in statističnimi strokovnjaki. Za negotove spremenljivke je predlagana analiza občutljivosti z navedbo razlogov in podpornih podatkov za vključitev/izključitev. Priporočljiv je konzervativen pristop k izbiri spremenljivk, izogibanje nepovezanim spremenljivkam in upoštevanje vprašanj, kot so multikolinearnost in interakcijski učinki, vizualizirani prek usmerjenih acikličnih grafov (DAG).
Za angleško kopijo smernic pošljite e-pošto info@ChinaMedDvice.com. Zaračunavamo nominalne stroške prevoda.
Poglej zadnje novice v programu Hainan Real World Data.
Poglej komunikacijsko smernico delo z regulativnimi organi.
Oglejte si naš posnet webinar o politiki Hainana.
- Distribucija vsebine in PR s pomočjo SEO. Okrepite se še danes.
- PlatoData.Network Vertical Generative Ai. Opolnomočite se. Dostopite tukaj.
- PlatoAiStream. Web3 Intelligence. Razširjeno znanje. Dostopite tukaj.
- PlatoESG. Ogljik, CleanTech, Energija, Okolje, sončna energija, Ravnanje z odpadki. Dostopite tukaj.
- PlatoHealth. Obveščanje o biotehnologiji in kliničnih preskušanjih. Dostopite tukaj.
- vir: https://chinameddevice.com/real-world-study-nmpa/
- :ima
- : je
- :ne
- 15%
- 2023
- 2024
- 28
- a
- dostop
- natančnost
- aciklični
- ustrezno
- uprava
- svetuje
- omogoča
- Prav tako
- an
- Analiza
- in
- odgovor
- pristop
- primerno
- odobritev
- SE
- AS
- oceniti
- povezan
- At
- Organi
- razpoložljivost
- izogibanje
- ozadje
- Ravnovesje
- temeljijo
- BE
- pristranskosti
- pristranskosti
- obremenitev
- izračun
- CAN
- lastnosti
- naboj
- Kitajska
- Izberite
- jasno
- klinični
- sodelovanje
- zbiranje
- zbirka
- COM
- izpolnjujejo
- Pogoji
- vodenje
- Soglasje
- konzervativni
- premislekov
- upoštevamo
- nadzor
- nadzorom
- nadzor
- Nadzor
- ustvarjajo
- Merila
- ključnega pomena
- datum
- kakovosti podatkov
- opredeliti
- opredelitev
- Izpeljano
- opisati
- opisuje
- Oblikovanje
- zasnovan
- oblikovanje
- modeli
- podrobno
- Podrobnosti
- Ugotovite,
- Razvoj
- naprava
- naprave
- drugačen
- usmerjen
- smer
- razne
- dokument
- ne
- Osnutek
- Droge
- učinkovitost
- Učinki
- E-naslov
- poudarja
- Angleščina
- zagotovitev
- etično
- oceniti
- dokazi
- obstoječih
- izkušnje
- eksperimentalni
- Strokovnjaki
- raziskuje
- izpostavljena
- Izpostavljenost
- zunanja
- olajšati
- dejavniki
- izvedljivost
- pristojbine
- končna
- dokončano
- po
- za
- Obrazci
- brezplačno
- nadalje
- vlada
- grafi
- skupina
- Skupine
- Smernice
- Zdravje
- zdravstveno varstvo
- visoka kvaliteta
- Kako
- HTTPS
- identificirati
- identifikacijo
- Pomembnost
- in
- vključujejo
- vključuje
- Vključno
- vključitev
- Podatki
- obvestila
- interakcije
- Vmesna
- Facebook Global
- intervencije
- intervencije
- vključuje
- Vprašanja
- IT
- januar
- jpg
- znanje
- primanjkuje
- Vodja
- kot
- lokalna
- Proizvajalci
- marec
- Tržna
- Merjenje
- ukrepe
- medicinski
- medicinski pripomoček
- medicinske naprave
- omenja
- Metode
- morda
- mesecev
- več
- nacionalni
- Nimate
- Cilji
- Opazovanje
- opazovalni
- of
- on
- možnosti
- or
- naši
- Rezultat
- rezultatov
- obrisi
- tujini
- pot
- Bolnik
- bolniki
- pilot
- platon
- Platonova podatkovna inteligenca
- PlatoData
- prosim
- politike
- prebivalstvo
- prebivalstva
- potencial
- moč
- Postopek
- Izdelki
- strokovni
- Program
- dokazilo
- prihodnosti
- protokoli
- zagotavljajo
- zagotavljanje
- objavljeno
- Namen
- kakovost
- vprašanja
- Naključno
- Rational
- pravo
- resnični svet
- Razlogi
- priporočeno
- registracija
- predpisi
- regulatorni
- Razmerje
- sprosti
- zahteva
- Raziskave
- Mnenja
- tveganja
- Varnost
- pravi
- scenariji
- Oddelek
- izbor
- Prodaja
- občutljivost
- september
- nastavitve
- pomemben
- Velikosti
- Viri
- posebna
- postopka
- Statistično
- Status
- Študije
- študija
- primerna
- podpora
- Podpora
- Pogoji
- Testiranje
- da
- O
- njihove
- Njih
- jih
- čeprav?
- 3
- skozi
- krat
- do
- Turizem
- sledenje
- trgovini
- prevod
- Zdravljenje
- poskusi
- dva
- tip
- Vrste
- Negotov
- nujnost
- nujno
- uporaba
- Rabljeni
- uporabo
- spremenljivka
- različnih
- različica
- je
- we
- ali
- medtem
- bo
- z
- brez
- deluje
- svet
- zefirnet