Лечение онкологических больных лучами пространственно-модулированного излучения может разрушить опухоли, сводя к минимуму повреждение близлежащих органов и здоровых тканей. В этом заключается идея протонной минилучевой лучевой терапии (pMBRT), новой методики лечения, в которой для доставки терапевтической дозы используется массив субмиллиметровых пучков излучения.
Мини-лучи состоят из чередующихся пиков высокой дозы и долины низкой дозы, что менее вредно для здоровых тканей на малых глубинах. На больших глубинах эти лучи постепенно расширяются, создавая однородное распределение дозы в целевом объеме. Исследования на мелких животных показали, что pMBRT может существенно уменьшить нормальную токсичность тканейпризывают эквивалентный или превосходный контроль опухоли, по сравнению с традиционной протонной терапией.
«Протонная минилучевая лучевая терапия уже продемонстрировала значительный прирост терапевтического индекса в доклинических исследованиях», — говорится в сообщении. Рамон Ортис от Институт Кюри. «Эти многообещающие результаты способствуют внедрению этой техники в клиническую практику». С этой целью Ортис (теперь в Калифорнийском университете в Сан-Франциско) и его коллеги из Института Кюри оценили преимущества pMBRT для лечения метастазов рака и сообщили о своих выводах в Медицинская физика.
Моделирование сценариев pMBRT
Метастатические заболевания являются причиной до 90% смертей от рака. Метастазы обычно лечат с помощью методов стереотаксической лучевой терапии (СРТ), но доза, необходимая для местного контроля, часто ограничена риском токсичности для близлежащих нормальных тканей. Например, при метастазах в головной мозг радиационно-индуцированный некроз головного мозга сообщается у половины пациентов, получавших СРТ.
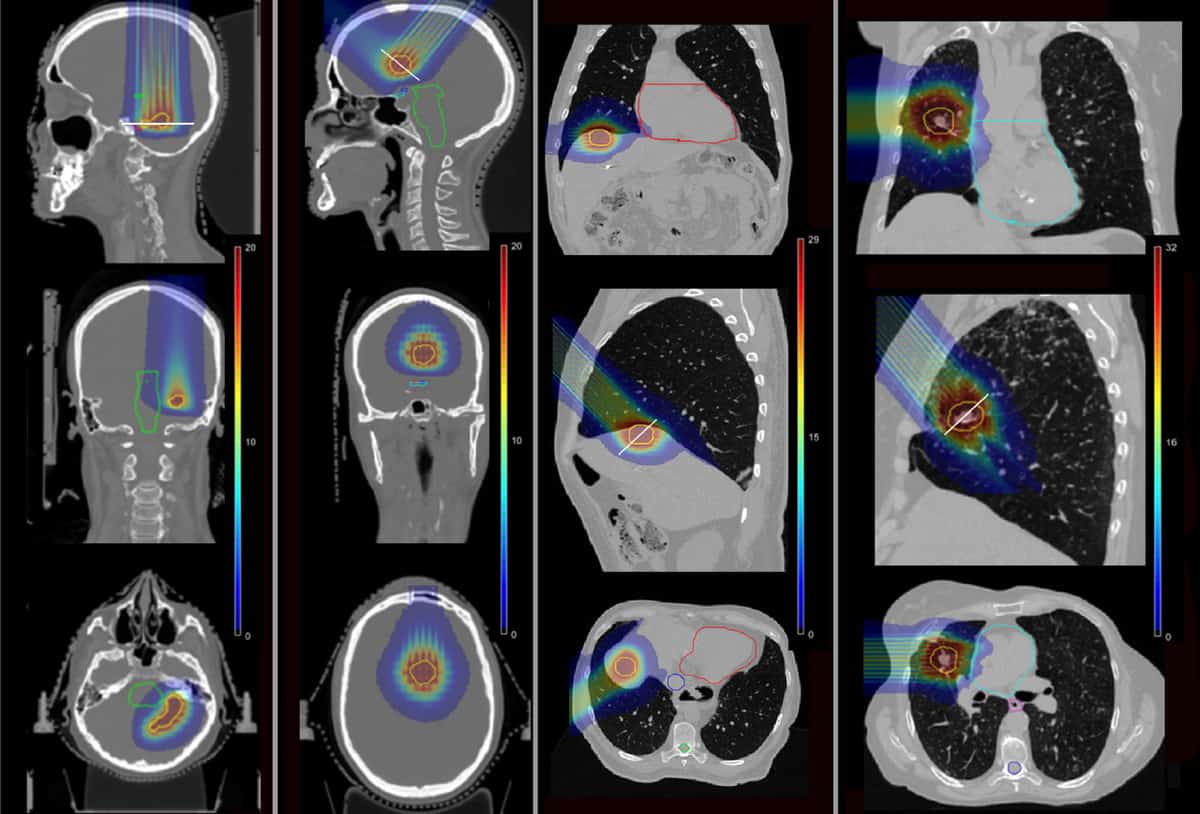
Чтобы определить, может ли pMBRT уменьшить такие осложнения, команда использовала моделирование Монте-Карло для расчета распределения доз для четырех пациентов, которые ранее получали SRT в Институте Кюри. Пациентов лечили от метастатических поражений в височной доле головного мозга, лобной доле, печени и легких.
Исследователи смоделировали планы pMBRT с одной фракцией, используя одно или два лечебных поля для доставки той же биологической эквивалентной дозы (BED) к опухоли-мишени, что и для SRT. Они смоделировали латунный коллиматор мини-луча, содержащий щели размером 400 мкм × 5.6 см с различным расстоянием между центрами, для создания мини-пучков как с узким, так и с более широким интервалом. Затем они рассчитали распределение доз для четырех случаев пациентов, для pMBRT, SRT и обычной протонной терапии.
В планах pMBRT с узким интервалом, которые создают равномерное распределение дозы в целевом объеме, охват опухоли был таким же или немного лучше, чем в планах SRT. Планы, использующие более широко расставленные лучи pMBRT, которые доставляют квазиравномерное распределение дозы к мишени, имели меньший охват опухоли.
Важно отметить, что pMBRT значительно снижает дозу облучения критических структур по сравнению с SRT. В первом случае с головным мозгом pMBRT снизила среднюю BED для органов риска (OAR) на 44% (правый слуховой нерв) и 100% (левый слуховой нерв). При втором лечении головного мозга pMBRT полностью щадила OAR, включая зрительный тракт, ствол мозга и хиазму.
В случае печени средняя ЭД на печень и ребра была снижена на 25% и 75% соответственно, при этом удалось избежать облучения верхней полой вены. А в случае легких доза ОАР была снижена от 11% (ребра) до 100% (легочная артерия и бронхи). Среднее значение BED для OAR было в основном сходным между pMBRT и обычной протонной терапией.
Исследователи также изучили возможные побочные эффекты pMBRT на нормальные ткани. Например, для двух случаев метастазов в головной мозг они рассчитали дозу, доставленную в здоровую ткань головного мозга. Они рассмотрели пределы дозы для стандартного фракционированного облучения, при котором нормированная общая доза в фракциях 2 Гр (NTD2.0) 72 Гр приводит к 5% вероятности радионекроза в течение пяти лет.
Для всех планов pMBRT максимальная долина NTD2.0 для здорового мозга (61 Гр (ОБЭ) для случая височной доли и 47 Гр (ОБЭ) для случая лобной доли) оставался ниже этого порога допустимой дозы, в отличие от обычной протонной терапии. Для пациентов с метастазами в легкие и печень средние дозы в тканях легких и печени в планах pMBRT также были значительно ниже максимально переносимых средних доз.
Клинические преимущества
Лечение pMBRT, рассматриваемое в этом исследовании, проводилось с использованием всего одной или двух массивов мини-лучей. Использование меньшего количества полей, чем при лечении СРТ (три или четыре дуги), требует меньшего количества репозиций пациента, сокращения времени лечения фракциями, а также уменьшения объема нормальной ткани, подвергаемой воздействию низких доз. Кроме того, доставка pMBRT за одну лечебную фракцию значительно сокращает общее время лечения по сравнению с планами SRT, в которых использовалось от трех до пяти фракций.

Минилучевая лучевая терапия: от фотонов к заряженным частицам
Исследователи отмечают, что планы pMBRT, оцениваемые в этой работе, могут быть реализованы клинически с использованием установки, уже реализованной в Центре протонной терапии Орсе для доклинических испытаний, с контролем движения мишени и органа во время лечения, как в SRT и протонной терапии.
Ортис рассказывает Мир физики что Институт Кюри сейчас обсуждает возможность проведения клинических испытаний фазы I/II. «Они будут оценивать нейротоксичность и показатели контроля над опухолью при лечении рецидивирующей мультиформной глиобластомы с помощью протонных мини-пучков», — объясняет он. «Это исследование направлено на то, чтобы внести свой вклад в подготовку этих клинических исследований».
- SEO-контент и PR-распределение. Получите усиление сегодня.
- Платоблокчейн. Интеллект метавселенной Web3. Расширение знаний. Доступ здесь.
- Источник: https://physicsworld.com/a/proton-minibeams-could-improve-treatment-of-cancer-metastases/
- 10
- a
- Учетные записи
- дополнение
- неблагоприятный
- Цель
- Все
- уже
- и
- животные
- массив
- избегающий
- за
- ниже
- Преимущества
- Лучшая
- между
- Мозг
- латунь
- рак
- случаев
- случаев
- Центр
- заряженный
- Клинический
- клинические испытания
- коллеги
- Колонки
- обычно
- сравненный
- полностью
- Вычисление
- считается
- контраст
- способствовать
- контроль
- контроль
- обычный
- может
- охват
- Создайте
- критической
- смерть
- доставить
- поставляется
- доставки
- Глубины
- уничтожить
- Определять
- обсуждающий
- Болезнь
- распределение
- распределения
- домен
- драматично
- в течение
- эффекты
- появление
- поощрять
- Эквивалент
- оценивать
- оценивается
- пример
- Объясняет
- подвергаться
- Поля
- First
- доля
- Франциско
- от
- Gain
- постепенно
- большой
- Половина
- вредный
- здоровый
- HTTPS
- идея
- изображение
- в XNUMX году
- улучшать
- in
- В других
- В том числе
- индекс
- информация
- Исследования
- вопрос
- только один
- Лиды
- Ограниченный
- рамки
- Печень
- локальным
- Низкий
- макс-ширина
- максимальный
- минимизация
- движение
- природа
- "обычные"
- ONE
- открытый
- Другие контрактные услуги
- изложенные
- пациент
- пациентов
- шаблон
- фаза
- фотон
- планирование
- Планы
- Платон
- Платон Интеллектуальные данные
- ПлатонДанные
- Точка
- возможность
- возможное
- предварительно
- вероятность
- многообещающий
- излучение
- радиотерапия
- Стоимость
- получила
- уменьшить
- Цена снижена
- снижает
- снижение
- остались
- замечательный
- Сообщается
- обязательный
- требуется
- исследователи
- соответственно
- Итоги
- Снижение
- то же
- Сан -
- Сан-Франциско
- говорит
- Во-вторых
- мелкий
- показанный
- существенно
- аналогичный
- небольшой
- стандарт
- исследования
- Кабинет
- такие
- топ
- цель
- команда
- снижения вреда
- говорит
- Ассоциация
- их
- Терапевтический
- терапия
- три
- порог
- миниатюрами
- время
- ткани
- в
- терпимость
- Всего
- Переводы
- лечения
- лечение
- испытания
- правда
- использование
- Долина
- различный
- объем
- тома
- будь то
- который
- в то время как
- КТО
- в
- Работа
- бы
- лет
- зефирнет