Подготовка и характеристика материала
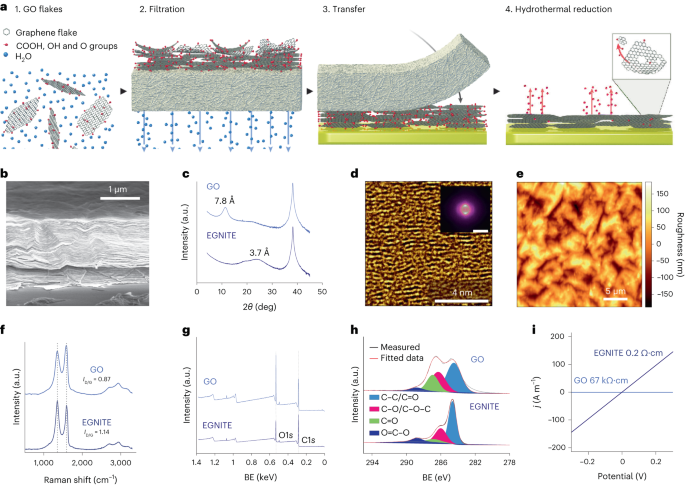
Водный раствор ГО разбавляли деионизированной водой до получения 0.15 мг/мл.-1 раствор и фильтруют в вакууме через нитроцеллюлозную мембрану с порами 0.025 мкм, образуя тонкую пленку ГО. Затем тонкую пленку перенесли на целевую подложку с помощью мокрого переноса в деионизированной воде и дальнейшего термического отжига при 100 °C в течение 2 мин. Пакет пленка ОГ-подложка подвергался гидротермальному восстановлению при 134°C в стандартном автоклаве в течение 3 часов с образованием EGNITE. Базовой подложкой для всех исследований характеристик EGNITE был квадрат (1 × 1 см).2) Si/SiO2 (400 мкм/1 мкм).
XPS
РФЭС измерения проводились на анализаторе Phoibos 150 (SPECS) в условиях сверхвысокого вакуума (базовое давление 5 × 10-10 мбар) с монохроматическим источником рентгеновского излучения Al Kα (1,486.74 эВ). Обзорные спектры были получены с энергией пропускания 50 эВ и размером шага 1 эВ, а спектры высокого разрешения были получены с энергией пропускания 20 эВ и размером шага 0.05 эВ. Общее разрешение в этих последних условиях составляет 0.58 эВ, что определяется путем измерения полной ширины на половине высоты Ag 3d5/2 пика напыленного серебра. РФЭС-анализ показывает сильное уменьшение после гидротермальной обработки пика C–O (связанного с эпоксидными группами), но небольшой вклад C–OH, C=O и C(O)OH за счет гидроксилов, карбонилов и карбоксилов, которые остаются после сокращения. Деконволюция O1s пик подтверждает такое поведение. Основной вклад в C1s однако сигнал после гидротермального восстановления исходит от sp2 гибридизованные орбитали C – C34,57.
дифракция рентгеновских лучей
Рентгеноструктурные измерения (θ-2θ сканирование) проводили в дифрактометре для исследования материалов (Malvern PANalytical). Этот дифрактометр имеет горизонтальную ω-2θ гониометр (радиус 320 мм) четырехкруговой геометрии и работал с керамической рентгеновской трубкой с Cu Kα-анодом (λ = 1.540598 Å). В качестве детектора используется Pixcel, быстрый детектор рентгеновского излучения, основанный на технологии Medipix2.
Рамановская спектроскопия
Измерения спектроскопии комбинационного рассеяния света проводились с использованием спектрографа Witec, оснащенного линией лазерного возбуждения 488 нм. Для измерений спектры комбинационного рассеяния были получены с использованием объектива с увеличением 50× и решетки с размером канавок 600 на нм; Мощность лазера поддерживалась ниже 1.5 мВт, чтобы избежать нагрева образца.
TEM
Ламель сфокусированного ионного пучка была изготовлена с помощью Helios NanoLab DualBeam (LMA-INA) для исследования поперечного сечения образца EGNITE. Структурный анализ проводился с помощью ПЭМ с использованием микроскопа Tecnai F20, работающего при 200 кВ, включая методы HRTEM и метод STEM с кольцевым темным полем под большим углом. Эксперимент STEM-EELS проводился в микроскопе Tecnai F20, работающем при 200 кэВ, с апертурой 5 мм, длиной камеры 30 мм, углом конвергенции 12.7 мрад и углом сбора 87.6 мрад. Поскольку мы использовали 0.5 эВ на пиксель и 250 эВ в качестве начальной энергии при регистрации потерь в сердечнике, мы не получили ожидаемый K-край Si при 1,839 эВ, M-край Pt при 2,122 эВ и M-край Au при 2,206 эВ. Относительный атомный состав C–O был получен, сосредоточив наше внимание на восстановленном слое GO и предположив, что проанализированные края (в нашем случае C и O) составляют 100%. Это предположение справедливо в нашем случае, о чем свидетельствует Дополнительная информация карты. Дифференциальное сечение энергии рассчитывалось с использованием модели Хартри – Слейтера, а фон - с использованием модели малой мощности.
Электрическая проводимость
Измерения электропроводности проводились с использованием измерителя Keithley 2400 в двухточечной конфигурации. Измеренные образцы состояли из пленок EGNITE размером 1 × 1 см.2 поверх SiO2 субстрат.
Анализ данных
Данные рентгеновской дифракции, комбинационного рассеяния света и XPS анализировались с использованием пакетов Python 3.7 (Numpy, Pandas, Scipy, Xrdtools, Lmfit, Rampy, Peakutils, Matplotlib). Расстояние между плоскостями рассчитывали на основе рентгеновских дифракционных измерений по закону Снеллиуса. Как только данные были перемещены в пространственную область, был установлен максимум пиков. Соответствующее расстояние давало среднее значение расстояния между плоскостями. Отклонения от этих средних значений рассчитывались по полной ширине на полувысоте лоренцевой аппроксимации пиков в пространственной области. Измерения XPS и рамановской спектроскопии были проанализированы путем подбора свертки пиков в ожидаемых местоположениях для соответствующих особенностей. Значения проводимости GO и EGNITE были получены путем аппроксимации I–V кривые, измеренные при измерениях электропроводности, по закону Ома. Данные n = 1 для каждого измерения.
Гибкое изготовление массивов
Изготовление устройств показано на дополнительном рисунке. 4. Устройства были изготовлены на 4-дюймовом Si/SiO.2 (400 мкм/1 мкм) пластины. Сначала на пластину наносился слой ПИ (PI-10, HD MicroSystems) толщиной 2611 мкм и подвергался запеканию в атмосфере, богатой азотом, при температуре 350°C в течение 30 мин. Металлические следы были нанесены с использованием оптической литографии фоторезиста с обращением изображения (AZ5214, Microchemicals). Электронно-лучевое испарение использовалось для осаждения 20 нм титана и 200 нм золота и было выполнено отрыв. Мы использовали пленку EGNITE толщиной около 1 мкм в качестве компромисса между электрохимическими характеристиками и гибкостью массива. После переноса пленки GO алюминий испаряли электронным лучом, а области поверх будущих микроэлектродов определяли с помощью негативного фоторезиста (nLOF 2070, Microchemicals) и снимали. Далее пленку ГО травили повсюду, кроме будущих микроэлектродов, с использованием кислородно-реактивного ионного травления (RIE) в течение 5 минут при мощности 500 Вт, а защитные алюминиевые колонки травили разбавленным раствором фосфорной и азотной кислот. Затем на пластину был нанесен слой PI-3 толщиной 2611 мкм и запечен, как описано ранее. Затем были определены отверстия PI-2611 на микроэлектроде с использованием толстого положительного фоторезиста (AZ9260, Microchemicals), который действовал как маска для последующего кислородного RIE. Позже устройства были нанесены на слой PI, опять же с использованием фоторезиста AZ9260 и RIE. Затем слой фоторезиста удаляли в ацетоне, пластину очищали изопропиловым спиртом и сушили. Наконец, устройства отделяли от пластины и были готовы к помещению в стерилизационные пакеты для гидротермической обработки при 134°C в стандартном автоклаве в течение 3 часов.
Электрохимическая характеристика микроэлектродов
Электрохимическую характеристику микроэлектродов проводили с помощью потенциостата Metrohm Autolab PGSTAT128N в 1× PBS (Sigma-Aldrich, P4417), содержащем 10 мМ фосфатного буфера, 137 мМ NaCl и 2.7 мМ KCl при pH 7.4 и с использованием трехэлектродной конфигурации. Электрод Ag/AgCl (FlexRef, WPI) использовали в качестве эталона, а платиновую проволоку (Alfa Aesar, 45093) использовали в качестве противоэлектрода.
Перед оценкой производительности на электроды подавались 10,000 1 импульсов со сбалансированным зарядом (15 мс, 100 мкА). Воздействие на электроды непрерывных импульсных протоколов продолжалось в течение 0.9 циклов циклической вольтамперометрии (от -0.8 до +50 В) при XNUMX мВ с.-1, 20 повторений по 5,000 импульсов (1 мс) и повторное определение потенциала холостого хода.
Анализ данных
Данные электрохимических характеристик были проанализированы с использованием пакетов Python 3.7 (Numpy, Pandas, Scipy, Pyeis, Lmfit, Matplotlib). Данные импедансной спектроскопии были сопоставлены с эквивалентной электрической моделью, состоящей из сопротивления (R) последовательно с элементом постоянной фазы (CPE). Отсюда значение CPE было аппроксимировано до емкости и разделено на геометрическую площадь микроэлектрода, чтобы получить эквивалентное значение межфазной емкости EGNITE. Емкость накопления заряда (CSC) микроэлектрода рассчитывали на основе циклических вольтамперометрических измерений путем интегрирования катодного и анодного режимов измеряемого тока и нормировки по скорости сканирования. Катодная и анодная емкость накопления заряда (cCSC и aCSC) при скорости сканирования 100 мВ EGNITE составляют 45.9 ± 2.4 и 34.6 ± 2.8 мКл см.-2соответственно (n = 3). Как сообщается для других материалов58, полученные CSC зависят от скорости сканирования (дополнительный рис. 5). Чтобы оценить наличие реакций восстановления кислорода, мы измерили форму CV-сигнала в электролите, продутом азотом.59 и не заметил существенных различий в форме сигнала (дополнительный рис. 6). Однако наши результаты не полностью учитывают влияние реакций восстановления кислорода на способность инжекции заряда EGNITE, и необходимо провести дополнительную работу, чтобы должным образом изучить это. Способность инжекции заряда микроэлектрода (CIC) устанавливали путем определения амплитуды импульса тока, которая вызывала разность напряжений (после устранения омического падения), соответствующую электрохимическому водному окну электрода (-0.9 В для катодного и +0.8 В для анодного по сравнению с Ag/AgCl). ) (дополнительный рис. 17)60.
статистический анализ
Данные являются средними ± s.d., n = 18 для EIS и n = 3 для хронопотенциометрии. Данные карты изменения катодно-емкостного напряжения представляют собой среднее значение изменений катодно-емкостного напряжения для одного события для каждой формы импульса. n = 3 электрода.
Оценка механической стабильности
Ультразвуковая обработка ультразвуком
Матрицы электродов EGNITE были помещены в химический стакан, наполненный водой, на водяной бане ультразвука (Elmasonic P 180H). Обработку ультразвуком применяли при частоте 37 кГц в течение 15 минут при мощности 200 Вт, а затем следовали дополнительные 15 минут обработки ультразвуком при частоте 37 кГц с мощностью, увеличенной до 300 Вт. Изображения электродов были получены до и после этапов обработки ультразвуком.
Тест на изгиб
Гибочная установка (рис. 2k) состоял из трех цилиндрических стержней; средний (диаметр 700 мкм) был опущен вниз, в результате чего углы изгиба составили 131°. Для испытания на изгиб использовались три гибкие матрицы микроэлектродов. Каждый массив содержал 18 микроэлектродов диаметром 50 мкм. Две матрицы были измерены после 10 и 20 циклов, тогда как одно устройство измерялось только в течение 10 циклов, так как оно было повреждено во время обращения после измерения. Цикл испытаний на изгиб состоял из 10-секундного приложения нагрузки плюс 10 секунд без нагрузки. Устройства подвергались электрохимическим характеристикам (EIS и CV) до и после 10 и 20 циклов изгиба.
Эпикортикальная нейронная запись
Эпикортикальная имплантация
Все экспериментальные процедуры проводились в соответствии с рекомендациями Совета Европейского Сообщества и французским законодательством по уходу и использованию лабораторных животных. Протоколы были одобрены Этическим комитетом Гренобля (ComEth) и одобрены министерством Франции (номер 04815.02). Крысы Спрэга-Доули (самцы, возраст 4 мес, масса ~600 г) анестезировали внутримышечно кетамином (50 мг на кг (вес тела)) и ксилазином (10 мг на кг (вес тела)), а затем фиксировали на стереотаксическом держателе. Удаление височного черепа обнажило слуховую кору. Твердую мозговую оболочку сохраняли во избежание повреждения кортикальной ткани. В вершине было просверлено отверстие для вставки электрода сравнения, а второе отверстие, на расстоянии 7 мм вперед от первого, было просверлено для вставки заземляющего электрода. Электроды представляли собой штыри толщиной 0.5 мм, используемые для гнезд интегральных схем. Их помещали так, чтобы обеспечить электрический контакт с твердой мозговой оболочкой, и фиксировали к черепу с помощью стоматологического цемента. Затем мы установили ленту поверхностного микроэлектрода на слуховую кору, как показано на рис. 3b. Рисунок вен идентифицирует слуховую кору головного мозга в области 41 на карте мозга крысы Крига. Кортикальные сигналы одновременно усиливались с коэффициентом усиления 1,000 и оцифровывались с частотой дискретизации 33 кГц. Динамик, находившийся в 20 см перед ухом крысы, контралатерально к обнаженной коре, доставлял акустические стимулы. Подаваемые стимулы контролировались с помощью 0.25-дюймового микрофона (Brüel & Kjaer, 4939), расположенного рядом с ухом и отображаемого на уровне звукового давления (дБ SPL относительно 20 мкПа). Мы исследовали вершинно-положительные (отрицательные вверх) реакции со средней задержкой, вызванные попеременными щелчками при уровне звукового давления 80 дБ и звуковыми импульсами при уровне звукового давления 70 дБ с частотами в диапазоне от 5 до 40 кГц, временем нарастания и спада 5 мс и продолжительность 200 мс.
Анализ данных
Электрофизиологические данные анализировались с использованием пакетов Python 3.7 (Numpy, Pandas, Scipy, Neo, Elephant, Sklearn Matplotlib) и пользовательской библиотеки PhyREC (https://github.com/aguimera/PhyREC). среднеквадратичное значение значения были рассчитаны с использованием скользящего окна 20 мс на частотах выше 200 Гц. Спектрограммы рассчитывались для диапазона от 70 Гц до 1.1 кГц. PSD рассчитывалась по 60 секундам непрерывной записи. Для данной электродной решетки рассчитывали две PSD: in vivo (IV) и посмертно (PM). SNR выражается в дБ (20 × ln(rms(IV)/rms(PM))) и интерполируется для 20 точек, логарифмически расположенных между 10 Гц и 1 кГц.
статистический анализ
Данные эпикортикальных нейронов, представленные на рис. 3 взяты из индивидуальных измерений на одном животном. На рис. 3cпредставлены данные с 64 электродов. На рис. 3d, представлены данные с двух выбранных электродов. На рис. 3fPSD и SNR рассчитаны для 64 электродов EGNITE и показаны как среднее значение ± s.d. На дополнительном рис. 12в,г медианные данные представлены для 192 электродов EGNITE из n = 3 эксперимента и 60 платиновых электродов от n = 1 эксперимент.
Внутрикорковая нейронная запись
Внутрикортикальная имплантация
Животных анестезировали смесью кетамин/ксилазин (75:1, 0.35 мл/28 г внутрибрюшинно) и это состояние поддерживали с помощью ингаляционной маски, содержащей 1.5% изофлурана. Несколько микровинтов были вставлены в череп для стабилизации имплантата, а тот, что наверху мозжечка, использовался в качестве общего основания. Зонд имплантировали в префронтальную кору (координаты: AP, 1.5 мм; ML, ±0.5 мм; ДВ, -1.7 мм от брегмы). Имплантацию проводили путем покрытия зонда мальтозой (см. протокол ниже), чтобы обеспечить временную жесткость зонда и облегчить его введение. Зонд герметизировали стоматологическим цементом. Разъемы TDT-ZifClip использовались для подключения зонда к электрофизиологической системе через миниатюрный кабель. После операции мышь прошла период восстановления продолжительностью 1 неделю, получая обезболивающее (бупренорфин) и противовоспалительное (мелоксикам) лечение. Нейронную активность регистрировали с помощью многоканальной системы Open Ephys с частотой дискретизации 30 кГц с усилителем Intan RHD2132. Эксперименты со слуховыми задачами проводились в звукоизолированном боксе с двумя динамиками внутри с использованием протоколов, основанных на ранее описанной работе.61. Звуковой стимул представлял собой щелчок белого шума длительностью 15 мс, повторявшийся 100 раз (циклов), каждый из которых разделен интервалом 5 секунд (межстимульный интервал). Во время выполнения задания животное могло свободно передвигаться.
Протокол обеспечения жесткости мальтозы
Водный раствор мальтозы нагревают до температуры стеклования (Tg), между 130 и 160 °C, используя электроплитку или микроволновую печь. Когда мальтоза становится вязкой, задняя часть зонда контактирует только с мальтозой. По мере того как мальтоза остывает, она затвердевает и делает зонд жестким.
Анализ данных
Нейронные сигналы от каждого электрода фильтровались в автономном режиме для извлечения SUA и LFP. SUA оценивалась путем фильтрации сигнала в диапазоне от 450 до 6,000 Гц, а спайки от отдельных нейронов сортировались с использованием анализа главных компонентов с помощью Offline Sorter v.4 (Plexon). Чтобы получить LFP, сигналы были понижены до 1 кГц, удалены тренды и подвергнуты режекторной фильтрации для удаления артефактов линии шума (50 Гц и ее гармоники) с помощью специально написанных сценариев на Python. AEP SNR рассчитывали как отношение пиковой амплитуды N1 и стандартного отклонения. за период 20 мс до стимула.
статистический анализ
Данные, представленные на рис. 3 часа, я являются средними ± s.d., n = 30 как количество усредненных испытаний. Данные, записанные с одного и того же электрода, показаны на 30, 60 и 90 дни. Представлены данные от одного животного.
Хроническая эпикортикальная биосовместимость
Хирургическая имплантация устройств
В этом исследовании использовали в общей сложности 27 взрослых самцов крыс Sprague-Dawley (Charles River). Животных содержали при температуре окружающей среды 21±2°C и влажности 40–50%, при цикле 12 часов света/12 часов темноты. Крыс содержали группами и имели свободный доступ к пище и воде на протяжении всего экспериментального периода. Экспериментальные процедуры проводились в соответствии с Законом о защите животных (1998 г.) с одобрения Министерства внутренних дел Великобритании и местного органа по этической проверке защиты животных (AWERB). Животных анестезировали изофлураном (2–3%) на время операции, а глубину анестезии контролировали с помощью теста на защемление пальца ноги. Животных помещали в стереотаксическую рамку (Kopf, 900LS), расположенную над термоодеялом для поддержания температуры тела. Краниотомическое отверстие (~5 мм ×4 мм) делали на расстоянии 1 мм от срединной линии с помощью стоматологической бормашины со сверлом с заусенцами диаметром 0.9 мм, твердую мозговую оболочку удаляли и эпикортикальное устройство помещали на кортикальную поверхность головного мозга. Отверстие для краниотомии запечатали Kwik-sil, затем для фиксации нанесли стоматологический цемент, а кожу зашили. Для восполнения потерянной жидкости и уменьшения послеоперационной боли были сделаны подкожные инъекции физиологического раствора (1 мл на кг (массы тела)) и бупренорфина (0.03 мг на кг массы тела), после чего анестезия была отменена.
Сбор и обработка тканей
Животных умерщвляли через 2, 6 или 12 недель после имплантации с помощью метода, соответствующего типу проводимого анализа.
Гистология и иммуногистохимия
Через 2, 6 или 12 недель после имплантации крыс умерщвляли посредством сердечной перфузии гепаринизированным (10 ед. мл).-1, Sigma-Aldrich) PBS, а затем 4% параформальдегида (PFA, Sigma-Aldrich) в PBS. Мозг постфиксировали в 4% PFA в течение 24 часов, затем переносили в 30% сахарозу в PBS по меньшей мере на 48 часов перед замораживанием в изопентане. Затем мозг хранили при температуре -80°C до криосрезов при толщине 25 мкм. Затем ткань окрашивали на молекулу-адаптер 1, связывающую ионизированный кальций (Iba-1), чтобы определить уровень активации микроглии. Вкратце, срезы тканей блокировали 5% козьей сывороткой в PBS с 0.1% тритоном-X в течение 1 часа перед инкубацией в течение ночи при 4°C с первичным антителом против Iba-1 (1:1,000, 019-19741; Wako). Затем срезы окрашивали вторичным антителом против кролика Alexa Fluor 594 (1:400, A-11012; Thermo Fisher) в течение 1 часа при комнатной температуре. Слайды монтировали с покровными стеклами, используя устойчивую к выцветанию среду для заливки Prolong Gold с 4,6-диамидино-2-фенилиндолом (Thermo Fisher). Зонд покрыл площадь 3 × 3.7 мм.2 на корковой поверхности головного мозга; срезы ткани, выбранные для окрашивания, покрывали эту область длиной 3.2 мм. Слайды получали с помощью сканера предметных стекол микроскопа 3DHistech Pannoramic-250 с увеличением 20×, а изображения анализировали с помощью CaseViewer v.2.4 (3DHistech). Для оценки активации микроглии была покрыта область размером 3.2 мм, при этом одно изображение анализировалось каждые 100 мкм. Изображения были сделаны при 8.5-кратном увеличении, на которых детализирован участок эпикортикального участка зонда, на расстоянии 3 мм от средней линии мозга, охватывающий область непосредственно под участком зонда.
Обработка изображений
Данные микроскопии были обработаны с использованием алгоритма характеристики фенотипа микроглии (дополнительный рисунок). 13). Активацию микроглии анализировали с использованием специального CellProfiler* (Broad Institute, v.3.1.9 от https://cellprofiler.org/) трубопровод. Во-первых, модуль EnhanceOrSuppressFeatures использовался для улучшения нитевидных структур, таких как нейриты, путем применения метода улучшения трубчатости. Из улучшенных изображений ячейки были сегментированы с помощью модуля IdentifyPrimaryObjects. Предварительные измерения ячеек показали, что подходящий диапазон диаметров объектов составляет 3–40 пикселей. Объекты, выходящие за пределы этого диапазона диаметров или соприкасающиеся с краем изображения, отбрасывались. Ячейки были сегментированы с использованием стратегии адаптивного порогового определения двух классов Otsu с размером адаптивного окна 50 пикселей. Объекты, идентифицированные модулем IdentifyPrimaryObjects, вводились в модуль MeasureObjectSizeShape для расчета необходимых свойств для классификации ячеек. В модуле ClassifyObjects в качестве категории, на основе которой будет основываться классификация, была указана AreaShape, а в качестве соответствующего измерения был выбран экстент. Клетки были классифицированы как "активированный» или «неактивированный» на основе их свойства «Протяженность», которое представляет собой отношение площади, занимаемой ячейкой, к площади, занимаемой ее ограничивающей рамкой. Этот классификационный подход был оправдан тем фактом, что активированная микроглия имеет большие клеточные тела и не имеет отростков и, таким образом, занимает гораздо большую часть своих ограничивающих рамок, чем их неактивированные аналоги. Наконец, модули CalculateMath и ExportToSpreadsheet использовались для расчета и вывода желаемой статистики.
статистический анализ
Наборы данных n = 3 для каждого типа устройства (имплантат только с PI (PI); PI с открытым микрообработанным золотом (золото); и PI с микрообработанным золотом и EGNITE (EGNITE) во все моменты времени), за исключением 6 недельного золота, которое n = 2 для данных ИФА. Контралатеральные полушария объединяли в каждый момент времени, чтобы получить n = 9 через 2 и 12 недель после имплантации и n = 8 через 6 недель после имплантации. Анализ данных проводился с использованием программного обеспечения GraphPad Prism v.8. Статистический анализ был завершен с использованием двустороннего дисперсионного анализа (ANOVA) с тестом множественных сравнений Тьюки, где это необходимо; P < 0.05 считалось значимым.
ИФА
После периода имплантации животных умерщвляли путем смещения шейных позвонков. Мозговую ткань извлекали как из правого, так и из левого полушария головного мозга, мгновенно замораживали в жидком азоте и хранили при -80°C до дальнейшего использования. Ткань лизировали с использованием лизирующего буфера NP-40 (150 мМ NaCl, 50 мМ Tris-Cl, 1% заменителя Nonidet P40, Fluka, pH доведен до 7.4), содержащего ингибитор протеазы и фосфатазы (коктейль ингибиторов протеазы и фосфатазы Halt, Thermo Fisher), с последующим механическим разрушением ткани (TissueLyser LT, Qiagen). Затем образцы центрифугировали в течение 10 минут при 5,000 об/мин, а супернатант хранили при 4°C до дальнейшего использования. Панель воспаления крыс LEGENDplex (номер по каталогу 740401, BioLegend), мультиплексный набор для ИФА на основе гранул, использовали для количественного определения следующих цитокинов; IL-1α, IL-1β, IL-6, IL-10, IL-12p70, IL-17A, IL-18, IL-33, CXCL1 (KC), CCL2 (MCP-1), гранулоцитарно-макрофагальные колониестимулирующие фактор, интерферон-γ и фактор некроза опухоли. Набор работал в соответствии с инструкциями производителя с загружаемым белком в фиксированном объеме 15 мкл. После инкубации с супернатантом шарики прогоняли на проточном цитометре BD FACSVerse и данные анализировали с использованием программного обеспечения для анализа данных LEGENDplex.
Нейронная стимуляция
Внутрифасцикулярная имплантация
Все эксперименты на животных были одобрены Комитетом по этике Автономного университета Барселоны в соответствии с Директивой Совета Европейских сообществ 2010/63/EU. Животных содержали при температуре 22±2°C при 12-часовом цикле света/12-часовой темноте со свободным доступом к пище и воде. Седалищный нерв анестезированных самок крыс линии Спрэг-Доули (250–300 г, ~18 недель) был открыт хирургическим путем, и электроды TIME были имплантированы поперечно через седалищный нерв с помощью прямой иглы, прикрепленной к петлевой нити 10-0.46. Процесс контролировали под диссекционным микроскопом, чтобы убедиться в правильности положения активных центров внутри нервных пучков (рис. 4b). В ходе экспериментов температуру тела животного поддерживали с помощью грелки.
Стимуляцию нерва осуществляли путем подачи серий двухфазных импульсов тока фиксированной длительности 100 мкс на фазу и увеличения амплитуды от 0 до 150 мкА с шагом 1 или 3 мкА при частоте 3 Гц в течение 33 с (стимулятор DS4, Digitimer) через различные устройства EGNITE. микроэлектроды. Одновременно регистрировались CMAP от мышц GM, TA и PL с использованием небольших игольчатых электродов (длина 13 мм, диаметр 0.4 мм, игольчатые электроды из нержавеющей стали A-03-14BEP, Bionic), помещенных в каждую мышцу.62. Активный электрод располагался на брюшке мышцы, а эталонный — на уровне сухожилия. Записи электромиографии были усилены (×100 для GM и TA, ×1,000 для PL; усилители P511AC, Grass), подвергнуты полосовой фильтрации (от 3 Гц до 3 кГц) и оцифрованы с помощью системы записи PowerLab (PowerLab16SP, ADInstruments) при 20 кГц.
Анализ данных
Амплитуда каждого CMAP измерялась от базовой линии до максимального отрицательного пика. Измерения пикового напряжения были нормированы на максимальную амплитуду CMAP, полученную для каждой мышцы в эксперименте. Индекс селективности (ИС) рассчитывали для каждого активного сайта как соотношение нормализованной амплитуды CMAP для одной мышцы, CMAPi, а сумма нормализованных амплитуд CMAP в трех мышцах по формуле SIi = nСМАРi/∑nСМАРj, при минимальной амплитуде тока стимуляции, которая вызывала минимальный функционально значимый мышечный ответ (определяемый как по меньшей мере 5% амплитуды CMAP для одной из мышц по отношению к максимальной амплитуде CMAP этой мышцы, которая была определена ранее). Затем активные участки с наивысшим SI для каждой из трех мышц были выбраны в качестве SI для каждой мышцы в данном эксперименте.
Хроническая внутринейральная биосовместимость
Следуя ранее описанной процедуре50,63, седалищный нерв анестезированных самок крыс Спрэга-Доули (250-300 г, ~18 недель) был подвергнут воздействию, а устройства для биосовместимости in vivo с EGNITE и без него были продольно имплантированы в большеберцовую ветвь седалищного нерва (n = 6–8 на группу). Вкратце, нерв прокалывают в области трифуркации прямой иглой, прикрепленной к петлевой нити 10-0 (STC-6, Ethicon); нить тянет за стреловидный кончик согнутой электродной ленты. Кончик срезан, чтобы отвести нить, а кончики каждого рычага слегка загнуты, чтобы избежать выдергивания устройства. Продольный имплантат был выбран потому, что он позволяет лучше изучить реакцию инородного тела внутри нерва.50.
Функциональная оценка нервов и животных
Животных оценивали во время последующего постимплантационного наблюдения с помощью тестов нервной проводимости, альгезиметрии и тестов локомоции при ходьбе.62. Для тестов проводимости седалищный нерв имплантированных и контралатеральных лап стимулировали игольчатыми электродами в седалищной вырезке и регистрировали CMAP мышцы PL, как указано выше. Были измерены латентность и амплитуда CMAP. Для теста альгезиметрии крыс помещали на платформу из проволочной сетки и применяли механический безвредный стимул с помощью металлического наконечника, соединенного с электронным альгезиметром фон Фрея (Bioseb). Измеряли ноцицептивный порог (сила в граммах, с которой животные отдергивали лапу) имплантированных по сравнению с контралатеральными лапами. Для теста на ходьбу подошвенную поверхность задних лап окрашивали черными чернилами и каждую крысу оставляли ходить по коридору. Были собраны следы и рассчитан функциональный индекс седалищного нерва.62.
гистология
Через 2 или 8 недель животным перфузировали PFA (4%), а седалищные нервы собирали, постфиксировали, криоконсервировали и обрабатывали для гистологического анализа. Для оценки FBR седалищные нервы разрезали на поперечные срезы толщиной 15 мкм с помощью криостата (Leica CM190). Образцы окрашивали первичными антителами к миелинизированным аксонам (анти-RT97 для маркировки Neurofilament 200K, 1:200; Банк гибридомных исследований развития) и макрофагам (анти-Iba-1, 1:500; Wako). Затем срезы инкубировали в течение 1 часа при комнатной температуре со вторичными антителами осла против мышиного Alexa Fluor 488 и осла против кролика Alexa Fluor 555 (1:200, Invitrogen). Были выбраны репрезентативные срезы центральной части имплантата большеберцового нерва, изображения сделаны с помощью эпифлуоресцентного микроскопа (Eclipse Ni, Nikon), прикрепленного к цифровой камере (DS-Ri2, Nikon), и анализ изображений выполнен с помощью программного обеспечения ImageJ (National Institutes). здравоохранения). Количество Iba-1-положительных клеток во всей области большеберцового нерва определяли количественно, а толщину тканевой капсулы измеряли как среднее расстояние каждой стороны имплантата до ближайших аксонов.
статистический анализ
Для статистического анализа данных мы использовали одно- или двусторонний дисперсионный анализ с последующим апостериорным тестом Бонферрони для выявления различий между группами или временем. Для графического представления и анализа использовалось программное обеспечение GraphPad Prism. Статистическую значимость учитывали, когда P <0.05.
Отчетная сводка
Дополнительная информация о дизайне исследований доступна в Резюме отчета по портфелю природы ссылка на эту статью
- SEO-контент и PR-распределение. Получите усиление сегодня.
- PlatoData.Network Вертикальный генеративный ИИ. Расширьте возможности себя. Доступ здесь.
- ПлатонАйСтрим. Интеллект Web3. Расширение знаний. Доступ здесь.
- ПлатонЭСГ. Углерод, чистые технологии, Энергия, Окружающая среда, Солнечная, Управление отходами. Доступ здесь.
- ПлатонЗдоровье. Биотехнологии и клинические исследования. Доступ здесь.
- Источник: https://www.nature.com/articles/s41565-023-01570-5
- :имеет
- :является
- :нет
- :куда
- ][п
- $UP
- 000
- 1
- 10
- 100
- 12
- 13
- 130
- 15%
- 150
- 160
- 19
- 1998
- 20
- 200
- 2010
- 2011
- 2014
- 2016
- 2018
- 2020
- 2022
- 22
- 24
- 25
- 250
- 26
- 27
- 28
- 30
- 300
- 320
- 33
- 35%
- 350
- 40
- 400
- 41
- 43
- 46
- 50
- 500
- 54
- 58
- 60
- 600
- 7
- 70
- 700
- 75
- 8
- 80
- 87
- 9
- 90
- a
- в состоянии
- выше
- доступ
- соответствие
- По
- акустическая
- приобретать
- приобретенный
- приобретение
- через
- Действие (Act):
- активированный
- Активация
- активный
- деятельность
- адаптивный
- дополнительный
- адрес
- Отрегулированный
- Для взрослых
- После
- AG
- снова
- AL
- Алкоголь
- Alexa
- алгоритм
- Все
- позволяет
- вдоль
- am
- окружающий
- количество
- Усиленный
- an
- анализирует
- анализ
- Ведущий
- и
- животное
- животные
- Антитела
- антитело
- кроме
- Применение
- прикладной
- Применение
- подхода
- соответствующий
- утверждение
- утвержденный
- МЫ
- ПЛОЩАДЬ
- области
- ARM
- около
- массив
- гайд
- AS
- оценить
- оценки;
- связанный
- предположение
- At
- Атмосфера
- атомное
- внимание
- уполномоченный
- доступен
- избежать
- прочь
- фон
- Банка
- Барселона
- Использование темпера с изогнутым основанием
- основанный
- Базовая линия
- BD
- BE
- Ширина
- , так как:
- было
- до
- поведение
- ниже
- Лучшая
- между
- переплет
- биомедицинских
- Немного
- Черный
- заблокировал
- органов
- тело
- изоферменты печени
- Коробка
- коробки
- Мозг
- мозги
- Филиал
- кратко
- широкий
- принес
- буфер
- но
- by
- кабель
- вычислять
- рассчитанный
- камера
- емкостный
- Пропускная способность
- заботится
- проводятся
- случаев
- Категории
- ccl2
- ячейка
- Клетки
- цемент
- центральный
- проблемы
- отличающийся
- заряд
- Чарльз
- химический
- выбранный
- классификация
- классифицированный
- нажмите на
- закрыто
- коктейль
- лыжных шлемов
- Колонки
- сочетании
- выходит
- комитет
- Сообщества
- сообщество
- Заполненная
- композиция
- Условия
- проводятся
- проводимость
- Конфигурация
- Свяжитесь
- подключенный
- считается
- Состоящий из
- постоянная
- обращайтесь
- содержащегося
- (CIJ)
- вклад
- Сближение
- исправить
- соответствующий
- коридор
- кора
- Совет
- коллегами
- курс
- покрытый
- критической
- Пересекать
- криоконсервированный
- Текущий
- изготовленный на заказ
- Порез
- цикл
- циклы
- цитокины
- повреждения
- темно
- данным
- анализ данных
- Дней
- de
- снижение
- считается
- определенный
- из
- поставляется
- зависеть
- пополнять счет
- депонированный
- глубина
- описано
- Проект
- желанный
- подробный
- Определять
- определены
- определения
- развития
- устройство
- Устройства
- DID
- Диета
- разница
- Различия
- различный
- Интернет
- оцифрованы
- разбавленный
- направлять
- непосредственно
- вывих
- Нарушение
- расстояние
- Разделенный
- do
- домен
- сделанный
- вниз
- Падение
- два
- продолжительность
- в течение
- Е & Т
- каждый
- Edge
- Электрический
- Электронный
- элемент
- слон
- возвышенный
- охватывая
- энергетика
- повышать
- расширение
- усиление
- обеспечивать
- оборудованный
- Эквивалент
- установленный
- По оценкам,
- Эфир (ETH)
- этический
- EUR
- Европейская кухня
- EV
- оценивается
- оценка
- События
- Каждая
- везде
- свидетельствует
- исследовать
- исключение
- ожидаемый
- эксперимент
- экспериментальный
- Эксперименты
- подвергаться
- Экспозиция
- выраженный
- степень
- извлечение
- содействовал
- факт
- фактор
- Осень
- далеко
- БЫСТРО
- Особенности
- женский пол
- Фига
- фигура
- заполненный
- фильм
- пленки
- фильтрация
- в заключение
- First
- примерка
- фиксированной
- Трансформируемость
- гибкого
- поток
- внимание
- фокусировка
- следует
- после
- питание
- Что касается
- Форс-мажор
- иностранный
- форма
- формула
- КАДР
- Бесплатно
- свободно
- Замораживание
- Французский
- от
- передний
- замороженные
- полный
- полностью
- функциональная
- функционально
- далее
- будущее
- Gain
- дал
- Общие
- геометрия
- Дайте
- данный
- стекло
- GM
- Go
- Золото
- Графен
- трава
- земля
- группы
- Группы
- методические рекомендации
- было
- Половина
- Управляемость
- Есть
- Медицина
- помощь
- полусферы
- высокое разрешение
- наивысший
- держатель
- Отверстие
- Главная
- Домашний офис
- горизонтальный
- ГОРЯЧИЙ
- Однако
- HTTPS
- Хуан
- i
- идентифицированный
- определения
- IEEE
- изображение
- анализ изображения
- изображений
- Влияние
- in
- В том числе
- повышение
- инкубационных
- ИНКУБАЦИЯ
- индекс
- individual
- воспаление
- информация
- вход
- внутри
- Институт
- инструкции
- интегрированный
- Интегрируя
- предназначенных
- Интерфейс
- интерфейсы
- в
- исследовать
- IT
- ЕГО
- хранится
- комплект
- Кох
- этикетка
- лаборатория
- большой
- больше
- лазер
- Фамилия
- Задержка
- новее
- закон
- слой
- наименее
- оставил
- Законодательство
- Длина
- уровень
- Библиотека
- такое как
- недостатки
- линия
- LINK
- связанный
- жидкость
- загрузка
- локальным
- расположенный
- места
- Длинное
- долгосрочный
- потерянный
- снижена
- макрофаги
- сделанный
- Главная
- поддерживать
- сделать
- карта
- Карты
- маска
- соответствует
- материала
- материалы
- Matplotlib
- максимальный
- mc
- значить
- означает
- измеренный
- измерение
- размеры
- измерение
- механический
- Медиа
- металл
- метод
- микроглии
- микрофон
- Микроскоп
- Микроскопия
- средняя
- мин
- минимальный
- минимальный
- министерство
- смесь
- ML
- модель
- Модели
- модуль
- Модули
- молекула
- контролируемый
- месяцев
- мышь
- двигаться
- переехал
- MS
- многоканальный
- мышца
- нанотехнологии
- национальный
- Национальные институты здоровья
- природа
- Возле
- необходимо
- некроз
- потребности
- отрицательный
- NEO
- сеть
- сеть
- нервный
- нейрофиламент
- Нейроны
- следующий
- нет
- Шум
- номер
- NumPy
- объект
- цель
- объекты
- наблюдать
- получать
- полученный
- of
- от
- Офис
- оффлайн
- Старый
- on
- консолидировать
- ONE
- только
- открытый
- отверстия
- работать
- or
- Другое
- наши
- внешний
- выходной
- внешнюю
- за
- общий
- всю ночь
- обзор
- Oxygen
- пакеты
- площадка
- боль
- панд
- панель
- часть
- pass
- паттеранами
- ПЛЮСНЫ
- PBS
- Вершина горы
- для
- производительность
- выполнены
- период
- периферийный
- фаза
- фенотип
- штифты
- трубопровод
- Pixel
- размещенный
- Planes
- Платформа
- платина
- Платон
- Платон Интеллектуальные данные
- ПлатонДанные
- плюс
- pm
- Точка
- пунктов
- «портфель»
- должность
- положительный
- После
- потенциал
- мощностью
- предварительный
- подготовка
- подготовленный
- присутствие
- представлены
- консервированный
- давление
- предварительно
- первичный
- Предварительный
- зонд
- Процедуры
- процесс
- обрабатываемых
- Процессы
- производства
- Продукция
- должным образом
- свойства
- собственность
- доля
- защищающий
- Белкове продукты
- протокол
- протоколы
- обеспечивать
- обеспечение
- Тянет
- импульс
- Питон
- R
- ассортимент
- ранжирование
- RAT
- Обменный курс
- соотношение
- RE
- реакция
- реакции
- готовый
- получение
- рекомендаций
- записанный
- запись
- выздоровление
- уменьшить
- Цена снижена
- снижение
- ссылка
- регенерация
- диеты
- область
- относительный
- соответствующие
- оставаться
- удаление
- удален
- удаление
- повторный
- замещать
- Сообщается
- Reporting
- представление
- представитель
- исследованиям
- Сопротивление
- Постановления
- уважение
- соответственно
- ответ
- ответы
- Итоги
- Обращение
- обзоре
- лента
- Богатые
- правую
- Рост
- Rivers - Реки
- Комната
- Run
- s
- то же
- сканирование
- скрипты
- Во-вторых
- вторичный
- Раздел
- разделах
- безопасный
- посмотреть
- выбранный
- Серии
- сыворотка
- Наборы
- несколько
- Форма
- показанный
- Шоу
- сторона
- сигнал
- сигналы
- значение
- значительный
- Серебро
- одновременно
- одинарной
- сайте
- Сайтов
- Размер
- Кожа
- Слайд-шоу
- Горки
- скольжение
- небольшой
- Снэп
- Software
- Решение
- Звук
- Источник
- пространственный
- Динамик
- динамики
- указанный
- функции
- Спектроскопия
- шипы
- Вращение
- площадь
- Стабильность
- стабилизировать
- стек
- Нержавеющая сталь
- стандарт
- нормированный
- Начало
- Область
- статистический
- статистика
- Steam
- стали
- ножка
- Шаг
- Шаги
- раздражитель
- диск
- хранить
- прямой
- Стратегия
- Зачистите
- сильный
- структурный
- структур
- исследования
- Кабинет
- подкожный
- последующее
- существенный
- такие
- сумма
- Поверхность
- Хирургия
- система
- T
- взять
- приняты
- цель
- Сложность задачи
- снижения вреда
- Технологии
- временный
- тестXNUMX
- тестов
- чем
- который
- Ассоциация
- Местоположение
- Будущее
- Великобритании
- их
- тогда
- Там.
- тепловой
- они
- этой
- те
- три
- порог
- Через
- по всему
- Таким образом
- время
- раз
- тип
- Советы
- туалетная бумага
- Титан
- в
- TONE
- топ
- Всего
- трогательный
- к
- трек
- поезда
- транс-
- перевод
- переданы
- Передающий
- переход
- лечение
- лечение
- лечение
- испытания
- учебник
- два
- напишите
- Uk
- ультразвук
- под
- понимание
- Прошел
- до
- использование
- используемый
- через
- вакуум
- действительный
- ценностное
- Наши ценности
- Против
- с помощью
- естественных условиях
- напряжение
- объем
- из
- W
- от
- ходьба
- законопроект
- Вода
- we
- неделя
- Недели
- взвешивание
- вес
- Благосостояние
- были
- когда
- который
- в то время как
- белый
- все
- окно
- Провод
- выводов
- без
- Работа
- работавший
- работает
- X
- рентгеновский
- зефирнет