Все реагенты использовали в том виде, в котором они были получены, если не указано иное. Все химикаты были приобретены у Sigma Aldrich, за исключением счетных шариков (CountBright Absolute Counting Beads, Invitrogen). ζ-Потенциал измеряли с использованием Zetasizer NanoZS90 (Malvern Instruments). Размер и морфологию частиц изучали методом СЭМ на микроскопе JEOL JSM 7800F Prime со встроенной ЭДС для проведения элементного анализа. Размер частиц определяли путем измерения 50 независимых частиц. Радиомгновенную тонкослойную хроматографию (ITLC) проводили на хроматографической бумаге из стеклянного микроволокна Agilent Technologies, пропитанной кремниевой кислотой, и анализировали с помощью ТСХ-сканера Lablogic Flow-count и фотоумножителя BioScan B-FC-3200 с использованием программного обеспечения Laura. Подвижная фаза ITLC состояла из 0.175 М лимонной кислоты и 0.325 М тринатрийцитрата в воде, если не указано иное. Радиоактивные образцы измерялись с помощью Capintec CRC-25R (Capintec) или LKB Wallac 1282 Compugamma CS (PerkinElmer), данные для которых собирались с использованием программного обеспечения EdenTerm. Эксперименты по проточной цитометрии проводились в сортировщике клеток BD FACSMelody с использованием программного обеспечения BD FACSChorus. Изображения ПЭТ/КТ получали с помощью сканера NanoPET/CT (Mediso), реконструировали с помощью программного обеспечения Nucline v.0.21, а изображения анализировали с помощью программного обеспечения VivoQuant (версия 3.5, InviCRO). Данные в режиме списка были получены с помощью специального программного обеспечения MATLAB, разработанного Mediso. Ауторадиографию проводили на приборе GE Amersham Typhoon.
Синтез частиц кремнезема субмикрометрового размера
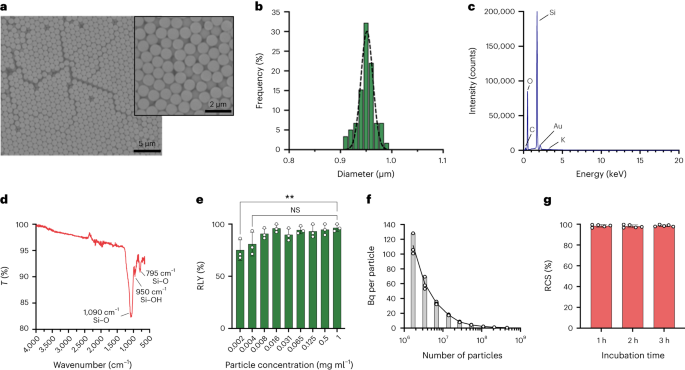
Частицы были синтезированы методом Штёбера. Этот метод основан на гидролизе и последовательной конденсации алкоксидов кремния с получением монодисперсных сферических частиц кремнезема.27. Тетраэтилортосиликат (ТЭОС) использовался в качестве источника кремния, аммиак в качестве основного катализатора и хлорид калия в качестве электролита. К раствору, содержащему катализатор и электролит, непрерывно добавляли раствор ТЭОС в этаноле. Изменение исходного количества реагента или скорости добавления приводит к различиям в размере частиц, как сообщалось ранее.28. Здесь перед синтезом частиц были приготовлены два раствора: раствор 1, содержащий 19.0 ммоль ТЭОС в 33.3 мл EtOH, и раствор 2, содержащий 0.23 ммоль KCl в 9 мл аммиака, 65 мл EtOH и 6.75 мл H.2О. Для синтеза Раствор 2 помещали в круглодонную колбу емкостью 250 мл, нагретую до 50°C, при перемешивании со скоростью 300 об/мин в течение 15 мин. Затем к раствору 1 по каплям добавляли раствор 2 (скорость подачи 0.2 мл в мин).-1). После добавления Раствора 1 полученные частицы очищали центрифугированием при 18,300°С.g в течение 3 минут и промывали EtOH пять раз. Наконец, SiO2 микрочастицы сушили под вакуумом.
Прививка частиц субмикронного размера силан-ПЭГ5k
20 мг мл-1 раствор силан–ПЭГ5k (Sigma Aldrich) в 98% EtOH добавляли к раствору smSiP в концентрации 5 мг мл.-1 в EtOH 98% и 2.8% аммиака. Смесь перемешивали в течение ночи при комнатной температуре и частицы извлекали центрифугированием при 18,300°С.g на 3 мин. Наконец, частицы трижды промывали дистиллированной водой и сушили в вакууме в течение ночи. Промывные растворы лиофилизировали в течение ночи и количество неприсоединившегося силана-ПЭГ5k взвешенные для расчета выхода реакции. 0.05 мг мл-1 раствор смСиП–ПЭГ5k в дистиллированной воде использовали для дальнейших реакций радиоактивного мечения.
[68Ga]GaCl3
Галлий-68 элюировали как [68Ga]GaCl3 от Эккерта и Циглера 68Ge /68Генератор Ga в сверхчистой HCl (4 мл, 0.1 М), изготовленный в соответствии с требованиями надлежащей производственной практики (ABX).
Концентрация [68Ga]GaCl3 элюирование катионообменником
Концентрацию элюата осуществляли с использованием установки, описанной на дополнительном рисунке. 1. Во-первых, 4 мл [68Ga]GaCl3 элюат загружали в картридж Strata-X-C 33u (Phenomenex) и элюат отбрасывали. Затем картридж промывали 5 мл раствора ацетона/0.1 М HCl (80:20) и элюат отбрасывали. Наконец, концентрированное [68Ga]GaCl3 собирали добавлением 700 мкл раствора ацетон/0.05 М HCl (98:2), сушили под азотом.2 поток и ресуспендировали в 50 мкл 0.5 М буфера HEPES (рН 4.9). Радио-ТСХ проводилась на разных этапах для контроля качества. Протокол занимает около 20 минут, обеспечивая выход восстановления 86.2 ± 8.5%.
Радиомечение частиц кремнезема в различных концентрациях с помощью 68Ga
Частицы кремнезема ресуспендировали в различных концентрациях (от 1 до 0.002 мг мл).-1) в 0.5 М буфере HEPES (рН 4.9). Затем 50 мкл раствора добавляли в реакционную пробирку перед добавлением концентрированного [68Ga]GaCl3 элюирование в 50 мкл 0.5 М HEPES-буфера (рН 4.9). Реакции проводили при 90 °C в течение 30 мин и проводили радио-ТСХ для расчета радиохимического выхода.
Измерение концентрации частиц методом проточной цитометрии
Концентрации частиц рассчитывали методом проточной цитометрии с использованием счетных шариков (CountBright Absolute Counting Beads, Invitrogen) в соответствии с инструкциями производителя. Частицы кремнезема ресуспендировали в концентрации 0.05 мг/мл.-1, обрабатывали ультразвуком в течение 10 минут и пропускали через фильтр с отсечкой 10 мкм (шприцевой фильтр KX, нейлон, 25 мм, 10 мкм). Счетные бусины CountBright Absolute нагревали до комнатной температуры и перемешивали на встряхивании в течение 30 секунд. Затем к 50 мкл частиц диоксида кремния добавляли 300 мкл шариков и смесь перемешивали на встряхивании в течение 30 мин до получения гомогенного раствора. Образец анализировали на проточном цитометре и установили порог прямого рассеяния (FSC) так, чтобы он включал шарики и частицы на графике линейного FSC и линейного рассеяния. После этого напряжение флуоресцентного детектора регулировали для счетных шариков и применяли стратегию стробирования для изоляции частиц кремнезема и популяций счетных шариков. Наконец, были нарисованы ворота для частиц и шариков для абсолютного счета, и для каждого образца было зарегистрировано 1,000 событий с шариками. Используя эту стратегию, количество частиц в растворе рассчитывалось по следующему уравнению:
$$begin{array}{l}displaystyle{mathrm{Absolute}},{mathrm{count}},left(frac{mathrm{Particles}}{{{upmu l}}}right)=displaystylefrac{({mathrm{ Частицы}},{mathrm{count}},times,{mathrm{Counting}},{mathrm{бусины}},{mathrm{объем}})}{({mathrm{Counting}},{mathrm{бусины}} ,{mathrm{count}},times,{mathrm{Частицы}},{mathrm{объем}})} раз,{mathrm{Подсчет}},{mathrm{бусинки}},{mathrm{концентрация}}left(frac {{mathrm{Бусины}}}{{{upmu l}}}right)end{array}$$
Радиомечение 500 смСиП
Пятьсот smSiP добавляли к 50 мкл концентрированного [68Ga]GaCl3 элюирование в 0.5 М HEPES-буфере, pH 4.9. Затем добавляли 5.6 мкл полисорбата 80 и смесь нагревали при 90°C в течение 30 мин при 900 об/мин в термическом смесителе. После этого был разработан окончательный протокол многоступенчатой очистки для удаления непрореагировавших/коллоидных частиц. 68Ga. Добавляли пятьдесят микролитров 10 мМ ЭДТА и смесь инкубировали 5 минут при комнатной температуре. Затем частицы центрифугировали в течение 3 минут при 18,300°С.g, ресуспендировали в 500 мкл PBS, содержащего 1 мМ ЭДТА + 0.1% полисорбата 80, и осторожно перемешивали на встряхивании в течение 10 с. Частицы снова центрифугировали, промывали раствором 0.1 мМ ЭДТА + 0.1% полисорбата 80 в PBS и осторожно перемешивали на вортексе в течение 10 с. Наконец, частицы центрифугировали и промывали еще пять раз PBS + 0.1% полисорбата 80 и ресуспендировали в 500 мкл PBS. Реакцию мечения радиоактивным изотопом контролировали с помощью радио-ТСХ во время последовательных стадий реакции для оценки присутствия коллоидов (которые можно спутать с частицами, если их не удалить должным образом), радиоактивной метки частиц и чистоты конечного продукта. RLY рассчитывали путем сравнения количества радиоактивности в частицах и супернатантах после стадий промывания.
фракционирование
Для стратегии фракционирования объемы от 0.5 до 20 мкл 68Ga-smSiP при теоретической концентрации 1 частица мкл-1 добавляли в разные пробирки для образцов с шагом 1 мкл (0.5, 1, 2, 3…) и добавляли PBS, чтобы довести конечный объем до 50 мкл. Затем 37.5 мкл из первой пробирки перенесли во вторую пробирку для образца, 25 мкл из второй пробирки в третью пробирку и, наконец, 12.5 мкл из третьей пробирки в четвертую пробирку. Эта стратегия обеспечивает четыре пробирки на образец с конечным объемом 12.5 мкл на пробирку. Радиоактивность в каждой пробирке измеряли с помощью гамма-счетчика и значения рассчитывали в кБк с использованием калибровочной кривой для дальнейшего сравнения и анализа. Образцы, содержащие большую часть радиоактивности только в одной пробирке, были обработаны ультразвуком в течение 30 секунд при комнатной температуре и подвергнуты второму этапу фракционирования. Затем образцы, в которых вся радиоактивность была обнаружена в одной пробирке (с незначительной активностью в трех других пробирках), использовались для дальнейших экспериментов in vivo/ex vivo.
Фантомная визуализация ПЭТ/КТ
Эксперимент по фантомному изображению был проведен с одним 68Га-смСиП. Канюлю использовали для доставки частицы в пробирку для образца, чтобы оценить, может ли одна частица остаться в трубке канюли во время введения. Вкратце, фантомную трубку поместили в сканер наноПЭТ/КТ, прикрепив к трубке конец кончика канюли. После начала получения ПЭТ частицу, ресуспендированную в 100 мкл PBS, доставляли с помощью инсулинового шприца, прикрепленного к началу канюли. Затем канюлю промывали 50 мкл PBS, чтобы обеспечить доставку частиц в фантомную трубку. Получение ПЭТ проводилось в течение 2 часов с последующим стандартным компьютерным сканированием.
ПЭТ/КТ in vivo
Исследования изображений животных прошли этическую проверку и проводились в соответствии с Законом о животных (научные процедуры) 1986 года (ASPA) и правилами Министерства внутренних дел Великобритании, регулирующими эксперименты на животных. Визуализацию in vivo проводили на здоровых 8-недельных мышах BALB/c. Животных анестезировали изофлюраном (2–3% в кислороде), канюлировали и помещали на кровать сканера под наркозом. Кровать нагревалась до 37°C за счет внутреннего потока воздуха, чтобы поддерживать нормальную температуру тела животного, а частоту дыхания контролировали и поддерживали на уровне 60–80 вдохов в минуту.-1 на протяжении всего сканирования. Важно поддерживать контроль над температурой животного, поскольку неожиданное падение температуры может привести к снижению скорости движения частиц в крови. Один 68Га-смСиП (n = 4) или 68Ga-smSiP–ПЭГ5k частица (n = 2) вводили через канюлю в 100 мкл PBS с последующей промывкой 50 мкл PBS после начала сбора данных ПЭТ (режим совпадения 1:5; временное окно совпадения 5 нс). ПЭТ записывали в течение 2 часов, а затем проводили полукруговую компьютерную томографию. На протяжении всего процесса контролировали температуру тела животного и частоту дыхания. Динамические изображения ПЭТ/КТ были реконструированы с использованием 3D-реконструкции Tera-Tomo (энергетическое окно 400–600 кэВ, режим совпадения 1:5, 20 итераций и 1 подмножество) с размером вокселей 0.4 × 0.4 ×0.4 мм.3 и с поправкой на затухание, разброс и затухание. Данные в режиме списка для всех приобретений ПЭТ/ПЭТ можно найти по адресу 68Ga-smSiP по ссылке. 29 и для 68Ga-smSiP–ПЭГ5k в исх. 30.
В реальном времени отслеживание
Сначала данные были экспортированы из сканера в формате списка (то есть в формате с отметкой времени и кристаллическим индексом для обнаруженных фотонов совпадений). Для преобразования индексов кристаллов в позиции в миллиметрах было применено геометрическое преобразование. Метод Бирмингема итеративно вычисляет MDP из подмножества всех LoR. Это делается путем отбрасывания LoR, которые находятся дальше заданного расстояния от MDP, поскольку они могут возникнуть из-за ложных LoR, например LoR, которые могут возникнуть из-за разброса. MDP уточняется с каждой итерацией; количество итераций фактически устанавливается f-фактор и относится к общему количеству LoR, которые используются для оценки конечного положения частицы в этом подмножестве (например, f-коэффициент 0.5 означает, что цикл итерации завершится, когда останется 50% LoR в подмножестве). Количество LoR, используемых в подмножестве, может быть уменьшено для улучшения временной выборки (подмножества являются последовательными во времени без перекрытия) за счет увеличения неопределенности положения (более подробную информацию об алгоритме можно найти в Parker et al.5) Метод Бирмингема использовался для анализа данных в режиме списка от ПЭТ-сканера. Для отслеживания частиц у мышей использовался адаптивный размер выборки. Размер выборки был установлен таким образом, чтобы обеспечить баланс достаточной временной выборки и минимизировать ошибки позиционирования. Размер выборки от 100 до 200 LoR использовался на ранних стадиях сканирования (<60 секунд от начала сканирования), при этом f = 0.1, что дает интервалы примерно 1–5 с. При времени сканирования >60 с размеры выборки варьировались от 1,000 до 2,000, что давало временные интервалы от 30 до 60 с в зависимости от эксперимента in vivo. Количество отсчетов, используемых для расчета MDP (на последней итерации), можно найти, умножив размер выборки на f-значение фактора. Эти параметры были основаны на предыдущем опыте и информации из предыдущих публикаций.1.
Скорость была получена как (sqrt{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) в котором ({v}_{м}^{2}) это скорость в x, y и z направления.
Поглощение органов ex vivo
Поглощение в различных органах оценивали с помощью гамма-счета. После визуализации ПЭТ/КТ in vivo животных умерщвляли путем смещения шейных позвонков, вырезали органы и взвешивали для подсчета радиоактивности на гамма-счетчике (LKB Wallac 1282 Compugamma CS). Данные выражали в процентах от введенной дозы (доза в органе/общая введенная доза) на грамм ткани (%ID г-1).
Авторадиография
Радиоактивность в легких отслеживали с помощью детектора радиации (зонд EP15, Morgan), легкие разрезали на небольшие участки скальпелем до получения небольшого участка ткани с радиоактивным сигналом. Ткань мгновенно замораживали в изопропаноле -80°С. Сразу после замораживания ткань помещали в среду с оптимальной температурой резки и разрезали в криостате на кусочки толщиной 20 мкм. Каждый срез исследовался детектором до тех пор, пока не был обнаружен радиоактивный срез. Предыдущий (ниже фона), радиоактивный и следующий (ниже фона) срезы помещали на предметное стекло микроскопа Superfrost (Epredia). Остальная часть оставшейся ткани также была ниже фона. Предметное стекло с тремя секциями накрывали пищевой пленкой и помещали на ночь в пластинку для авторадиографии GE. Пластину анализировали с использованием GE Amersham Typhoon с разрешением 25 мкм и настройкой ФЭУ 4,000. Ауторадиографическое изображение накладывалось на изображение ткани, показывающее одно пятно радиоактивности в радиоактивном срезе. Для количественного определения были приготовлены стандарты с использованием различных известных видов деятельности, и каждый из них был нанесен на бумагу в виде квинтета по 1 мкл. Пятна инкубировали на том же люминесцентном экране для хранения, BAS-IP MS (многоцелевой стандарт) от GE, для количественного определения отдельных частиц. Изображение было получено с помощью Amersham Typhoon 5 с управляющим программным обеспечением версии 2.0 в режиме люминофора с размером пикселя 100 мкм и чувствительностью 4,000. Изображения были количественно оценены с помощью программного обеспечения ImageQantTL v10.0-261 с использованием набора инструментов для количественного анализа геля. Пятна корректировались выбором области непосредственно до или после пятна в качестве постоянного фона. Полученный объем пятна использовался для расчета Бк в частице на основе калибровочной кривой.
Статистика и воспроизводимость
Для количественного анализа анализировали минимум три биологические повторы, исключая данные in vivo. 68Ga-smSiP–ПЭГ5k (n = 2). Данные были проанализированы с помощью обычного однофакторного дисперсионного анализа (ANOVA) с использованием критерия множественных сравнений Даннетта и критерия Стьюдента. t-тест. А P значение <0.05 считалось статистически значимым.
- SEO-контент и PR-распределение. Получите усиление сегодня.
- PlatoData.Network Вертикальный генеративный ИИ. Расширьте возможности себя. Доступ здесь.
- ПлатонАйСтрим. Интеллект Web3. Расширение знаний. Доступ здесь.
- ПлатонЭСГ. Углерод, чистые технологии, Энергия, Окружающая среда, Солнечная, Управление отходами. Доступ здесь.
- ПлатонЗдоровье. Биотехнологии и клинические исследования. Доступ здесь.
- Источник: https://www.nature.com/articles/s41565-023-01589-8
- :является
- :нет
- :куда
- ][п
- 000
- 1
- 10
- 100
- 12
- 15%
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- Absolute
- соответствие
- Достигать
- приобретенный
- приобретение
- приобретения
- Действие (Act):
- активно
- деятельность
- адаптивный
- добавленный
- добавить
- дополнение
- Отрегулированный
- вводить
- администрация
- авансы
- После
- потом
- снова
- AIR
- AL
- алгоритм
- Все
- причислены
- аммоний
- количество
- an
- анализировать
- анализ
- Ведущий
- и
- животное
- животные
- прикладной
- примерно
- МЫ
- возникать
- AS
- At
- b
- фон
- Баланс
- Использование темпера с изогнутым основанием
- основанный
- основа
- BD
- BE
- до
- начало
- ниже
- между
- Бирмингем
- кровь
- тело
- кратко
- приносить
- буфер
- by
- вычислять
- рассчитанный
- исчисляет
- расчет
- CAN
- проводятся
- Катализатор
- ячейка
- химических веществ
- Выбирая
- нажмите на
- совпадение
- сравнение
- сравнения
- состоящие
- концентрированный
- концентрации
- проводятся
- спутанный
- последовательный
- считается
- постоянная
- непрерывно
- контроль
- контроль
- конвертировать
- исправленный
- Цена
- может
- счетчик
- подсчет
- покрытый
- Crystal
- cs
- кривая
- Порез
- резки
- данным
- доставить
- поставляется
- поставка
- в зависимости
- описано
- предназначенный
- подробнее
- обнаруженный
- определены
- развитый
- Различия
- различный
- инструкция
- вывих
- расстояние
- приносит
- дозировать
- обращается
- Падение
- в течение
- динамический
- e
- Е & Т
- каждый
- Рано
- фактически
- электролит
- встроенный
- излучение
- занятых
- конец
- энергетика
- Проект и
- обеспечивать
- Оборудование
- ошибки
- оценка
- Эфир (ETH)
- оценивать
- оценивается
- События
- пример
- Кроме
- без учета
- опыт
- эксперимент
- Эксперименты
- выраженный
- ложный
- Фига
- фильм
- фильтр
- окончательный
- в заключение
- First
- 5
- поток
- следует
- после
- Что касается
- формат
- вперед
- найденный
- 4
- Четвертый
- Замораживание
- от
- замороженные
- FSC
- далее
- ворота
- ge
- генератор
- стекло
- хорошо
- руководящий
- Грамм
- Рост
- здоровый
- здесь
- Главная
- Домашний офис
- HTTPS
- if
- изображение
- изображений
- Изображениями
- немедленно
- важную
- улучшать
- in
- включают
- повышение
- инкубационных
- независимые
- индекс
- Индексы
- сообщил
- мгновение
- инструкции
- инструмент
- инструменты
- интегрированный
- Интерфейс
- в нашей внутренней среде,
- в
- IT
- итерация
- итерации
- Сохранить
- известный
- Kx
- вести
- Вероятно
- LINK
- Легкие
- сохранение
- изготовлен
- производство
- материала
- Май..
- означает
- измеренный
- измерение
- средний
- метод
- методы
- мышей
- микрон
- Микроскоп
- мин
- минимизация
- минимальный
- сочетание
- смесь
- ML
- Мобильный телефон
- режим
- контролируемый
- БОЛЕЕ
- Морган
- самых
- MS
- с разными
- умножения
- нанотехнологии
- природа
- следующий
- нет
- "обычные"
- номер
- получать
- полученный
- of
- Офис
- on
- ONE
- только
- против
- оптимальный
- or
- обычный
- Другое
- в противном случае
- внешний
- за
- всю ночь
- Oxygen
- бумага & картон
- параметры
- частица
- Прошло
- PBS
- для
- процент
- выполнены
- домашнее животное
- фантом
- фаза
- фотон
- картина
- Pixel
- размещенный
- Платон
- Платон Интеллектуальные данные
- ПлатонДанные
- популяции
- часть
- должность
- позиционирование
- позитрон
- практика
- подготовленный
- присутствие
- предыдущий
- предварительно
- Простое число
- Предварительный
- зонд
- Процедуры
- процесс
- производит
- Продукт
- должным образом
- протокол
- обеспечивать
- приводит
- обеспечение
- купленный
- квантование
- количественный
- количество
- R
- излучение
- Радио
- ассортимент
- Обменный курс
- реакция
- реакции
- реального времени
- получила
- последний
- записанный
- выздоровление
- Цена снижена
- снижение
- ссылка
- рафинированный
- область
- правила
- относится
- оставаться
- осталось
- удаление
- удален
- копирует
- Требования
- Постановления
- ОТДЫХ
- в результате
- обзоре
- отзывы
- Комната
- Run
- s
- то же
- сканирование
- сканирование
- сканирует
- SCI
- научный
- экран
- Во-вторых
- секунды
- разделах
- SEM
- чувствительность
- набор
- установка
- установка
- показ
- Сигма
- сигнал
- значительный
- кремний
- одинарной
- Размер
- Размеры
- Ломтик
- Слайд-шоу
- небольшой
- Снэп
- Software
- Решение
- Решения
- Источник
- конкретный
- Спотовая торговля
- пятна
- этапы
- стандарт
- стандартов
- Начало
- Начало
- заявил
- статистически
- Шаг
- Шаги
- диск
- Стратегия
- поток
- учился
- исследования
- изучение
- достаточный
- поставка
- опрошенных
- синтез
- принимает
- техника
- технологии
- тестXNUMX
- чем
- который
- Ассоциация
- тогда
- теоретический
- тепловой
- Эти
- В третьих
- этой
- три
- порог
- Через
- по всему
- время
- раз
- отметка времени
- тип
- туалетная бумага
- в
- инструментом
- Ящик для инструментов
- Всего
- трек
- Отслеживание
- трансформация
- ловушке
- два
- Uk
- Неопределенность
- под
- Неожиданный
- единиц
- до
- используемый
- через
- вакуум
- ценностное
- Наши ценности
- Скорость
- версия
- Против
- естественных условиях
- напряжение
- объем
- тома
- Воксельный
- W
- законопроект
- мойка
- Вода
- были
- когда
- будь то
- который
- в то время как
- все
- будете
- окно
- в
- Уступать
- дали
- уступая
- зефирнет
- ZIP