16 ianuarie 2024
(Știri Nanowerk) O reacție chimică cheie – în care mișcarea protonilor între suprafața unui electrod și un electrolit antrenează un curent electric – este o etapă critică în multe tehnologii energetice, inclusiv celulele de combustie și electrolizoarele utilizate pentru a produce hidrogen gazos. Pentru prima dată, chimiștii MIT au detaliat modul în care se întâmplă aceste transferuri de electroni cuplați de protoni la suprafața unui electrod. Rezultatele lor ar putea ajuta cercetătorii să proiecteze celule de combustibil, baterii sau alte tehnologii energetice mai eficiente. „Avansul nostru în această lucrare a fost studiul și înțelegerea naturii modului în care acești electroni și protoni se cuplează la un loc de suprafață, ceea ce este relevant pentru reacțiile catalitice care sunt importante în contextul dispozitivelor de conversie a energiei sau al reacțiilor catalitice”, spune Yogesh Surendranath, un profesor de chimie și inginerie chimică la MIT și autorul principal al studiului. Printre descoperirile lor, cercetătorii au reușit să urmărească exact modul în care modificările pH-ului soluției de electrolit din jurul unui electrod afectează rata de mișcare a protonilor și fluxul de electroni în interiorul electrodului. Studentul absolvent al MIT Noah Lewis este autorul principal al lucrării, care apare astăzi în Chimia naturii („Un cadru mecanicist la nivel molecular pentru cinetica de transfer de electroni cuplați cu protoni interfacial”). Ryan Bisbey, fost post-doctorat MIT; Karl Westendorff, un student absolvent al MIT; și Alexander Soudackov, cercetător de la Universitatea Yale, sunt, de asemenea, autori ai lucrării.
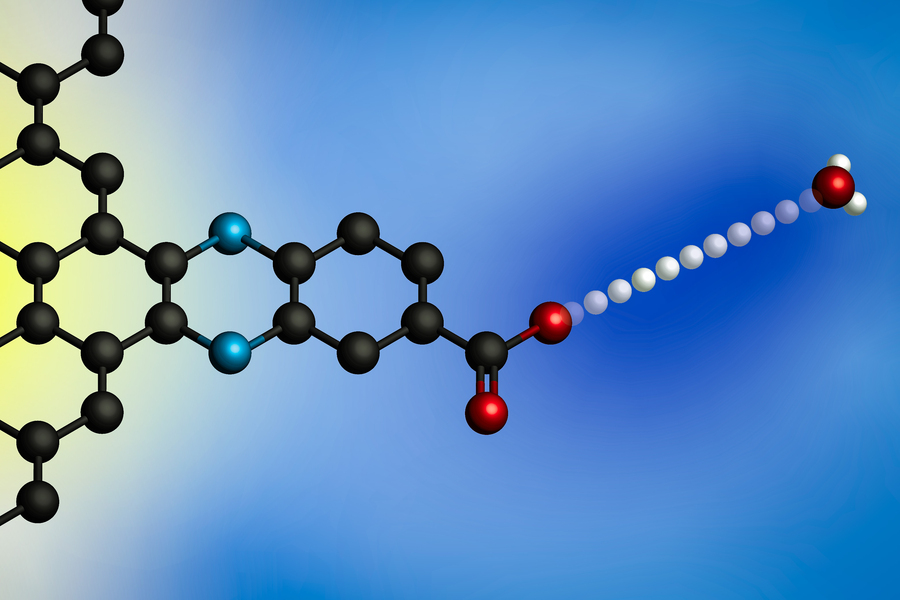 Aplicarea unui potențial electric determină transferul unui proton de la un ion de hidroniu (în dreapta) la suprafața unui electrod. Folosind electrozi cu situsuri de legare a protonilor definite molecular, cercetătorii MIT au dezvoltat un model general pentru aceste reacții interfațiale de transfer de electroni cuplați cu protoni. (Imagine: Cu amabilitatea cercetătorilor)
Aplicarea unui potențial electric determină transferul unui proton de la un ion de hidroniu (în dreapta) la suprafața unui electrod. Folosind electrozi cu situsuri de legare a protonilor definite molecular, cercetătorii MIT au dezvoltat un model general pentru aceste reacții interfațiale de transfer de electroni cuplați cu protoni. (Imagine: Cu amabilitatea cercetătorilor)
 Aplicarea unui potențial electric determină transferul unui proton de la un ion de hidroniu (în dreapta) la suprafața unui electrod. Folosind electrozi cu situsuri de legare a protonilor definite molecular, cercetătorii MIT au dezvoltat un model general pentru aceste reacții interfațiale de transfer de electroni cuplați cu protoni. (Imagine: Cu amabilitatea cercetătorilor)
Aplicarea unui potențial electric determină transferul unui proton de la un ion de hidroniu (în dreapta) la suprafața unui electrod. Folosind electrozi cu situsuri de legare a protonilor definite molecular, cercetătorii MIT au dezvoltat un model general pentru aceste reacții interfațiale de transfer de electroni cuplați cu protoni. (Imagine: Cu amabilitatea cercetătorilor)
Protoni care trec
Transferul de electroni cuplați de protoni are loc atunci când o moleculă, adesea apă sau un acid, transferă un proton către o altă moleculă sau pe o suprafață a unui electrod, ceea ce stimulează acceptorul de protoni să preia și un electron. Acest tip de reacție a fost valorificat pentru multe aplicații energetice. „Aceste reacții de transfer de electroni cuplați cu protoni sunt omniprezente. Ele sunt adesea pași cheie în mecanismele catalitice și sunt deosebit de importanți pentru procesele de conversie a energiei, cum ar fi generarea de hidrogen sau cataliza celulelor de combustie”, spune Surendranath. Într-un electrolizor care generează hidrogen, această abordare este utilizată pentru a elimina protonii din apă și pentru a adăuga electroni la protoni pentru a forma hidrogen gazos. Într-o pilă de combustie, electricitatea este generată atunci când protonii și electronii sunt îndepărtați din hidrogenul gazos și adăugați la oxigen pentru a forma apă. Transferul de electroni cuplați de protoni este comun în multe alte tipuri de reacții chimice, de exemplu, reducerea dioxidului de carbon (conversia dioxidului de carbon în combustibili chimici prin adăugarea de electroni și protoni). Oamenii de știință au învățat multe despre cum apar aceste reacții atunci când acceptorii de protoni sunt molecule, deoarece pot controla cu precizie structura fiecărei molecule și pot observa modul în care electronii și protonii trec între ei. Cu toate acestea, atunci când transferul de electroni cuplați cu protoni are loc la suprafața unui electrod, procesul este mult mai dificil de studiat, deoarece suprafețele electrozilor sunt de obicei foarte eterogene, cu multe locuri diferite de care un proton s-ar putea lega. Pentru a depăși acest obstacol, echipa MIT a dezvoltat o modalitate de a proiecta suprafețele electrozilor care le oferă un control mult mai precis asupra compoziției suprafeței electrodului. Electrozii lor constau din foi de grafen cu compuși organici, care conțin inele, atașați la suprafață. La sfârșitul fiecăreia dintre aceste molecule organice se află un ion de oxigen încărcat negativ care poate accepta protoni din soluția înconjurătoare, ceea ce face ca un electron să curgă din circuit în suprafața grafitică. „Putem crea un electrod care nu constă dintr-o mare diversitate de site-uri, ci este o gamă uniformă de un singur tip de site-uri foarte bine definite, care pot lega fiecare un proton cu aceeași afinitate”, spune Surendranath. „Din moment ce avem aceste site-uri foarte bine definite, ceea ce ne-a permis să facem a fost să dezvăluim cinetica acestor procese.” Folosind acest sistem, cercetătorii au reușit să măsoare fluxul de curent electric către electrozi, ceea ce le-a permis să calculeze rata transferului de protoni către ionul de oxigen de la suprafață la echilibru - starea în care ratele donării de protoni la suprafață. iar transferul de protoni înapoi în soluție de la suprafață sunt egale. Ei au descoperit că pH-ul soluției din jur are un efect semnificativ asupra acestei rate: cele mai mari rate au avut loc la extremele scalei de pH - pH 0, cel mai acid, și pH 14, cel mai bazic. Pentru a explica aceste rezultate, cercetătorii au dezvoltat un model bazat pe două posibile reacții care pot apărea la electrod. 3O+), care sunt în concentrație mare în soluții puternic acide, eliberează protoni la suprafața ionilor de oxigen, generând apă. În al doilea, apa livrează protoni la suprafața ionilor de oxigen, generând ioni de hidroxid (OH-), care sunt în concentrație mare în soluții puternic bazice. Cu toate acestea, viteza la pH 0 este de aproximativ patru ori mai rapidă decât rata la pH 14, în parte pentru că hidroniul renunță la protoni la o viteză mai rapidă decât apa.O reacție de reconsiderat
Cercetătorii au mai descoperit, spre surprinderea lor, că cele două reacții au viteze egale nu la pH neutru 7, unde concentrațiile de hidroniu și hidroxid sunt egale, ci la pH 10, unde concentrația de ioni de hidroxid este de 1 milion de ori mai mare decât cea a hidroniului. Modelul sugerează că acest lucru se datorează faptului că reacția directă care implică donarea de protoni din hidroniu sau apă contribuie mai mult la rata globală decât reacția inversă care implică îndepărtarea protonilor de către apă sau hidroxid. Modelele existente despre modul în care apar aceste reacții la suprafețele electrozilor presupun că reacțiile înainte și înapoi contribuie în mod egal la rata generală, astfel încât noile descoperiri sugerează că aceste modele ar putea trebui reconsiderate, spun cercetătorii. „Aceasta este ipoteza implicită, că reacțiile directe și inverse contribuie în mod egal la rata de reacție”, spune Surendranath. „Descoperirea noastră este cu adevărat revelatoare, deoarece înseamnă că presupunerea pe care oamenii o folosesc pentru a analiza totul, de la cataliza celulelor de combustie până la evoluția hidrogenului, ar putea fi ceva pe care trebuie să o revizuim.” Cercetătorii își folosesc acum configurația experimentală pentru a studia modul în care adăugarea diferitelor tipuri de ioni la soluția de electrolit care înconjoară electrodul poate accelera sau încetini rata fluxului de electroni cuplați de protoni. „Cu sistemul nostru, știm că site-urile noastre sunt constante și nu se afectează unul pe celălalt, așa că putem citi ce influențează schimbarea soluției asupra reacției de la suprafață”, spune Lewis.- Distribuție de conținut bazat pe SEO și PR. Amplifică-te astăzi.
- PlatoData.Network Vertical Generative Ai. Împuterniciți-vă. Accesați Aici.
- PlatoAiStream. Web3 Intelligence. Cunoștințe amplificate. Accesați Aici.
- PlatoESG. carbon, CleanTech, Energie, Mediu inconjurator, Solar, Managementul deșeurilor. Accesați Aici.
- PlatoHealth. Biotehnologie și Inteligență pentru studii clinice. Accesați Aici.
- Sursa: https://www.nanowerk.com/news2/green/newsid=64425.php
- :are
- :este
- :nu
- :Unde
- $UP
- 1
- 10
- 11
- 13
- 14
- 16
- 7
- 8
- a
- Capabil
- Despre Noi
- Accept
- adăuga
- adăugat
- adăugare
- avansa
- afecta
- care afectează
- Alexander
- permis
- de asemenea
- printre
- an
- analiza
- și
- O alta
- apare
- aplicatii
- Aplicarea
- abordare
- SUNT
- Mulțime
- AS
- asuma
- presupunere
- At
- autor
- Autorii
- înapoi
- bazat
- de bază
- baterii
- BE
- deoarece
- fost
- între
- lega
- legare
- dar
- by
- calcula
- CAN
- carbon
- dioxid de carbon
- cauze
- celulă
- Celule
- Centru
- Schimbare
- Modificări
- încărcat
- chimic
- chimie
- Chimiștii
- Comun
- compoziție
- concentrare
- constant
- context
- a contribui
- contribuie
- Control
- Convertire
- ar putea
- Cuplu
- crea
- critic
- Curent
- Data
- afacere
- Mod implicit
- definit
- livra
- Oferă
- Amenajări
- detaliu
- dezvoltat
- Dispozitive
- diferit
- dificil
- a descoperit
- Diversitate
- do
- Nu
- face
- donaţie
- jos
- unități
- fiecare
- efect
- eficient
- electric
- electricitate
- electrolit
- electroni
- capăt
- se încheie
- energie
- Inginerie
- egal
- la fel de
- Echilibru
- Eter (ETH)
- tot
- evoluţie
- exact
- exemplu
- existent
- experimental
- Explica
- extremă
- mai repede
- descoperire
- constatările
- First
- prima dată
- debit
- Pentru
- formă
- Fost
- Înainte
- găsit
- patru
- Cadru
- din
- Combustibil
- celule de combustibil
- combustibili
- GAS
- General
- generată
- generator
- generaţie
- oferă
- absolvent
- Grafenul
- mare
- întâmpla
- valorificat
- Avea
- inimă
- ajutor
- Înalt
- cea mai mare
- Cum
- Totuși
- HTTPS
- hidrogen
- imagine
- important
- in
- Inclusiv
- în
- implicând
- IT
- jpg
- Karl
- Cheie
- Copil
- Cunoaște
- conduce
- învățat
- Lewis
- multe
- Mai..
- mijloace
- măsura
- mecanisme
- De mijloc
- milion
- MIT
- absolvent al MIT
- model
- Modele
- moleculă
- mai mult
- mai eficient
- cele mai multe
- mişcare
- mişcare
- mult
- Natură
- Nevoie
- negativ
- Neutru
- Nou
- Noe
- acum
- observa
- obstacol
- avea loc
- a avut loc
- of
- de multe ori
- on
- or
- organic
- Altele
- al nostru
- afară
- peste
- global
- Învinge
- Oxigen
- Hârtie
- parte
- în special
- trece
- oameni
- Plato
- Informații despre date Platon
- PlatoData
- posibil
- potenţial
- potenţial
- precis
- tocmai
- proces
- procese
- produce
- Profesor
- protoni
- rată
- tarife
- reacţie
- Reacții
- Citeste
- într-adevăr
- reducere
- îndepărtare
- scoate
- îndepărtat
- Din surse regenerabile
- energie regenerabila
- cercetare
- cercetători
- REZULTATE
- dezvaluie
- inversa
- dreapta
- Ryan
- s
- acelaşi
- Spune
- spune
- Scară
- Om de stiinta
- oamenii de stiinta
- Al doilea
- senior
- configurarea
- semnificativ
- singur
- teren
- Centre de cercetare
- încetini
- So
- soluţie
- soluţii
- ceva
- viteză
- Stat
- Pas
- paşi
- stimulează
- tare
- structura
- student
- Studiu
- Studiu
- astfel de
- sugera
- sugerează
- Suprafață
- surpriză
- Înconjurător
- sistem
- Lua
- echipă
- Tehnologii
- decât
- acea
- Statul
- lor
- Lor
- Acestea
- ei
- acest
- aceste
- timp
- ori
- la
- astăzi
- urmări
- transfer
- Transferuri
- Două
- tip
- Tipuri
- omniprezent
- înţelegere
- universitate
- dezlega
- us
- utilizat
- folosind
- obișnuit
- foarte
- a fost
- Apă
- Cale..
- we
- bine definit
- au fost
- Ce
- cand
- care
- larg
- cu
- în
- zephyrnet