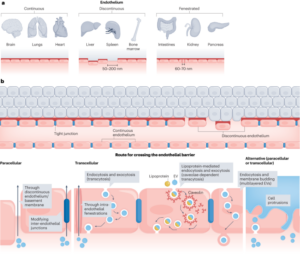
Toți reactivii au fost utilizați așa cum au fost primiți, dacă nu se specifică altfel. Toate substanțele chimice au fost achiziționate de la Sigma Aldrich, cu excepția granulelor de numărare (CountBright Absolute Counting Beads, Invitrogen). ζ-Potențialul a fost măsurat folosind un Zetasizer NanoZS90 (Malvern Instruments). Mărimea și morfologia particulelor au fost studiate prin SEM într-un microscop JEOL JSM 7800F Prime cu EDS integrat pentru a furniza analiza elementară. Mărimea particulelor a fost determinată prin măsurarea a 50 de particule independente. Cromatografia instantă radio în strat subțire (ITLC) a fost dezvoltată pe hârtie de cromatografie din microfibră de sticlă Agilent Technologies impregnată cu acid silicic și analizată folosind un scaner Lablogic Flow-count TLC și un detector cu tub fotomultiplicator (PMT) BioScan B-FC-3200 folosind software-ul Laura. Faza mobilă ITLC a fost compusă din acid citric 0.175 M și citrat trisodic 0.325 M în apă, dacă nu se specifică altfel. Probele radioactive au fost măsurate folosind un Capintec CRC-25R (Capintec) sau un LKB Wallac 1282 Compugamma CS (PerkinElmer) pentru care datele au fost colectate folosind software-ul EdenTerm. Experimentele de citometrie în flux au fost efectuate într-un sortator de celule BD FACSMelody folosind software-ul BD FACSChorus. Imaginile PET/CT au fost achiziționate folosind un scaner NanoPET/CT (Mediso), reconstruite folosind software-ul Nucline v.0.21, iar imaginile au fost analizate folosind software-ul VivoQuant (versiunea 3.5, InviCRO). Datele Listmode au fost obținute printr-un instrument software specific MATLAB dezvoltat de Mediso. Autoradiografia a fost efectuată cu un instrument GE Amersham Typhoon.
Sinteza particulelor de silice de dimensiuni sub-micrometrice
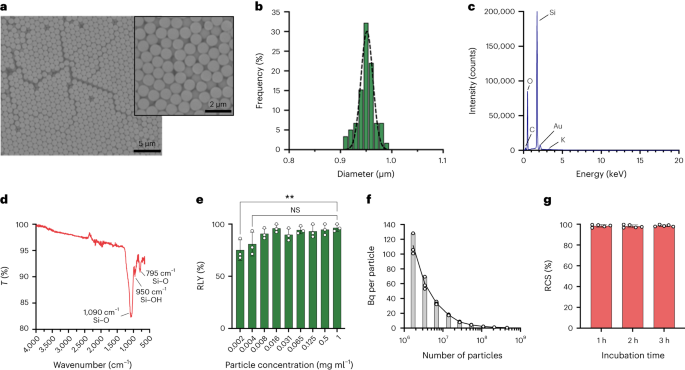
Particulele au fost sintetizate folosind metoda Stöber. Această metodă se bazează pe hidroliza și condensarea consecutivă a alcoxizilor de siliciu pentru a produce particule de silice monodisperse, sferice.27. Tetraetil ortosilicat (TEOS) a fost folosit ca sursă de siliciu, amoniacul ca catalizator de bază și clorură de potasiu ca electrolit. O soluție de TEOS în etanol a fost adăugată continuu la o soluție care conține catalizatorul și electrolitul. Modificarea cantității de pornire a reactivului sau a vitezei de adăugare oferă diferențe în dimensiunea particulelor așa cum a fost raportat anterior28. Aici au fost preparate două soluții înainte de sinteza particulelor: Soluția 1 care conține 19.0 mmol de TEOS în 33.3 ml de EtOH și Soluția 2 care conține 0.23 mmol de KCl în 9 ml de amoniac, 65 ml de EtOH și 6.75 ml de H.2O. Pentru sinteză, Soluția 2 a fost plasată într-un balon cu fund rotund de 250 ml încălzit la 50 °C sub agitare la 300 rpm timp de 15 min. Apoi, Soluția 1 a fost adăugată prin picurare la Soluția 2 (viteza de alimentare 0.2 ml min-1). După adăugarea Soluţiei 1, particulele obţinute au fost purificate prin centrifugare la 18,300g timp de 3 minute și spălat cu EtOH de cinci ori. În cele din urmă, SiO2 microparticulele au fost uscate sub vid.
Grefarea particulelor de dimensiuni sub-micrometrice cu silan-PEG5k
A 20 mg ml-1 soluție de silan-PEG5k (Sigma Aldrich) în EtOH 98% a fost adăugat peste o soluție de smSiP la 5 mg ml-1 în EtOH 98% și 2.8% amoniac. Amestecul a fost agitat peste noapte la temperatura camerei, iar particulele au fost recuperate prin centrifugare la 18,300°C.g timp de 3 min. În cele din urmă, particulele au fost spălate de trei ori cu apă distilată și uscate sub vid peste noapte. Soluțiile de spălare au fost liofilizate peste noapte și cantitatea de silan-PEG neatașat5k ponderat pentru calculul randamentului de reacție. A 0.05 mg ml-1 soluție de smSiP-PEG5k în apă distilată a fost folosită pentru alte reacții de radiomarcare.
[68Ga]GaCl3
Galiul-68 a fost eluat ca [68Ga]GaCl3 de la un Eckert și Ziegler 68GE/68Generator de Ga în HCI ultrapur (4 ml, 0.1 M) fabricat conform cerințelor de bune practici de fabricație (ABX).
Concentrația [68Ga]GaCl3 eluare prin schimb cationic
Concentrația de eluție a fost efectuată folosind configurația descrisă în Fig. 1. În primul rând, cei 4 ml de [68Ga]GaCl3 eluțiile au fost încărcate pe un cartuş Strata-XC 33u (Phenomenex) și eluatul a fost aruncat. Apoi, cartuşul a fost spălat cu 5 ml de soluţie de acetonă/HCI 0.1 M (80:20) şi eluatul a fost aruncat. În cele din urmă, concentratul [68Ga]GaCl3 a fost colectat prin adăugarea a 700 ui de soluție de acetonă/HCI 0.05 M (98:2), uscată sub azot.2 curent și resuspendat în 50 pl de tampon HEPES 0.5 M, (pH 4.9). Radio-TLC a fost efectuat la diferitele etape pentru controlul calității. Protocolul durează aproximativ 20 de minute, oferind un randament de recuperare de 86.2 ± 8.5%.
Radiomarcarea particulelor de silice la diferite concentrații cu 68Ga
Particulele de silice au fost resuspendate la diferite concentrații (de la 1 la 0.002 mg ml-1) în tampon HEPES 0.5 M (pH 4.9). Apoi, s-au adăugat 50 µl de soluție într-un tub de reacție înainte de adăugarea soluției concentrate [68Ga]GaCl3 eluare în 50 pl de tampon HEPES 0.5 M (pH 4.9). Reacțiile au fost conduse la 90 °C timp de 30 de minute și a fost efectuată radio-TLC pentru a calcula randamentul radiochimic.
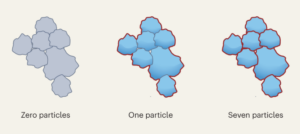
Măsurarea concentrației particulelor prin citometrie în flux
Concentrațiile de particule au fost calculate prin citometrie în flux utilizând bile de numărare (CountBright Absolute Counting Beads, Invitrogen) urmând instrucțiunile producătorului. Particulele de silice au fost resuspendate la 0.05 mg ml-1, sonicat timp de 10 minute și trecut printr-un filtru cu dimensiunea de tăiere de 10 um (filtru seringă KX, nailon, 25 mm, 10 um). Granulele de numărare absolute CountBright au fost încălzite la temperatura camerei și agitate timp de 30 de secunde. Apoi, s-au adăugat 50 ui de perle la 300 ui de particule de silice și amestecul a fost agitat timp de 30 de minute pentru a obține o soluție omogenă. Eșantionul a fost rulat pe citometrul de flux și pragul de împrăștiere direct (FSC) a fost stabilit pentru a include mărgelele și particulele pe diagrama de împrăștiere liniară-FSC față de partea liniară. Ulterior, tensiunea detectorului de fluorescență a fost ajustată pentru bilele de numărare și s-a efectuat o strategie de trecere pentru a izola particulele de silice și populațiile de granule de numărare. În cele din urmă, au fost desenate porțile de pe particule și granulele de numărare absolută și au fost înregistrate 1,000 de evenimente de granule pentru fiecare probă. Utilizând această strategie, numărul de particule în soluție a fost calculat folosind următoarea ecuație:
$$begin{array}{l}displaystyle{mathrm{Absolut}},{mathrm{count}},left(frac{mathrm{Particules}}{{{upmu l}}}right)=displaystylefrac{({mathrm{ Particule}},{mathrm{număr.}},timpli,{mathrm{Numărătoare}},{mathrm{margele}},{mathrm{volumul}})}{({mathrm{Numărătoare}},{mathrm{margele}} ,{mathrm{număr.}},ori,{mathrm{Particule}},{mathrm{volumul}})} ori,{mathrm{Numărătoare}},{mathrm{margele}},{mathrm{concentrație}}stânga(frac {{mathrm{Beads}}}{{{upmu l}}}right)end{array}$$
Radiomarcarea a 500 smSiP
Cinci sute de smSiP au fost adăugate la 50 pl de concentrat [68Ga]GaCl3 eluare în tampon HEPES 0.5 M pH 4.9. Apoi, s-au adăugat 5.6 ui de polisorbat 80 și amestecul a fost încălzit la 90 °C timp de 30 de minute la 900 rpm într-un amestecător termic. Ulterior, a fost proiectat un protocol final de purificare în mai multe etape pentru a îndepărta nereacționat/coloidal 68Ga. S-au adăugat cincizeci de microlitri de EDTA 10 mM, iar amestecul a fost incubat 5 minute la temperatura camerei. Apoi, particulele au fost centrifugate timp de 3 minute la 18,300g, resuspendat în 500 ui de PBS conţinând 1 mM EDTA + 0.1% polisorbat 80 şi agitat uşor timp de 10 s. Particulele au fost centrifugate din nou, spălate cu o soluție de 0.1 mM EDTA + 0.1% polisorbat 80 în PBS și agitate ușor timp de 10 s. În cele din urmă, particulele au fost centrifugate și spălate încă de cinci ori cu PBS + 0.1% polisorbat 80 și resuspendate în 500 ui PBS. Reacția de radiomarcare a fost monitorizată prin radio-TLC în timpul etapelor succesive de reacție pentru a evalua prezența coloizilor (care pot fi confundați cu particule dacă nu sunt îndepărtați corespunzător), radiomarcarea particulelor și puritatea produsului final. RLY a fost calculat prin comparație între cantitatea de radioactivitate din particule și supernatanți după etapele de spălare.
Fracționare
Pentru strategia de fracţionare, volume de la 0.5 µl până la 20 µl de 68Ga-smSiP la o concentrație teoretică de 1 particulă pl-1 au fost adăugate în diferite tuburi de probă în pași de 1 pl (0.5, 1, 2, 3...) și a fost adăugat PBS pentru a aduce volumul final la 50 pl. Apoi, 37.5 ui din primul tub au fost pipetați într-un al doilea tub de probă, 25 ui din al doilea tub într-un al treilea tub și în final 12.5 ui din al treilea tub într-un al patrulea tub. Această strategie oferă patru tuburi per probă cu un volum final de 12.5 µl per tub. Radioactivitatea din fiecare tub a fost măsurată într-un contor gamma și valorile au fost calculate în kBq utilizând o curbă de calibrare, pentru comparare și analiză ulterioară. Probele care conțineau cea mai mare parte a radioactivității într-un singur tub au fost supuse cu ultrasunete timp de 30 s la temperatura camerei și supuse unei a doua etape de fracționare. Apoi, probele în care toată radioactivitatea a fost găsită într-un singur tub (cu activitate neglijabilă în celelalte trei tuburi) au fost utilizate pentru experimente ulterioare in vivo/ex vivo.
Imagistica fantomă PET/CT
Un experiment de imagistică fantomă a fost efectuat cu unul 68Ga-smSiP. A fost folosită o canulă pentru a livra particula într-un tub de probă pentru a evalua dacă o singură particulă ar putea rămâne prinsă în tubul canulei în timpul administrării. Pe scurt, tubul fantomă a fost plasat în scanerul nanoPET/CT cu capătul vârfului canulei atașat de tub. După începerea achiziției PET, particula resuspendată în 100 pl de PBS a fost livrată cu o seringă de insulină atașată la începutul canulei. Apoi, canula a fost spălată cu 50 pl de PBS pentru a asigura livrarea particulei în tubul fantomă. Achiziția PET a fost efectuată timp de 2 ore, urmată de o scanare CT standard.
Imagistica PET/CT in vivo
Studiile de imagistică pe animale au fost revizuite din punct de vedere etic și efectuate în conformitate cu Legea privind animalele (proceduri științifice) din 1986 (ASPA) Reglementările Ministerului de Interne din Regatul Unit care reglementează experimentarea pe animale. Imagistica in vivo a fost efectuată la șoareci BALB/c sănătoși în vârstă de 8 săptămâni. Animalele au fost anesteziate cu izofluran (2-3% în oxigen), canulate și plasate pe patul scanerului sub anestezie. Patul a fost încălzit la 37 ° C prin fluxul de aer intern pentru a menține animalul la temperatura normală a corpului, iar rata de respirație a fost monitorizată și menținută la 60-80 respirații min.-1 pe tot parcursul scanării. Menținerea controlului asupra temperaturii animalelor este importantă, deoarece o scădere neașteptată a temperaturii ar putea duce la o reducere a vitezei particulei în sânge. unu 68Ga-smSiP (n = 4) sau 68Ga-smSiP–PEG5k particulă (n = 2) a fost administrat prin canulă în 100 ui de PBS, urmată de spălare cu 50 ui de PBS după începerea achiziției PET (modul de coincidență 1:5; fereastră de timp de coincidență de 5 ns). PET a fost înregistrat timp de 2 ore, apoi a fost efectuată o scanare CT semicirculară. Temperatura corpului animal și frecvența respiratorie au fost monitorizate pe parcursul întregului proces. Imaginile PET/CT dinamice au fost reconstruite folosind reconstrucția 3D Tera-Tomo (fereastră de energie 400–600 keV, mod de coincidență 1:5, 20 de iterații și 1 subset) la o dimensiune voxel de 0.4 × 0.4 × 0.4 mm3 și corectate pentru atenuare, împrăștiere și dezintegrare. Datele din modul listă pentru toate achizițiile PET/PEPT pot fi găsite pentru 68Ga-smSiP la ref. 29 si pentru 68Ga-smSiP–PEG5k la ref. 30.
Urmărire în timp real
Mai întâi, datele au fost exportate de la scaner în format listmode (adică un format cu un marcaj de timp și un index de cristal pentru fotonii de coincidență detectați). S-a aplicat o transformare geometrică pentru a converti din indici de cristal în poziție în unități mm. Metoda Birmingham calculează iterativ MDP dintr-un subset al tuturor LoR-urilor. Face acest lucru prin eliminarea LoR-urilor care sunt mai departe de o distanță stabilită de MDP, deoarece acestea pot apărea din LoR-uri false, de exemplu, LoR-uri care pot proveni din dispersie. MDP-ul este rafinat cu fiecare iterație; numărul de iterații este stabilit efectiv de către f-factor și se referă la numărul total de LoR care sunt utilizate pentru a estima poziția finală a particulelor în cadrul acelui subset (de exemplu, un f-factorul de 0.5 înseamnă că bucla de iterație se va termina când rămân 50% din LoR-urile din subset). Numărul de LoR-uri utilizate într-un subset poate fi redus pentru a îmbunătăți eșantionarea temporală (subseturile sunt consecutive în timp, fără suprapunere) cu prețul creșterii incertitudinii în poziție (mai multe detalii ale algoritmului pot fi găsite în Parker și colab.5) Metoda Birmingham a fost utilizată pentru a analiza datele în modul listă de la scanerul PET. O dimensiune adaptivă a eșantionului a fost utilizată pentru a urmări particulele la șoareci. Dimensiunea eșantionului a fost setată pentru a obține un echilibru de eșantionare temporală suficientă, minimizând în același timp erorile de poziționare. O dimensiune a eșantionului între 100 și 200 LoR a fost utilizată în etapele incipiente ale scanărilor (<60 s de la începutul scanării), cu f = 0.1, rezultând intervale de aproximativ 1–5 s. La timpi de scanare > 60 s, dimensiunile eșantionului au fost variate între 1,000 și 2,000, ceea ce a condus la intervale de timp cuprinse între 30 s și 60 s, în funcție de experimentul in vivo. Numărul de numărări utilizate pentru a calcula MDP (în iterația finală) poate fi găsit prin înmulțirea dimensiunii eșantionului cu f-valoarea factorului. Acești parametri s-au bazat pe experiența anterioară și au fost informați de publicațiile anterioare1.
Viteza a fost obtinuta ca (sqrt{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) Unde ({v}_{m}^{2}) este viteza în x, y și z direcții.
Captarea de organe ex vivo
Captarea în diferite organe a fost evaluată prin numărare gamma. După imagistica PET/CT in vivo, animalele au fost ucise prin dislocare cervicală și organele au fost excizate și cântărite pentru numărarea radioactivității într-un contor gamma (LKB Wallac 1282 Compugamma CS). Datele au fost exprimate ca doză procentuală injectată (doză în organ/doza totală injectată) per gram de țesut (% ID g-1).
autoradiografie
Radioactivitatea din plămâni a fost urmărită cu un detector de radiații (sondă EP15, Morgan), iar plămânii au fost tăiați în secțiuni mici cu un bisturiu până când a fost obținută o mică porțiune de țesut cu semnal radioactiv. Țesutul a fost congelat rapid în izopropanol la -80 °C. Imediat după congelare, țesutul a fost încorporat într-un mediu cu temperatură optimă de tăiere și tăiat într-un criostat în felii de 20 um. Fiecare felie a fost cercetată cu detectorul până când a fost găsită felia radioactivă. Secțiunea anterioară (sub fundal), radioactivă și următoarea (sub fundal) au fost plasate pe o lamă de microscop Superfrost (Epredia). Restul țesutului rămas era, de asemenea, sub fundal. Lama de microscop cu cele trei secțiuni a fost acoperită cu folie alimentară și s-a opus unei plăci de autoradiografie GE peste noapte. Placa a fost analizată folosind GE Amersham Typhoon cu rezoluție de 25 µm și setare PMT de 4,000. Imaginea autoradiografiei a fost suprapusă pe imaginea țesutului, arătând un punct de radioactivitate în felia radioactivă. Pentru cuantificare, standardele au fost pregătite în diferite activități cunoscute și fiecare a fost observat ca 1 µl cvintet în hârtie. Petele au fost incubate în același ecran cu fosfor de stocare, BAS-IP MS (Standard multifuncțional) de la GE, ca particulele individuale cuantificate. Imaginea a fost achiziționată cu Amersham Typhoon 5 cu software-ul de control versiunea 2.0 în modul fosfor, cu o dimensiune a pixelilor de 100 µm și o sensibilitate de 4,000. Imaginile au fost cuantificate cu software-ul ImageQantTL v10.0-261 folosind setul de instrumente de cuantificare a gelului. Petele au fost corectate prin alegerea unei regiuni imediat înainte sau după spot ca fundal constant. Volumul rezultat al spotului a fost utilizat pentru a calcula Bq din particule pe baza curbei de calibrare.
Statistici și reproductibilitate
Pentru analiza cantitativă, au fost analizate cel puțin trei replici biologice, excluzând datele in vivo ale 68Ga-smSiP–PEG5k (n = 2). Datele au fost analizate prin analiza obișnuită a varianței (ANOVA) cu testul de comparații multiple al lui Dunnett și testul Student. t-Test. A P valoarea <0.05 a fost considerată semnificativă statistic.
- Distribuție de conținut bazat pe SEO și PR. Amplifică-te astăzi.
- PlatoData.Network Vertical Generative Ai. Împuterniciți-vă. Accesați Aici.
- PlatoAiStream. Web3 Intelligence. Cunoștințe amplificate. Accesați Aici.
- PlatoESG. carbon, CleanTech, Energie, Mediu inconjurator, Solar, Managementul deșeurilor. Accesați Aici.
- PlatoHealth. Biotehnologie și Inteligență pentru studii clinice. Accesați Aici.
- Sursa: https://www.nature.com/articles/s41565-023-01589-8
- :este
- :nu
- :Unde
- ][p
- 000
- 1
- 10
- 100
- 12
- 15%
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- Absolut
- conform
- Obține
- dobândite
- achiziție
- achiziții
- act
- activităţi de
- activitate
- adaptivă
- adăugat
- adăugare
- plus
- Ajustat
- administrată
- administrare
- avans
- După
- după aceea
- din nou
- AIR
- AL
- Algoritmul
- TOATE
- de asemenea
- Amoniac
- sumă
- an
- analiză
- analiză
- Ancoră
- și
- animal
- animale
- aplicat
- aproximativ
- SUNT
- apărea
- AS
- At
- b
- fundal
- Sold
- de bază
- bazat
- bază
- BD
- BE
- înainte
- Început
- de mai jos
- între
- Birmingham
- sânge
- corp
- scurt
- aduce
- tampon
- by
- calcula
- calculată
- calculează
- calcul
- CAN
- transportate
- Catalizator
- celulă
- chimicale
- alegere
- clic
- coincidență
- comparație
- comparații
- compuse
- Concentrat
- concentrare
- efectuat
- confuz
- consecutiv
- luate în considerare
- constant
- continuu
- Control
- controlată
- converti
- corectat
- A costat
- ar putea
- Contracara
- socoteală
- acoperit
- Cristal
- cs
- curba
- Tăiat
- tăiere
- de date
- livra
- livrate
- livrare
- În funcție
- descris
- proiectat
- detalii
- detectat
- determinat
- dezvoltat
- diferenţele
- diferit
- traseu
- dislocare
- distanţă
- face
- doză
- elaborate
- Picătură
- în timpul
- dinamic
- e
- E&T
- fiecare
- Devreme
- în mod eficient
- electrolit
- încorporat
- de emisie
- angajat
- capăt
- energie
- Inginerie
- asigura
- echipament
- Erori
- estima
- Eter (ETH)
- evalua
- evaluat
- evenimente
- exemplu
- Cu excepția
- F? r?
- experienţă
- experiment
- experimente
- și-a exprimat
- fals
- Smochin
- Film
- filtru
- final
- În cele din urmă
- First
- cinci
- debit
- a urmat
- următor
- Pentru
- format
- Înainte
- găsit
- patru
- Al patrulea
- congelare
- din
- congelate
- FSC
- mai mult
- porti
- ge
- generator
- de sticlă
- bine
- guvernare
- Gram
- Creștere
- sănătos
- aici
- Acasă
- home Office
- HTTPS
- if
- imagine
- imagini
- Imaging
- imediat
- important
- îmbunătăţi
- in
- include
- crescând
- incubate
- independent
- index
- Indici
- informat
- clipă
- instrucțiuni
- instrument
- instrumente
- integrate
- interfaţă
- intern
- în
- IT
- repetare
- iterații
- A pastra
- cunoscut
- Kx
- conduce
- Probabil
- LINK
- Plămânii
- mentine
- fabricat
- de fabricaţie
- material
- Mai..
- mijloace
- măsurat
- măsurare
- mediu
- metodă
- Metode
- soareci
- micron
- Microscop
- minute
- minimizând
- minim
- Baterie
- amestec
- ML
- Mobil
- mod
- monitorizate
- mai mult
- Morgan
- cele mai multe
- MS
- multiplu
- multiplicându-se
- nanotehnologie
- Natură
- următor
- Nu.
- normală.
- număr
- obține
- obținut
- of
- Birou
- on
- ONE
- afară
- opus
- optimă
- or
- obișnuit
- Altele
- in caz contrar
- afară
- peste
- peste noapte
- Oxigen
- Hârtie
- parametrii
- particulă
- Trecut
- PBS
- pentru
- procent
- efectuată
- animale de companie
- fantomă
- fază
- Fotonii
- imagine
- Pixel
- plasat
- Plato
- Informații despre date Platon
- PlatoData
- populații
- porţiune
- poziţie
- poziţionare
- pozitroni
- practică
- pregătit
- prezenţă
- precedent
- în prealabil
- Prim
- anterior
- sondă
- Proceduri
- proces
- produce
- Produs
- cum se cuvine
- protocol
- furniza
- furnizează
- furnizarea
- cumparate
- calitate
- cuantificare
- cantitativ
- cantitate
- R
- Radiaţie
- radio
- gamă
- rată
- reacţie
- Reacții
- în timp real
- primit
- recent
- inregistrata
- recuperare
- Redus
- reducere
- referință
- rafinat
- regiune
- regulament
- relatează
- rămâne
- rămas
- scoate
- îndepărtat
- replică
- Cerinţe
- Rezoluţie
- REST
- rezultând
- revizuiască
- revizuite
- Cameră
- Alerga
- s
- acelaşi
- scanare
- scanare
- scanări
- SCI
- ştiinţific
- Ecran
- Al doilea
- secunde
- secțiuni
- SEM
- Sensibilitate
- set
- instalare
- configurarea
- arătând
- Sigma
- Semnal
- semnificativ
- Siliciu
- singur
- Mărimea
- dimensiuni
- Felie
- Diapozitiv
- mic
- Fixaţi
- Software
- soluţie
- soluţii
- Sursă
- specific
- Loc
- pete
- Stadiile
- standard
- standarde
- Începe
- Pornire
- stabilit
- statistic
- Pas
- paşi
- depozitare
- Strategie
- curent
- studiat
- studiu
- Studiu
- suficient
- livra
- au realizat studii
- sinteză
- ia
- tehnică
- Tehnologii
- test
- decât
- acea
- apoi
- teoretic
- termic
- Acestea
- Al treilea
- acest
- trei
- prag
- Prin
- de-a lungul
- timp
- ori
- timestamp-ul
- sfat
- țesut
- la
- instrument
- Toolbox
- Total
- urmări
- Urmărire
- Transformare
- prins
- Două
- Uk
- Incertitudine
- în
- Neașteptat
- de unităţi
- până la
- utilizat
- folosind
- Vid
- valoare
- Valori
- Viteză
- versiune
- Impotriva
- in vivo
- Voltaj
- volum
- volume
- voxel
- W
- a fost
- spălat
- Apă
- au fost
- cand
- dacă
- care
- în timp ce
- întreg
- voi
- fereastră
- cu
- în
- Randament
- a cedat
- elastic
- zephyrnet
- Zip