Leczenie pacjentów z rakiem przestrzennie modulowanymi wiązkami promieniowania może zniszczyć guzy, jednocześnie minimalizując uszkodzenia pobliskich narządów i zdrowych tkanek. Taka jest idea radioterapii miniwiązkami protonów (pMBRT), nowej techniki leczenia, która wykorzystuje szereg submilimetrowych wiązek promieniowania do dostarczania dawki terapeutycznej.
Miniwiązki obejmują naprzemienne szczyty wysokich dawek i doliny niskich dawek, wzór, który jest mniej szkodliwy dla zdrowej tkanki na płytkich głębokościach. Na większych głębokościach wiązki te stopniowo rozszerzają się, tworząc jednorodny rozkład dawki w docelowej objętości. Badania na małych zwierzętach wykazały, że pMBRT może dramatycznie zmniejszyć normalną toksyczność tkanekZ równoważną lub lepszą kontrolę guzaw porównaniu z konwencjonalną terapią protonową.
„Radioterapia miniwiązkami protonów wykazała już znaczny wzrost indeksu terapeutycznego w badaniach przedklinicznych” – mówi Ramona Ortiza od Institut Curie. „Te obiecujące wyniki zachęcają do przełożenia tej techniki na dziedzinę kliniczną”. W tym celu Ortiz (obecnie w UC San Francisco) i współpracownicy z Institut Curie ocenili korzyści pMBRT w leczeniu przerzutów raka, opisali swoje odkrycia w Fizyka medyczna.
Symulacja scenariuszy pMBRT
Choroba z przerzutami odpowiada za do 90% zgonów związanych z rakiem. Przerzuty są zwykle leczone za pomocą technik radioterapii stereotaktycznej (SRT), ale dawka wymagana do miejscowej kontroli jest często ograniczona przez ryzyko toksyczności dla pobliskiej normalnej tkanki. Na przykład w przypadku przerzutów do mózgu martwicę mózgu wywołaną promieniowaniem zgłasza się u połowy pacjentów leczonych SRT.
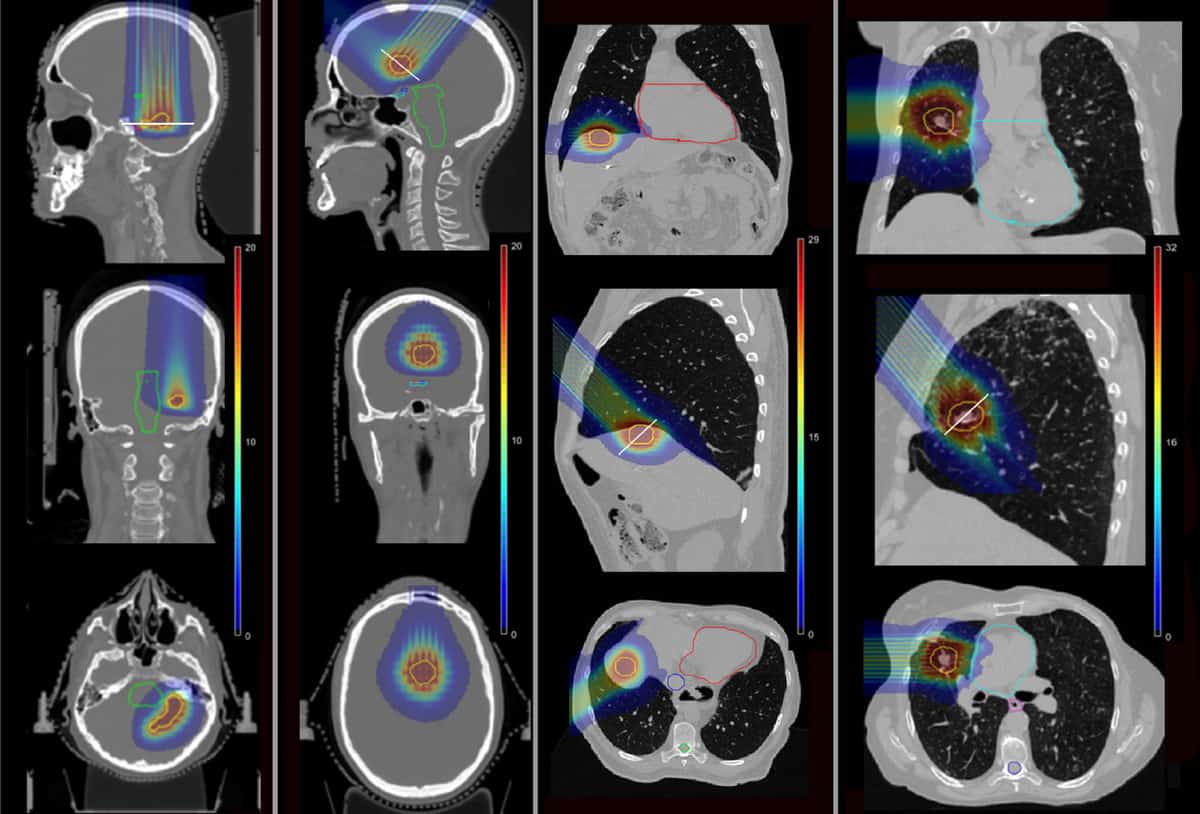
Aby ustalić, czy pMBRT może zmniejszyć takie powikłania, zespół wykorzystał symulacje Monte Carlo do obliczenia dystrybucji dawek dla czterech pacjentów, którzy wcześniej otrzymywali SRT w Institut Curie. Pacjenci byli leczeni z powodu zmian przerzutowych w płacie skroniowym, płacie czołowym, wątrobie i płucach.
Naukowcy przeprowadzili symulację jednofrakcyjnych planów pMBRT, wykorzystując jedno lub dwa pola zabiegowe, aby dostarczyć tę samą dawkę równoważną biologicznie (BED) do docelowego nowotworu, jak przepisano dla SRT. Modelowali mosiężny kolimator miniwiązek zawierający szczeliny o wymiarach 400 μm × 5.6 cm w różnych odległościach od środka do środka, aby stworzyć zarówno wąskie, jak i szersze miniwiązki. Następnie obliczyli rozkład dawek dla czterech przypadków pacjentów, dla pMBRT, SRT i konwencjonalnej terapii protonowej.
W planach pMBRT z wąskimi odstępami, które tworzą równomierny rozkład dawki w objętości docelowej, pokrycie guza było podobne lub nieco lepsze niż w planach SRT. Plany wykorzystujące szersze wiązki pMBRT, które zapewniają quasi-równomierną dystrybucję dawki do celu, miały mniejszy zasięg guza.
Co ważne, pMBRT znacznie zmniejszyło dawkę do struktur krytycznych w porównaniu z SRT. W pierwszym przypadku mózgu pMBRT zmniejszył średni BED do zagrożonych narządów (OAR) o od 44% (prawy nerw słuchowy) do 100% (lewy nerw słuchowy). W drugim leczeniu mózgu pMBRT całkowicie oszczędził OAR, w tym przewód wzrokowy, pień mózgu i skrzyżowanie.
W przypadku wątroby średnie BED wątroby i żeber zmniejszyło się odpowiednio o 25% i 75%, jednocześnie unikając napromieniania żyły głównej górnej. W przypadku płuc dawka dla OAR została zmniejszona o od 11% (żebra) do 100% (tętnica płucna i oskrzela). Średnia BED do OAR była w większości podobna między pMBRT a konwencjonalną terapią protonową.
Naukowcy zbadali również możliwe niekorzystne skutki pMBRT na normalne tkanki. Na przykład w przypadku dwóch przypadków przerzutów do mózgu obliczyli dawkę dostarczoną do zdrowej tkanki mózgowej. Rozważali dawki graniczne dla standardowego napromieniowania frakcjonowanego, w którym znormalizowana dawka całkowita przy 2 ułamkach Gy (NTD2.0) 72 Gy prowadzi do 5% prawdopodobieństwa wystąpienia martwicy popromiennej w ciągu pięciu lat.
Dla wszystkich planów pMBRT maksymalna dolina NTD2.0 dla zdrowego mózgu (61 Gy (RBE) dla przypadku płata skroniowego i 47 Gy (RBE) dla przypadku płata czołowego) pozostawała poniżej tego progu tolerancji dawki, w przeciwieństwie do konwencjonalnej terapii protonowej. W przypadku pacjentów z przerzutami do płuc i wątroby średnie dawki do tkanek płuc i wątroby w planach pMBRT były również znacznie poniżej maksymalnych tolerowanych średnich dawek.
Korzyści kliniczne
Leczenie pMBRT uwzględnione w tym badaniu zostało przeprowadzone przy użyciu tylko jednej lub dwóch macierzy miniwiązek. Zastosowanie mniejszej liczby pól niż w zabiegach SRT (trzy lub cztery łuki) wymaga mniejszej liczby repozycji pacjenta, skrócenia czasu leczenia frakcji, a także zmniejszenia objętości prawidłowej tkanki narażonej na działanie niskich dawek. Ponadto dostarczenie pMBRT w jednej frakcji leczenia znacznie skraca całkowity czas leczenia w porównaniu z planami SRT, które wykorzystywały od trzech do pięciu frakcji.

Radioterapia miniwiązkami: od fotonów do cząstek naładowanych
Naukowcy zwracają uwagę, że plany pMBRT oceniane w tej pracy mogą być realizowane klinicznie przy użyciu konfiguracji już wdrożonej w Centrum Terapii Protonowej Orsay do prób przedklinicznych, z kontrolą ruchu celu i narządów podczas leczenia, tak jak w przypadku SRT i terapii protonowej.
mówi Ortiz Świat Fizyki że Institut Curie omawia obecnie możliwość badań klinicznych fazy I/II. „Pozwoliłoby to ocenić neurotoksyczność i wskaźniki kontroli nowotworu w leczeniu nawracającego glejaka wielopostaciowego za pomocą miniwiązek protonów” – wyjaśnia. „To badanie ma na celu przyczynienie się do przygotowania tych badań klinicznych”.
- Dystrybucja treści i PR oparta na SEO. Uzyskaj wzmocnienie już dziś.
- Platoblockchain. Web3 Inteligencja Metaverse. Wzmocniona wiedza. Dostęp tutaj.
- Źródło: https://physicsworld.com/a/proton-minibeams-could-improve-treatment-of-cancer-metastases/
- 10
- a
- Konta
- dodatek
- niekorzystny
- Cele
- Wszystkie kategorie
- już
- i
- zwierzęta
- Szyk
- unikając
- za
- poniżej
- Korzyści
- Ulepsz Swój
- pomiędzy
- Mózg
- mosiądz
- Rak
- walizka
- Etui
- Centrum
- naładowany
- Kliniczne
- Badania kliniczne
- koledzy
- kolumny
- powszechnie
- w porównaniu
- całkowicie
- obliczać
- za
- kontrast
- przyczynić się
- kontrola
- kontrolowanych
- Konwencjonalny
- mógłby
- pokrycie
- Stwórz
- krytyczny
- zgonów
- dostarczyć
- dostarczona
- dostarczanie
- Głębokości
- zniszczyć
- Ustalać
- Omawiając
- choroba
- 分配
- Dystrybucje
- domena
- dramatycznie
- podczas
- ruchomości
- wschodzących
- zachęcać
- Równoważny
- oceniać
- oceniane
- przykład
- Objaśnia
- narażony
- Łąka
- i terminów, a
- frakcja
- Francisco
- od
- Wzrost
- stopniowo
- większy
- Pół
- szkodliwy
- zdrowy
- HTTPS
- pomysł
- obraz
- realizowane
- podnieść
- in
- W innych
- Włącznie z
- wskaźnik
- Informacja
- Dochodzenia
- problem
- tylko jeden
- Wyprowadzenia
- Ograniczony
- Limity
- Wątroba
- miejscowy
- niski
- Maksymalna szerokość
- maksymalny
- minimalizowanie
- ruch
- Natura
- normalna
- ONE
- koncepcja
- Inne
- opisane
- pacjent
- pacjenci
- Wzór
- faza
- Fotony
- planowanie
- plany
- plato
- Analiza danych Platona
- PlatoDane
- punkt
- możliwość
- możliwy
- poprzednio
- prawdopodobieństwo
- obiecujący
- Promieniowanie
- Radioterapia
- ceny
- Odebrane
- zmniejszyć
- Zredukowany
- zmniejsza
- redukcja
- pozostał
- znakomity
- Zgłoszone
- wymagany
- Wymaga
- Badacze
- odpowiednio
- Efekt
- Ryzyko
- taki sam
- San
- San Francisco
- mówią
- druga
- płytki
- pokazane
- znacznie
- podobny
- mały
- standard
- badania naukowe
- Badanie
- taki
- przełożony
- cel
- zespół
- Techniki
- mówi
- Połączenia
- ich
- Terapeutyczny
- terapia
- trzy
- próg
- miniatur
- czas
- Tkanki
- do
- tolerancja
- Kwota produktów:
- Tłumaczenie
- leczenia
- leczenie
- Próby
- prawdziwy
- posługiwać się
- Dolina
- różnorodny
- Tom
- kłęby
- czy
- który
- Podczas
- KIM
- w ciągu
- Praca
- by
- lat
- zefirnet