Przygotowanie i charakterystyka materiału
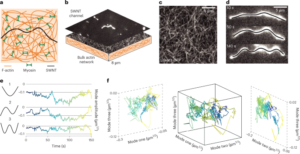
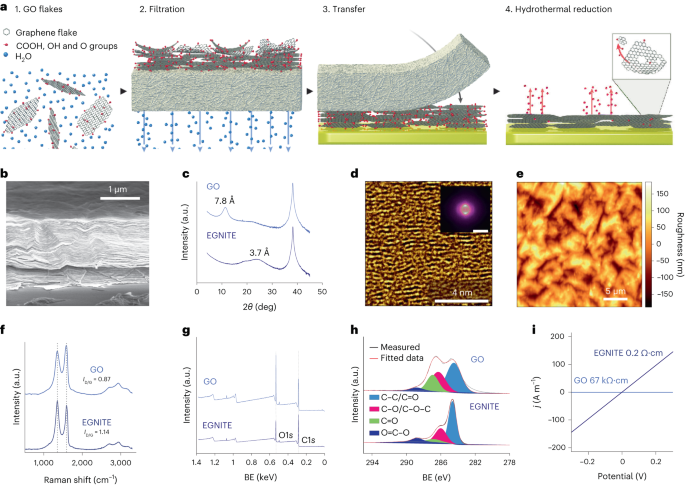
Wodny roztwór GO rozcieńczono w wodzie dejonizowanej, aby uzyskać 0.15 mg ml-1 roztworu i przesączono pod próżnią przez membranę nitrocelulozową o porach 0.025 µm, tworząc cienką warstwę GO. Następnie cienką warstwę przeniesiono na docelowe podłoże metodą transferu na mokro w wodzie dejonizowanej i dalszego wyżarzania termicznego w temperaturze 100 °C przez 2 min. Stos folia GO – podłoże zredukowano hydrotermicznie w temperaturze 134 °C w standardowym autoklawie przez 3 h, uzyskując EGNITE. Podstawowym podłożem do wszystkich badań charakterystyki EGNITE był kwadrat (1 × 1 cm2) Si/SiO2 (400 μm/1 μm).
XPS
Pomiary XPS przeprowadzono za pomocą analizatora Phoibos 150 (SPECS) w warunkach ultrawysokiej próżni (ciśnienie podstawowe, 5 × 10-10 mbar) z monochromatycznym źródłem promieniowania rentgenowskiego Al Kα (1,486.74 eV). Widma przeglądowe uzyskano przy energii przejścia 50 eV i rozmiarze kroku 1 eV, a widma o wysokiej rozdzielczości uzyskano przy energii przejścia 20 eV i rozmiarze kroku 0.05 eV. Ogólna rozdzielczość w tych ostatnich warunkach wynosi 0.58 eV, jak określono poprzez pomiar pełnej szerokości w połowie maksimum Ag 3dDaszek 5/2 z napylonego srebra. Analiza XPS wykazuje silny spadek po obróbce hydrotermicznej piku C–O (związanego z grupami epoksydowymi), ale niewielki udział C–OH, C=O i C(O)OH ze względu na grupy hydroksylowe, karbonylowe i karboksylowe, które pozostać po redukcji. Dekonwolucja O1s szczyt potwierdza takie zachowanie. Główny wkład w C1s pochodzi jednak sygnał po redukcji hydrotermalnej sp2 zhybrydyzowane orbitale C – C34,57.
Dyfrakcja rentgenowska
Pomiary dyfrakcji promieni rentgenowskich (θ-2θ skan) przeprowadzono w dyfraktometrze Materials Research (Malvern PANalytical). Ten dyfraktometr ma poziomą ω-2θ goniometr (promień 320 mm) w geometrii czterokołowej i współpracował z ceramiczną lampą rentgenowską z anodą Cu Kα (λ = 1.540598 Å). Zastosowanym detektorem jest Pixcel, czyli szybki detektor promieni rentgenowskich oparty na technologii Medipix2.
Spektroskopia ramanowska
Pomiary metodą spektroskopii Ramana wykonano przy użyciu spektrografu Witec wyposażonego w laserową linię wzbudzenia o długości fali 488 nm. Do pomiarów uzyskano widma Ramana przy użyciu obiektywu 50× i siatki 600 rowków na nm; moc lasera utrzymywano poniżej 1.5 mW, aby uniknąć nagrzewania próbki.
TEM
Do badania przekroju poprzecznego próbki EGNITE przygotowano blaszkę skupionej wiązki jonów za pomocą Helios NanoLab DualBeam (LMA-INA). Analizy strukturalne przeprowadzono za pomocą TEM przy użyciu mikroskopu Tecnai F20 pracującego przy 200 kV, w tym HRTEM i technik pierścieniowego ciemnego pola pod wysokim kątem. Eksperyment STEM-EELS przeprowadzono w mikroskopie Tecnai F20 pracującym przy 200 KeV, z aperturą 5 mm, długością kamery 30 mm, kątem zbieżności 12.7 mrad i kątem zbierania 87.6 mrad. Ponieważ do pomiaru strat w rdzeniu użyliśmy 0.5 eV na piksel i 250 eV jako energii początkowej, nie uzyskaliśmy krawędzi Si K oczekiwanej przy 1,839 eV, krawędzi Pt M przy 2,122 eV i krawędzi Au M przy 2,206 eV. Względny skład atomowy C–O uzyskano skupiając naszą uwagę na zredukowanej warstwie GO i zakładając, że analizowane krawędzie (w naszym przypadku C i O) sumują się do 100%. Założenie to sprawdza się w naszym przypadku, co widać w artykule Dodatkowa informacja mapy. Przekrój różnicowy energii obliczono za pomocą modelu Hartree-Slatera, a tło za pomocą modelu o małej mocy.
Przewodnictwo elektryczne
Pomiary przewodności elektrycznej wykonano przy użyciu źródłometru Keithley 2400 w konfiguracji dwupunktowej. Zmierzone próbki składały się z folii EGNITE o wymiarach 1 × 1 cm2 na górze SiO2 substrat.
Analiza danych
Dane dyfrakcji rentgenowskiej, Ramana i XPS analizowano przy użyciu pakietów Pythona 3.7 (Numpy, Pandas, Scipy, Xrdtools, Lmfit, Rampy, Peakutils, Matplotlib). Odległość między płaszczyznami obliczono na podstawie pomiarów dyfrakcji promieni rentgenowskich zgodnie z prawem Snella. Po przeniesieniu danych do domeny przestrzennej dopasowano maksimum pików. Odpowiednia odległość dała średnią wartość odległości pomiędzy płaszczyznami. Odchylenia od tych średnich wartości obliczono na podstawie pełnej szerokości i połowy maksimum dopasowań lorentzowskich pików w dziedzinie przestrzennej. Pomiary XPS i spektroskopii Ramana analizowano poprzez dopasowanie splotu pików w oczekiwanych lokalizacjach dla odpowiednich cech. Wartości przewodności GO i EGNITE uzyskano poprzez dopasowanie I-V krzywe zmierzone w pomiarach przewodności elektrycznej zgodnie z prawem Ohma. Dane są n = 1 dla każdego pomiaru.
Elastyczne wytwarzanie tablic
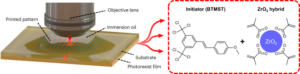
Wykonanie urządzeń pokazano na rysunku uzupełniającym. 4. Urządzenia zostały wykonane na 4-calowym Si/SiO2 (400 μm/1 μm) płytki. Najpierw na wafel naniesiono warstwę PI (PI-10, HD MicroSystems) o grubości 2611 µm i wypiekano w atmosferze bogatej w azot w temperaturze 350 °C przez 30 min. Ślady metaliczne uformowano przy użyciu litografii optycznej fotomaski odwracającej obraz (AZ5214, Microchemicals). Zastosowano odparowanie wiązką elektronów, aby osadzić 20 nm tytanu i 200 nm złota, a następnie przeprowadzono odrywanie. Zastosowaliśmy folię EGNITE o grubości około 1 μm jako kompromis między wydajnością elektrochemiczną a elastycznością układu. Po przeniesieniu folii GO aluminium odparowano wiązką elektronów i zdefiniowano obszary na wierzchu przyszłych mikroelektrod za pomocą fotorezystu negatywowego (nLOF 2070, Microchemicals) i oderwano. Następnie folię GO wytrawiono wszędzie poza przyszłymi mikroelektrodami, stosując trawienie jonami reaktywnymi z tlenem (RIE) przez 5 minut przy 500 W, a zabezpieczające kolumny aluminiowe wytrawiono rozcieńczonym roztworem kwasów fosforowego i azotowego. Następnie na płytkę nałożono warstwę PI-3 o grubości 2611 µm i wypiekano jak opisano wcześniej. Następnie zdefiniowano otwory PI-2611 na mikroelektodzie przy użyciu grubej fotomaski dodatniej (AZ9260, Microchemicals), która działała jak maska dla późniejszego tlenowego RIE. Później urządzenia wzorowano na warstwie PI, ponownie wykorzystując fotorezyst AZ9260 i RIE. Następnie warstwę fotorezystu usunięto w acetonie, a płytkę oczyszczono w alkoholu izopropylowym i wysuszono. Na koniec urządzenia oddzielono od płytki i były gotowe do umieszczenia w woreczkach do sterylizacji w celu poddania ich obróbce hydrotermicznej w temperaturze 134 °C w standardowym autoklawie przez 3 h.
Charakterystyka elektrochemiczna mikroelektrod
Charakterystykę elektrochemiczną mikroelektrod przeprowadzono za pomocą potencjostatu Metrohm Autolab PGSTAT128N w 1 x PBS (Sigma-Aldrich, P4417) zawierającym 10 mM bufor fosforanowy, 137 mM NaCl i 2.7 mM KCl przy pH 7.4 i przy użyciu konfiguracji trzech elektrod. Jako odniesienie zastosowano elektrodę Ag/AgCl (FlexRef, WPI), a jako przeciwelektrodę zastosowano drut platynowy (Alfa Aesar, 45093).
Przed oceną działania elektrody poddano impulsowi 10,000 1 impulsów ze zrównoważonym ładunkiem (15 ms, 100 µA). Poddawanie elektrod działaniu protokołów ciągłego pulsowania, poprzedzonych 0.9 cyklicznymi cyklami woltamperometrii (od -0.8 do +50 V) przy XNUMX mV s-1, 20 powtórzeń po 5,000 impulsów (1 ms) i ponowne określenie potencjału obwodu otwartego.
Analiza danych
Dane charakterystyki elektrochemicznej analizowano przy użyciu pakietów Python 3.7 (Numpy, Pandas, Scipy, Pyeis, Lmfit, Matplotlib). Dane ze spektroskopii impedancyjnej dopasowano do równoważnego modelu elektrycznego składającego się z rezystancji (R) szeregowo z elementem stałofazowym (CPE). Stamtąd wartość CPE przybliżono do pojemności i podzielono przez obszar geometryczny mikroelektrody, aby uzyskać równoważną wartość pojemności międzyfazowej EGNITE. Pojemność magazynowania ładunku mikroelektrody (CSC) obliczono na podstawie pomiarów woltamperometrii cyklicznej poprzez całkowanie reżimów katodowego i anodowego mierzonego prądu i normalizację poprzez szybkość skanowania. Katodowa i anodowa pojemność przechowywania ładunku (cCSC i aCSC) przy szybkości skanowania 100 mV EGNITE wynosi 45.9 ± 2.4 i 34.6 ± 2.8 mC cm-2, odpowiednio (n = 3). Jak podano w przypadku innych materiałów58, uzyskane CSC zależą od szybkości skanowania (rysunek uzupełniający). 5). Aby ocenić obecność reakcji redukcji tlenu, zmierzyliśmy kształt fali CV w elektrolicie przedmuchanym azotem59 i nie zaobserwował znacznych różnic w kształcie fali (rysunek uzupełniający). 6). Jednak nasze wyniki nie uwzględniają w pełni wpływu reakcji redukcji tlenu na zdolność wtryskiwania ładunku EGNITE i należy wykonać dodatkową pracę, aby właściwie to zbadać. Zdolność wstrzykiwania ładunku mikroelektrody (CIC) ustalono poprzez określenie amplitudy impulsu prądu, która wywołała różnicę napięcia (po usunięciu spadku omowego), która odpowiadała elektrochemicznemu okienku wodnemu elektrody (-0.9 V dla katodowego i +0.8 V dla anodowego w porównaniu do Ag/AgCl ) (rysunek uzupełniający. 17)60.
Analiza statystyczna
Dane są średnie ± sd, n = 18 dla EIS i n = 3 dla chronopotencjometrii. Dane mapy skoków napięcia pojemnościowego katodowego są średnią skoków napięcia pojemnościowego katodowego dla jednego zdarzenia dla każdego kształtu impulsu n = 3 elektrody.
Ocena stabilności mechanicznej
Sonikacja ultradźwiękowa
Układy elektrod EGNITE umieszczono w zlewce wypełnionej wodą w ultradźwiękowej łaźni wodnej (Elmasonic P 180H). Zastosowano sonikację przy 37 kHz przez 15 min przy 200 W, a następnie przez dodatkowe 15 min sonikację przy 37 kHz z mocą podwyższoną do 300 W. Obrazy elektrod uzyskano przed i po etapach sonikacji.
Test zginania
Układ gięcia (ryc. 2k) składał się z trzech cylindrycznych prętów; środkowy (średnica 700 µm) został obniżony w dół, tworząc kąt zgięcia wynoszący 131°. Do testu zginania wykorzystano trzy elastyczne układy mikroelektrod. Każdy układ zawierał 18 mikroelektrod o średnicy 50 µm. Dwie macierze mierzono po 10 i 20 cyklach, natomiast jedno urządzenie mierzono tylko przez 10 cykli, ponieważ uległo uszkodzeniu podczas przenoszenia po pomiarze. Cykl próby zginania składał się z obciążenia trwającego 10 sekund plus 10 sekund bez obciążenia. Urządzenia scharakteryzowano elektrochemicznie (EIS i CV) przed i po 10 i 20 cyklach zginania.
Epikortykalny zapis neuronowy
Implantacja epikortykalna
Wszystkie procedury doświadczalne przeprowadzono zgodnie z zaleceniami Rady Wspólnoty Europejskiej oraz francuskim ustawodawstwem dotyczącym opieki i wykorzystania zwierząt laboratoryjnych. Protokoły zostały zatwierdzone przez komisję etyczną Grenoble (ComEth) i zatwierdzone przez francuskie ministerstwo (numer 04815.02). Szczury Sprague-Dawley (samice, 4 miesiące, waga ~600 g) znieczulono domięśniowo ketaminą (50 mg na kg (masy ciała)) i ksylazyną (10 mg na kg (masy ciała)), a następnie przymocowano do uchwytu stereotaktycznego. Usunięcie czaszki skroniowej odsłoniło korę słuchową. Dura mater została zakonserwowana, aby uniknąć uszkodzenia tkanki korowej. W wierzchołku wywiercono otwór w celu wprowadzenia elektrody odniesienia, a następnie wywiercono drugi otwór, 7 mm w kierunku przodu od pierwszego, w celu wprowadzenia elektrody uziemiającej. Elektrodami były kołki o grubości 0.5 mm stosowane w gniazdach układów scalonych. Umieszczono je tak, aby zapewnić kontakt elektryczny z oponą twardą i przymocowano do czaszki cementem dentystycznym. Następnie zamontowaliśmy powierzchniową wstęgę mikroelektrody na korze słuchowej, jak pokazano na ryc. 3b. Wzory żył identyfikują korę słuchową w obszarze 41 mapy mózgu szczura Kriega. Sygnały korowe jednocześnie wzmacniano ze wzmocnieniem 1,000 i przetwarzano na postać cyfrową przy częstotliwości próbkowania 33 kHz. Głośnik znajdujący się 20 cm przed uchem szczura, po stronie przeciwnej do odsłoniętej kory mózgowej, dostarczał bodźce akustyczne. Dostarczone bodźce monitorowano za pomocą mikrofonu o średnicy 0.25 cala (Brüel i Kjaer, 4939) umieszczonego w pobliżu ucha i prezentowano je na poziomie ciśnienia akustycznego (dB SPL re 20 μPa). Badamy dodatnie wierzchołki (ujemne w górę) odpowiedzi o średnim opóźnieniu wywołane naprzemiennymi kliknięciami przy 80 dB SPL i impulsami tonowymi przy 70 dB SPL o częstotliwościach w zakresie od 5 do 40 kHz, czasie narastania i opadania 5 ms oraz czas trwania 200 ms.
Analiza danych
Dane elektrofizjologiczne analizowano przy użyciu pakietów Pythona 3.7 (Numpy, Pandas, Scipy, Neo, Elephant, Sklearn Matplotlib) i niestandardowej biblioteki PhyREC (https://github.com/aguimera/PhyREC). r.m.s. wartości obliczono przy przesuwającym się oknie wynoszącym 20 ms przy częstotliwościach powyżej 200 Hz. Spektrogramy obliczono dla zakresu od 70 Hz do 1.1 kHz. PSD obliczono na podstawie 60 sekund ciągłych nagrań. Dla danego układu elektrod obliczono dwa PSD: in vivo (IV) i post mortem (PM). SNR wyraża się w dB (20 × ln(r.m.s.(IV)/r.m.s.(PM))) i interpoluje dla 20 punktów logarytmicznie rozmieszczonych w zakresie od 10 Hz do 1 kHz.
Analiza statystyczna
Dane neuronowe epikorowe przedstawione na ryc. 3 pochodzą z indywidualnych pomiarów pojedynczego zwierzęcia. Na ryc. 3cprzedstawiono dane z 64 elektrod. Na ryc. 3dprzedstawiono dane z dwóch wybranych elektrod. Na ryc. 3f, PSD i SNR są obliczane na podstawie 64 elektrod EGNITE i pokazane jako średnia ± s.d. Na dodatkowym ryc. 12c, zm Medianę danych przedstawiono dla 192 elektrod EGNITE z firmy n = 3 eksperymenty i 60 elektrod platynowych z n = 1 eksperyment.
Wewnątrzkorowy zapis neuronowy
Implantacja wewnątrzkorowa
Zwierzęta znieczulono mieszaniną ketaminy/ksylazyny (75:1, 0.35 ml/28 g i.p.) i stan ten utrzymywano za pomocą maski inhalacyjnej zawierającej 1.5% izofluranu. W czaszce umieszczono kilka mikrośrub w celu ustabilizowania implantu, a tę na szczycie móżdżku wykorzystano jako ogólne podłoże. Sonda została wszczepiona do kory przedczołowej (współrzędne: AP, 1.5 mm; ML, ±0.5 mm; DV, -1.7 mm od bregmy). Implantację przeprowadzono poprzez pokrycie sondy maltozą (patrz protokół poniżej), aby zapewnić tymczasową sztywność sondy i ułatwić wprowadzenie sondy. Sonda została uszczelniona cementem dentystycznym. Do podłączenia sondy do układu elektrofizjologicznego za pomocą zminiaturyzowanego przewodu wykorzystano złącza TDT-ZifClip. Po operacji mysz przeszła okres rekonwalescencji trwający 1 tydzień, otrzymując leki przeciwbólowe (buprenorfina) i przeciwzapalne (meloksykam). Aktywność neuronową rejestrowano za pomocą wielokanałowego systemu Open Ephys przy częstotliwości próbkowania 30 kHz ze wzmacniaczem Intan RHD2132. Eksperymenty z zadaniami słuchowymi przeprowadzono w dźwiękoszczelnym pudełku, w którym znajdowały się dwa głośniki, przy użyciu protokołów opartych na wcześniej opisanych pracach61. Bodziec dźwiękowy składał się z kliknięcia białego szumu o długości 15 ms, powtarzanego 100 razy (cykle), każdy oddzielony 5 sekundami (interwał między bodźcami). Podczas wykonywania zadania zwierzę mogło swobodnie się poruszać.
Protokół usztywniacza maltozowego
Wodny roztwór maltozy podgrzewa się do temperatury zeszklenia (Tg), w temperaturze od 130 do 160 °C, używając płyty grzejnej lub kuchenki mikrofalowej. Gdy maltoza stanie się lepka, tylna strona sondy styka się tylko z maltozą. Gdy maltoza ochładza się, sztywnieje i usztywnia sondę.
Analiza danych
Sygnały neuronowe z każdej elektrody filtrowano w trybie offline w celu wyodrębnienia SUA i LFP. SUA oszacowano poprzez filtrowanie sygnału pomiędzy 450 a 6,000 Hz, a impulsy z poszczególnych neuronów posortowano za pomocą analizy głównych składowych za pomocą Offline Sorter v.4 (Plexon). Aby uzyskać LFP, sygnały zostały obniżone do 1 kHz, poddane detrendacji i poddane filtracji wycinającej w celu usunięcia artefaktów linii szumu (50 Hz i jego harmonicznych) za pomocą niestandardowych skryptów napisanych w języku Python. AEP SNR obliczono jako stosunek szczytowej amplitudy N1 i s.d. okresu 20 ms przed bodźcem.
Analiza statystyczna
Dane pokazane na ryc. 3h, tj są średnie ± sd, n = 30 jako liczba uśrednionych prób. Dane zarejestrowane z tej samej elektrody pokazano w dniach 30, 60 i 90. Przedstawiono dane od pojedynczego zwierzęcia.
Przewlekła biokompatybilność epikortykalna
Chirurgiczna implantacja urządzeń
Do badania wykorzystano ogółem 27 dorosłych samców szczurów Sprague-Dawley (Charles River). Zwierzęta trzymano w temperaturze otoczenia 21 ± 2 °C i wilgotności 40–50%, w cyklu 12 h światła/12 h ciemności. Szczury trzymano w grupach i przez cały okres doświadczenia zapewniano im swobodny dostęp do diety i wody. Procedury eksperymentalne przeprowadzono zgodnie z ustawą o dobrostanie zwierząt (1998), za zgodą brytyjskiego Ministerstwa Spraw Wewnętrznych i lokalnego organu ds. oceny etycznej dobrostanu zwierząt (AWERB). Na czas zabiegu zwierzęta znieczulano izofluranem (2–3%), a głębokość znieczulenia monitorowano za pomocą testu odruchu uszczypnięcia palca. Zwierzęta umieszczono w ramie stereotaktycznej (Kopf, 900LS), umieszczonej nad kocem termicznym w celu utrzymania temperatury ciała. Otwór po kraniotomii (~5 mm ×4 mm) wykonano w odległości 1 mm od linii środkowej za pomocą wiertła dentystycznego z wiertłem o średnicy 0.9 mm, usunięto oponę twardą i urządzenie nadkorowe umieszczono na korowej powierzchni mózgu. Otwór po kraniotomii zamknięto Kwik-silem, następnie cementem dentystycznym w celu zabezpieczenia i zszyto skórę. W celu uzupełnienia utraconych płynów i zmniejszenia bólu pooperacyjnego podano podskórne wstrzyknięcia soli fizjologicznej (1 ml na kg (masy ciała)) i buprenorfiny (0.03 mg na kg (masy ciała)), po czym wycofano znieczulenie.
Zbieranie i przetwarzanie tkanek
Zwierzęta kończono w 2, 6 lub 12 tygodniu po implantacji, stosując metodę odpowiednią do rodzaju analizy, która miała zostać przeprowadzona.
Histologia i immunohistochemia
Po 2, 6 lub 12 tygodniach od implantacji szczury kończono metodą perfuzji serca za pomocą heparynizowanego (10 U ml-1, Sigma-Aldrich) PBS, a następnie 4% paraformaldehyd (PFA, Sigma-Aldrich) w PBS. Mózgi utrwalono w 4% PFA na 24 godziny, następnie przeniesiono do 30% sacharozy w PBS na co najmniej 48 godzin przed zamrożeniem w izopentanie. Mózgi następnie przechowywano w temperaturze -80 °C do czasu kriosekcji przy 25 µm. Następnie tkankę barwiono pod kątem cząsteczki adaptera 1 wiążącej zjonizowany wapń (Iba-1) w celu określenia poziomu aktywacji mikrogleju. W skrócie, skrawki tkanek blokowano 5% surowicą kozią w PBS z 0.1% Triton-X przez 1 godzinę, po czym inkubowano przez noc w temperaturze 4°C z pierwotnym przeciwciałem anty-Iba-1 (1:1,000, 019-19741; Wako). Skrawki następnie barwiono przeciwciałem wtórnym, przeciwkróliczym Alexa Fluor 594 (1:400, A-11012; Thermo Fisher) przez 1 godzinę w temperaturze pokojowej. Szkiełka mocowano za pomocą szkiełek nakrywkowych, stosując środek do mocowania zapobiegający blaknięciu Prolong Gold z 4,6-diamidyno-2-fenyloindolem (Thermo Fisher). Sonda obejmowała obszar 3 × 3.7 mm2 na korowej powierzchni mózgu; skrawki tkanek wybrane do barwienia pokrywały w tym obszarze długość 3.2 mm. Slajdy obrazowano przy użyciu skanera szkiełek mikroskopowych 3DHistech Pannoramic-250 przy 20×, a obrazy analizowano przy użyciu CaseViewer v.2.4 (3DHistech). Aby ocenić aktywację mikrogleju, pokryto obszar o wielkości 3.2 mm i analizowano jeden obraz co 100 µm. Zdjęcia wykonano przy powiększeniu 8.5×, które szczegółowo przedstawiały przekrój miejsca wprowadzenia sondy nadkorowej, 3 mm od linii środkowej mózgu, obejmujący obszar bezpośrednio pod miejscem sondy.
Przetwarzanie obrazu
Dane mikroskopowe przetworzono obrazowo przy użyciu algorytmu charakteryzacji fenotypu mikrogleju (rysunek uzupełniający). 13). Aktywację mikrogleju analizowano przy użyciu niestandardowego narzędzia CellProfiler* (Broad Institute, wersja 3.1.9 z https://cellprofiler.org/) rurociąg. Najpierw wykorzystano moduł EnhanceOrSuppressFeatures do uwydatnienia struktur nitkowatych, takich jak neuryty, poprzez zastosowanie metody wzmacniania rurek. Na podstawie ulepszonych obrazów komórki podzielono na segmenty przy użyciu modułu IdentyfikujPrimaryObjects. Wstępne pomiary komórek sugerują, że odpowiedni zakres średnic obiektu wynosił 3–40 pikseli. Obiekty wykraczające poza ten zakres średnic lub dotykające krawędzi obrazu zostały odrzucone. Komórki segmentowano przy użyciu dwuklasowej strategii adaptacyjnego progowania Otsu z adaptacyjnym rozmiarem okna wynoszącym 50 pikseli. Obiekty zidentyfikowane przez modułidentPrimaryObjects zostały wprowadzone do modułu MeasureObjectSizeShape w celu obliczenia właściwości niezbędnych do klasyfikacji komórek. W module ClassifyObjects jako kategorię, na której opierają się klasyfikacje, wybrano AreaShape, a jako odpowiednią miarę wybrano Extent. Komórki sklasyfikowano jako "aktywowane” lub „nieaktywowane” w oparciu o ich właściwość Zasięg, która jest stosunkiem obszaru zajmowanego przez komórkę do obszaru zajmowanego przez jej obwiednię. To podejście do klasyfikacji zostało zracjonalizowane faktem, że aktywowany mikroglej ma duże ciała komórkowe i nie ma żadnych procesów, w związku z czym zajmuje znacznie większą część swoich ramek ograniczających niż ich nieaktywowane odpowiedniki. Na koniec do obliczenia i wygenerowania pożądanych statystyk wykorzystano moduły CalculateMath i ExportToSpreadsheet.
Analiza statystyczna
Zestawy danych są n = 3 dla każdego typu urządzenia (implant zawierający wyłącznie PI (PI); PI z odsłoniętym złotem mikrofabrykowanym (złoto); oraz PI ze złotem mikrofabrykowanym i EGNITE (EGNITE) we wszystkich punktach czasowych) z wyjątkiem 6-tygodniowego złota, które jest n = 2 dla danych ELISA. W każdym punkcie czasowym połączono przeciwległe półkule, aby uzyskać wynik n = 9 w 2 i 12 tygodniu po implantacji oraz n = 8 w 6 tygodniu po implantacji. Analizę danych przeprowadzono przy użyciu oprogramowania GraphPad Prism v.8. Analizę statystyczną zakończono przy użyciu dwukierunkowej analizy wariancji (ANOVA) z testem wielokrotnych porównań Tukeya, tam gdzie było to konieczne; P Za istotne uznano < 0.05.
ELISA
Po okresie implantacji zwierzęta uśmiercano przez zwichnięcie odcinka szyjnego. Tkankę mózgową pobrano zarówno z prawej, jak i lewej półkuli mózgu, szybko zamrożono w ciekłym azocie i przechowywano w temperaturze -80 °C do dalszego użycia. Tkankę poddano lizie przy użyciu buforu do lizy NP-40 (150 mM NaCl, 50 mM Tris-Cl, 1% substytutu Nonidet P40, Fluka, pH doprowadzone do 7.4) zawierającego inhibitor proteazy i fosfatazy (Halt Protease and Phosphatase Inhibitor Cocktail, Thermo Fisher), a następnie mechaniczne rozbicie tkanki (TissueLyser LT, Qiagen). Próbki następnie wirowano przez 10 minut przy 5,000 obr./min, a supernatant przechowywano w temperaturze 4°C do dalszego użycia. Panel zapalenia szczurów LEGENDplex (numer katalogowy 740401, BioLegend), zestaw multipleksowego testu ELISA na bazie kulek, przeprowadzono w celu ilościowego określenia następujących cytokin; IL-1α, IL-1β, IL-6, IL-10, IL-12p70, IL-17A, IL-18, IL-33, CXCL1 (KC), CCL2 (MCP-1), stymulujące kolonie granulocytów i makrofagów czynnik, interferon-γ i czynnik martwicy nowotworu. Zestaw uruchomiono zgodnie z instrukcjami producenta, z białkiem załadowanym w stałej objętości 15 µl. Po inkubacji z supernatantem kulki przepuszczano w cytometrze przepływowym BD FACSVerse i dane analizowano przy użyciu oprogramowania do analizy danych LEGENDplex.
Stymulacja nerwowa
Implantacja wewnątrzwiązkowa
Wszystkie eksperymenty na zwierzętach zostały zatwierdzone przez Komisję Etyczną Universitat Autònoma de Barcelona zgodnie z Dyrektywą Rady Wspólnot Europejskich 2010/63/UE. Zwierzęta trzymano w temperaturze 22 ± 2 °C w cyklu 12 h światła/12 h ciemności, przy swobodnym dostępie do pożywienia i wody. Nerw kulszowy znieczulonych samic szczurów Sprague-Dawley (250–300 g, ~18-tygodniowego życia) odsłonięto chirurgicznie i elektrody TIME wszczepiono poprzecznie w poprzek nerwu kulszowego za pomocą prostej igły przymocowanej do nici pętelkowej 10-046. Proces ten monitorowano pod mikroskopem preparacyjnym, aby zapewnić prawidłowe położenie miejsc aktywnych wewnątrz pęczków nerwowych (ryc. 4b). Podczas doświadczeń temperaturę ciała zwierząt utrzymywano za pomocą poduszki grzewczej.
Stymulację nerwów przeprowadzono poprzez zastosowanie ciągów dwufazowych impulsów prądu o stałym czasie trwania 100 µs na fazę i rosnącej amplitudzie od 0 do 150 µA w krokach co 1 lub 3 µA przy 3 Hz przez 33 s (stymulator DS4, Digitimer) za pośrednictwem różnych urządzeń EGNITE mikroelektrody. Jednocześnie rejestrowano CMAP z mięśni GM, TA i PL przy użyciu małych elektrod igłowych (elektrody igłowe ze stali nierdzewnej o długości 13 mm i średnicy 0.4 mm A-03-14BEP, Bionic) umieszczonych w każdym mięśniu62. Elektrodę aktywną umieszczono na brzuszku mięśnia, a elektrodę odniesienia na poziomie ścięgna. Zapisy elektromiograficzne amplifikowano (×100 dla GM i TA, ×1,000 dla PL; wzmacniacze P511AC, Grass), filtrowano pasmowo (3 Hz do 3 kHz) i digitalizowano za pomocą systemu rejestracji PowerLab (PowerLab16SP, ADInstruments) przy 20 kHz.
Analiza danych
Amplituda każdego CMAP mierzono od linii podstawowej do maksymalnego ujemnego piku. Pomiary szczytowego napięcia znormalizowano do maksymalnej amplitudy CMAP uzyskanej dla każdego mięśnia w eksperymencie. Dla każdego miejsca aktywnego obliczono wskaźnik selektywności (SI) jako stosunek znormalizowanej amplitudy CMAP dla jednego mięśnia, CMAPioraz suma znormalizowanych amplitud CMAP w trzech mięśniach, zgodnie ze wzorem SIi = nWCPAi/∑nWCPAj, przy minimalnej amplitudzie prądu stymulacji, która wywołała minimalną funkcjonalnie istotną reakcję mięśniową (zdefiniowaną jako co najmniej 5% amplitudy CMAP dla jednego z mięśni w odniesieniu do maksymalnej amplitudy CMAP tego mięśnia, która została wcześniej określona). Następnie wybrano miejsca aktywne o najwyższym SI dla każdego z trzech mięśni jako SI dla każdego mięśnia w danym eksperymencie.
Przewlekła biokompatybilność wewnątrznerwowa
Zgodnie z wcześniej opisaną procedurą50,63, nerw kulszowy znieczulonych samic szczurów Sprague-Dawley (250–300 g, ~w wieku 18 tygodni) i urządzenia do badania biokompatybilności in vivo z EGNITE i bez niego wszczepiono wzdłużnie w gałąź piszczelową nerwu kulszowego (n = 6–8 na grupę). W skrócie, nerw przekłuwa się w miejscu rozgałęzienia prostą igłą przymocowaną do nici pętelkowej 10-0 (STC-6, Ethicon); nić ciągnie za strzałkowatą końcówkę wygiętego paska elektrody. Końcówka jest przycięta w celu usunięcia nitki, a końcówki każdego ramienia są lekko wygięte, aby uniknąć wysunięcia urządzenia. Wybrano implant podłużny, ponieważ umożliwia lepsze badanie reakcji na ciało obce wewnątrz nerwu50.
Ocena czynnościowa nerwów i zwierząt
Zwierzęta oceniano podczas obserwacji po implantacji za pomocą badań przewodnictwa nerwowego, algezymetrii i testów lokomocji na torze chodzenia62. Do testów przewodzenia nerw kulszowy wszczepionej i przeciwnej łapy stymulowano elektrodami igłowymi w nacięciu kulszowym i rejestrowano CMAP mięśnia PL jak powyżej. Mierzono opóźnienie i amplitudę CMAP. Do testu algezymetrycznego szczury umieszczono na platformie z drucianej siatki i zastosowano mechaniczny, nieszkodliwy bodziec za pomocą metalowej końcówki połączonej z elektronicznym algezymetrem Von Freya (Bioseb). Mierzono próg nocyceptywny (siła w gramach, przy której zwierzęta cofały łapę) dla łap wszczepionych i przeciwnych. W teście chodzenia powierzchnię podeszwową tylnych łap pomalowano czarnym tuszem i każdy szczur pozostawiono, by szedł korytarzem. Zebrano ślady stóp i obliczono wskaźnik czynnościowy kulszowy62.
Histologia
Po 2 lub 8 tygodniach zwierzęta perfundowano PFA (4%), pobrano nerwy kulszowe, utrwalono je, zamrożono i poddano analizie histologicznej. W celu oceny FBR nerwy kulszowe pocięto na przekroje poprzeczne o grubości 15 μm za pomocą kriostatu (Leica CM190). Próbki barwiono pierwszorzędowymi przeciwciałami dla mielinowanych aksonów (anty-RT97 do znakowania Neurofilament 200K, 1:200; Developmental Studies Hybridoma Bank) i makrofagów (anty-Iba-1, 1:500; Wako). Następnie skrawki inkubowano przez 1 godzinę w temperaturze pokojowej z wtórnymi przeciwciałami osła przeciw mysiej Alexa Fluor 488 i osła przeciw królikowi Alexa Fluor 555 (1:200, Invitrogen). Wybrano reprezentatywne skrawki centralnej części implantu w nerwie piszczelowym, wykonano zdjęcia za pomocą mikroskopu epifluorescencyjnego (Eclipse Ni, Nikon) podłączonego do aparatu cyfrowego (DS-Ri2, Nikon) i przeprowadzono analizę obrazu za pomocą oprogramowania ImageJ (National Institutes zdrowia). Określono ilościowo ilość komórek Iba-1-dodatnich w całym obszarze nerwu piszczelowego i zmierzono grubość torebki tkankowej jako średnią odległość każdej strony implantu od najbliższych aksonów.
Analiza statystyczna
Do analizy statystycznej danych wykorzystaliśmy jedno- lub dwuczynnikową ANOVA, a następnie test post hoc Bonferroniego dla różnic między grupami lub czasami. Do graficznej reprezentacji i analizy wykorzystano oprogramowanie GraphPad Prism. Istotność statystyczną rozważano, kiedy P <0.05.
Podsumowanie raportowania
Dalsze informacje na temat projektu badań są dostępne w Podsumowanie sprawozdawczości dotyczącej portfela przyrody powiązane z tym artykułem.
- Dystrybucja treści i PR oparta na SEO. Uzyskaj wzmocnienie już dziś.
- PlatoData.Network Pionowe generatywne AI. Wzmocnij się. Dostęp tutaj.
- PlatoAiStream. Inteligencja Web3. Wiedza wzmocniona. Dostęp tutaj.
- PlatonESG. Węgiel Czysta technologia, Energia, Środowisko, Słoneczny, Gospodarowanie odpadami. Dostęp tutaj.
- Platon Zdrowie. Inteligencja w zakresie biotechnologii i badań klinicznych. Dostęp tutaj.
- Źródło: https://www.nature.com/articles/s41565-023-01570-5
- :ma
- :Jest
- :nie
- :Gdzie
- ][P
- $W GÓRĘ
- 000
- 1
- 10
- 100
- 12
- 13
- 130
- 15%
- 150
- 160
- 19
- 1998
- 20
- 200
- 2010
- 2011
- 2014
- 2016
- 2018
- 2020
- 2022
- 22
- 24
- 25
- 250
- 26
- 27
- 28
- 30
- 300
- 320
- 33
- 35%
- 350
- 40
- 400
- 41
- 43
- 46
- 50
- 500
- 54
- 58
- 60
- 600
- 7
- 70
- 700
- 75
- 8
- 80
- 87
- 9
- 90
- a
- Zdolny
- powyżej
- dostęp
- zgodność
- Stosownie
- akustyczny
- nabyć
- nabyty
- nabycie
- w poprzek
- działać
- aktywowany
- Aktywacja
- aktywny
- działalność
- adaptive
- Dodatkowy
- adres
- Skorygowana
- Dorosły
- Po
- AG
- ponownie
- AL
- Alkohol
- Alexa
- algorytm
- Wszystkie kategorie
- pozwala
- wzdłuż
- am
- Rozproszone
- ilość
- wzmacniany
- an
- analizuje
- analiza
- Kotwica
- i
- zwierzę
- zwierzęta
- Przeciwciała
- przeciwciało
- osobno
- Zastosowanie
- stosowany
- Stosowanie
- podejście
- właściwy
- zatwierdzenie
- zatwierdzony
- SĄ
- POWIERZCHNIA
- obszary
- ARM
- na około
- Szyk
- artykuł
- AS
- oszacować
- oszacowanie
- powiązany
- założenie
- At
- Atmosfera
- atomowy
- Uwaga
- upoważniony
- dostępny
- uniknąć
- z dala
- tło
- Bank
- Barcelona
- baza
- na podstawie
- Baseline
- BD
- BE
- Belka
- bo
- być
- zanim
- zachowanie
- poniżej
- Ulepsz Swój
- pomiędzy
- wiążący
- biomedyczny
- Bit
- Czarny
- zablokowany
- ciała
- ciało
- obie
- Pudełko
- Skrzynki
- Mózg
- mózg
- Oddział
- krótko
- szeroki
- przyniósł
- bufor
- ale
- by
- kabel
- obliczać
- obliczony
- aparat fotograficzny
- Pojemnościowy
- Pojemność
- który
- prowadzone
- walizka
- Kategoria
- ccl2
- komórka
- Komórki
- cement
- centralny
- wyzwania
- charakteryzuje
- opłata
- Charles
- chemiczny
- wybrany
- klasyfikacja
- sklasyfikowany
- kliknij
- zamknięte
- koktajl
- kolekcja
- kolumny
- połączony
- byliśmy spójni, od początku
- komisja
- społeczności
- społeczność
- Zakończony
- skład
- Warunki
- przeprowadzone
- przewodność
- systemu
- Skontaktuj się
- połączony
- za
- Składający się
- stały
- skontaktuj się
- zawarte
- ciągły
- wkład
- Konwergencja
- skorygowania
- Odpowiedni
- korytarz
- kora
- Rada
- odpowiednikami
- kurs
- pokryty
- krytyczny
- Krzyż
- kriokonserwowany
- Aktualny
- zwyczaj
- Ciąć
- cykl
- Cykle
- cytokiny
- szkodliwe
- Ciemny
- dane
- analiza danych
- Dni
- de
- spadek
- uważane
- zdefiniowane
- del
- dostarczona
- zależeć
- kaucja
- zdeponowany
- głębokość
- opisane
- Wnętrze
- życzenia
- szczegółowe
- Ustalać
- ustalona
- określaniu
- rozwojowy
- urządzenie
- urządzenia
- ZROBIŁ
- Dieta
- różnica
- Różnice
- różne
- cyfrowy
- digitalizacji
- rozcieńczony
- kierować
- bezpośrednio
- przemieszczenie
- Zakłócenie
- dystans
- podzielony
- do
- domena
- zrobić
- na dół
- Spadek
- z powodu
- czas trwania
- podczas
- E i T
- każdy
- krawędź
- elektryczny
- Elektroniczny
- element
- słoń
- podniesiony
- obejmujący
- energia
- wzmacniać
- wzmocnione
- wzmocnienie
- zapewnić
- wyposażony
- Równoważny
- ustanowiony
- szacunkowa
- Eter (ETH)
- etyczny
- EUR
- europejski
- EV
- oceniane
- ewaluację
- wydarzenie
- Każdy
- wszędzie
- udowodnione
- zbadać
- wyjątek
- spodziewany
- eksperyment
- eksperymentalny
- eksperymenty
- narażony
- Ekspozycja
- wyrażone
- stopień
- wyciąg
- ułatwiać
- fakt
- czynnik
- Spadać
- daleko
- FAST
- Korzyści
- Płeć żeńska
- Figa
- Postać
- wypełniony
- Film
- filmy
- filtracja
- W końcu
- i terminów, a
- dopasowywanie
- ustalony
- Elastyczność
- elastyczne
- pływ
- koncentruje
- skupienie
- następnie
- następujący
- jedzenie
- W razie zamówieenia projektu
- wytrzymałość
- obcy
- Nasz formularz
- formuła
- FRAME
- Darmowy
- swobodnie
- Zamrażanie
- francuski
- od
- z przodu
- zamrożone
- pełny
- w pełni
- funkcjonalny
- funkcjonalnie
- dalej
- przyszłość
- Wzrost
- dał
- Ogólne
- geometria
- Dać
- dany
- szkło
- GM
- Go
- Złoto
- Grafen
- trawa
- Ziemia
- Zarządzanie
- Grupy
- wytyczne
- miał
- Pół
- Prowadzenie
- Have
- Zdrowie
- pomoc
- półkule
- wysoka rozdzielczość
- Najwyższa
- posiadacz
- Otwór
- Strona główna
- Domowe biuro
- Poziomy
- HOT
- Jednak
- HTTPS
- Huang
- i
- zidentyfikowane
- zidentyfikować
- IEEE
- obraz
- Analiza obrazu
- zdjęcia
- Rezultat
- in
- Włącznie z
- wzrastający
- inkubowane
- inkubacja
- wskaźnik
- indywidualny
- zapalenie
- Informacja
- wkład
- wewnątrz
- Instytut
- instrukcje
- zintegrowany
- Integracja
- zamierzony
- Interfejs
- interfejsy
- najnowszych
- badać
- IT
- JEGO
- trzymane
- zestaw
- Koch
- Etykieta
- laboratorium
- duży
- większe
- laser
- Nazwisko
- Utajenie
- później
- Prawo
- warstwa
- najmniej
- lewo
- Prawodawstwo
- Długość
- poziom
- Biblioteka
- lubić
- Ograniczenia
- Linia
- LINK
- powiązany
- Ciecz
- załadować
- miejscowy
- usytuowany
- lokalizacji
- długo
- długoterminowy
- stracił
- opuszczony
- makrofagi
- zrobiony
- Główny
- utrzymać
- robić
- mapa
- Mapy
- maska
- dopasowane
- materiał
- materiały
- matplotlib
- maksymalny
- mc
- oznaczać
- znaczy
- mierzona
- pomiary
- Pomiary
- zmierzenie
- mechaniczny
- Media
- metal
- metoda
- mikrogleju
- mikrofon
- Mikroskop
- Mikroskopia
- Środkowy
- min
- minimalny
- minimum
- ministerstwo
- mieszanina
- ML
- model
- modele
- moduł
- Moduły
- cząsteczka
- monitorowane
- miesięcy
- mysz
- ruch
- przeniósł
- MS
- Wielokanałowy
- mięsień
- nanotechnologia
- narodowy
- Narodowy Instytut Zdrowia
- Natura
- Blisko
- niezbędny
- martwica
- wymagania
- ujemny
- NEO
- netto
- sieć
- Nerwowy
- neurofilament
- Neurony
- Następny
- Nie
- Hałas
- numer
- tępy
- przedmiot
- cel
- obiekty
- obserwować
- uzyskać
- uzyskane
- of
- poza
- Biurowe
- nieaktywny
- Stary
- on
- pewnego razu
- ONE
- tylko
- koncepcja
- otwory
- eksploatowane
- or
- Inne
- ludzkiej,
- na zewnątrz
- wydajność
- zewnętrzne
- koniec
- ogólny
- w ciągu nocy
- przegląd
- Tlen
- Pakiety
- ścieżka
- Ból
- pandy
- płyta
- część
- przechodzić
- wzory
- ŁAPY
- PBS
- Szczyt
- dla
- jest gwarancją najlepszej jakości, które mogą dostarczyć Ci Twoje monitory,
- wykonywane
- okres
- obwodowy
- faza
- fenotyp
- kołki
- rurociąg
- piksel
- umieszczony
- Planes
- Platforma
- platyna
- plato
- Analiza danych Platona
- PlatoDane
- plus
- pm
- punkt
- zwrotnica
- teczka
- position
- pozytywny
- Post
- potencjał
- power
- wstępny
- przygotowanie
- przygotowany
- obecność
- przedstawione
- zachowane
- nacisk
- poprzednio
- pierwotny
- Wcześniejszy
- sonda
- procedury
- wygląda tak
- obrobiony
- procesów
- produkcji
- Produkty
- prawidłowo
- niska zabudowa
- własność
- odsetek
- ochrony
- Białko
- protokół
- protokoły
- zapewniać
- że
- Ściąga
- puls
- Python
- R
- zasięg
- nośny
- SZCZUR
- Kurs
- stosunek
- RE
- reakcja
- Reakcje
- gotowy
- odbieranie
- zalecenia
- nagrany
- nagranie
- regeneracja
- zmniejszyć
- Zredukowany
- redukcja
- odniesienie
- regeneracja
- reżimy
- region
- względny
- pozostawać
- usunąć
- Usunięto
- usuwanie
- powtórzony
- obsługi produkcji rolnej, która zastąpiła
- Zgłoszone
- Raportowanie
- reprezentacja
- przedstawiciel
- Badania naukowe
- Odporność
- Rozkład
- poszanowanie
- odpowiednio
- odpowiedź
- Odpowiedzi
- Efekt
- Odwrócenie
- przeglądu
- wstążka
- Bogaty
- prawo
- Rosnąć
- Rzeka
- Pokój
- run
- s
- taki sam
- skanować
- skrypty
- druga
- wtórny
- Sekcja
- działy
- bezpieczne
- widzieć
- wybrany
- Serie
- Surowica
- Zestawy
- kilka
- Shape
- pokazane
- Targi
- bok
- Signal
- Sygnały
- znaczenie
- znaczący
- Srebro
- jednocześnie
- pojedynczy
- witryna internetowa
- Witryny
- Rozmiar
- skóra
- suwak
- slajdy
- przesuwny
- mały
- Snap
- Tworzenie
- rozwiązanie
- Dźwięk
- Źródło
- Przestrzenne
- Głośnik
- Głośniki
- określony
- okular
- Spektroskopia
- kolce
- Spin
- Kwadratowa
- Stabilność
- ustabilizować
- stos
- Stal nierdzewna
- standard
- standaryzowany
- Startowy
- Stan
- statystyczny
- statystyka
- Steam
- stal
- trzon
- Ewolucja krok po kroku
- Cel
- bodziec
- przechowywanie
- przechowywany
- proste
- Strategia
- Rozebrać się
- silny
- strukturalny
- Struktury
- badania naukowe
- Badanie
- podskórnie
- kolejny
- znaczny
- taki
- suma
- Powierzchnia
- Chirurgia
- system
- T
- Brać
- Zadania
- cel
- Zadanie
- Techniki
- Technologia
- tymczasowy
- test
- Testy
- niż
- że
- Połączenia
- Strefa
- Przyszłość
- UK
- ich
- następnie
- Tam.
- termiczny
- one
- to
- tych
- trzy
- próg
- Przez
- poprzez
- A zatem
- czas
- czasy
- typ
- wskazówki
- tkanka
- Tytan
- do
- TON
- Top
- Kwota produktów:
- dotykając
- w kierunku
- śledzić
- pociągi
- trans
- przenieść
- przeniesione
- Przesyłanie
- przejście
- leczony
- leczenie
- zabiegi
- Próby
- Tutorial
- drugiej
- rodzaj
- Uk
- ultradźwięk
- dla
- zrozumienie
- przeszedł
- aż do
- posługiwać się
- używany
- za pomocą
- Odkurzać
- ważny
- wartość
- Wartości
- Przeciw
- przez
- vivo
- Napięcie
- Tom
- z
- W
- spacer
- chodzący
- była
- Woda
- we
- tydzień
- tygodni
- ważenia
- waga
- Dobrobyt
- były
- jeśli chodzi o komunikację i motywację
- który
- Podczas
- biały
- cały
- okno
- Drut
- w
- wycofanie
- bez
- Praca
- pracował
- pracujący
- X
- rentgenowski
- zefirnet