16 januari 2024
(Nanowerk NieuwsEen belangrijke chemische reactie – waarbij de beweging van protonen tussen het oppervlak van een elektrode en een elektrolyt een elektrische stroom aandrijft – is een cruciale stap in veel energietechnologieën, waaronder brandstofcellen en de elektrolyzers die worden gebruikt om waterstofgas te produceren. Voor het eerst hebben MIT-chemici in detail in kaart gebracht hoe deze proton-gekoppelde elektronenoverdrachten plaatsvinden op een elektrodeoppervlak. Hun resultaten kunnen onderzoekers helpen efficiëntere brandstofcellen, batterijen of andere energietechnologieën te ontwerpen. “Onze vooruitgang in dit artikel was het bestuderen en begrijpen van de aard van hoe deze elektronen en protonen aan het oppervlak paren, wat relevant is voor katalytische reacties die belangrijk zijn in de context van apparaten voor energieconversie of katalytische reacties”, zegt Yogesh Surendranath, een onderzoeker. hoogleraar scheikunde en chemische technologie aan het MIT en senior auteur van het onderzoek. Onder hun bevindingen konden de onderzoekers precies nagaan hoe veranderingen in de pH van de elektrolytoplossing rond een elektrode de snelheid van protonbeweging en elektronenstroom binnen de elektrode beïnvloeden. MIT-student Noah Lewis is de hoofdauteur van het artikel, dat vandaag verschijnt in Natuurchemie (“Een mechanistisch raamwerk op moleculair niveau voor grensvlakproton-gekoppelde elektronenoverdrachtskinetiek”). Ryan Bisbey, een voormalig MIT-postdoc; Karl Westendorff, een afgestudeerde MIT-student; en Alexander Soudackov, een onderzoekswetenschapper aan de Yale Universiteit, zijn ook auteurs van het artikel.
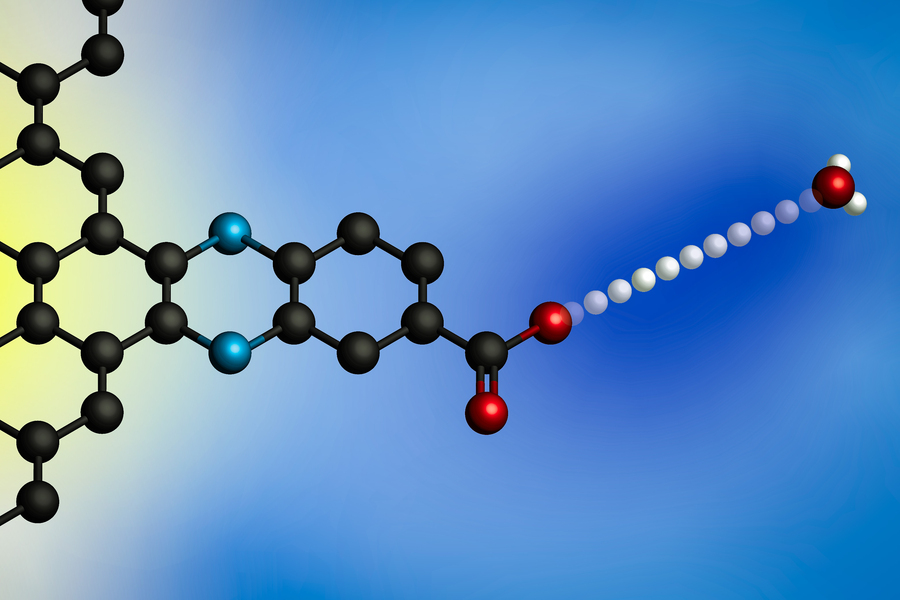 Het aanleggen van een elektrische potentiaal zorgt ervoor dat een proton overgaat van een hydroniumion (rechts) naar het oppervlak van een elektrode. Met behulp van elektroden met moleculair gedefinieerde protonbindingsplaatsen ontwikkelden MIT-onderzoekers een algemeen model voor deze grensvlakproton-gekoppelde elektronenoverdrachtsreacties. (Afbeelding: met dank aan de onderzoekers)
Het aanleggen van een elektrische potentiaal zorgt ervoor dat een proton overgaat van een hydroniumion (rechts) naar het oppervlak van een elektrode. Met behulp van elektroden met moleculair gedefinieerde protonbindingsplaatsen ontwikkelden MIT-onderzoekers een algemeen model voor deze grensvlakproton-gekoppelde elektronenoverdrachtsreacties. (Afbeelding: met dank aan de onderzoekers)
 Het aanleggen van een elektrische potentiaal zorgt ervoor dat een proton overgaat van een hydroniumion (rechts) naar het oppervlak van een elektrode. Met behulp van elektroden met moleculair gedefinieerde protonbindingsplaatsen ontwikkelden MIT-onderzoekers een algemeen model voor deze grensvlakproton-gekoppelde elektronenoverdrachtsreacties. (Afbeelding: met dank aan de onderzoekers)
Het aanleggen van een elektrische potentiaal zorgt ervoor dat een proton overgaat van een hydroniumion (rechts) naar het oppervlak van een elektrode. Met behulp van elektroden met moleculair gedefinieerde protonbindingsplaatsen ontwikkelden MIT-onderzoekers een algemeen model voor deze grensvlakproton-gekoppelde elektronenoverdrachtsreacties. (Afbeelding: met dank aan de onderzoekers)
Protonen passeren
Proton-gekoppelde elektronenoverdracht vindt plaats wanneer een molecuul, vaak water of een zuur, een proton overbrengt naar een ander molecuul of naar een elektrodeoppervlak, wat de protonacceptor stimuleert om ook een elektron op te nemen. Dit soort reactie is voor veel energietoepassingen benut. “Deze proton-gekoppelde elektronenoverdrachtsreacties zijn alomtegenwoordig. Het zijn vaak sleutelstappen in katalytische mechanismen, en zijn vooral belangrijk voor energieconversieprocessen zoals waterstofopwekking of brandstofcelkatalyse”, zegt Surendranath. In een waterstofgenererende elektrolyseur wordt deze aanpak gebruikt om protonen uit water te verwijderen en elektronen aan de protonen toe te voegen om waterstofgas te vormen. In een brandstofcel wordt elektriciteit opgewekt wanneer protonen en elektronen uit waterstofgas worden verwijderd en aan zuurstof worden toegevoegd om water te vormen. Proton-gekoppelde elektronenoverdracht is gebruikelijk bij veel andere soorten chemische reacties, bijvoorbeeld koolstofdioxidereductie (de omzetting van koolstofdioxide in chemische brandstoffen door elektronen en protonen toe te voegen). Wetenschappers hebben veel geleerd over hoe deze reacties plaatsvinden als de protonacceptoren moleculen zijn, omdat ze de structuur van elk molecuul nauwkeurig kunnen controleren en kunnen observeren hoe elektronen en protonen daartussen passeren. Wanneer proton-gekoppelde elektronenoverdracht echter plaatsvindt aan het oppervlak van een elektrode, is het proces veel moeilijker te bestuderen omdat de elektrodeoppervlakken meestal zeer heterogeen zijn, met veel verschillende plaatsen waaraan een proton zich mogelijk zou kunnen binden. Om dat obstakel te overwinnen, heeft het MIT-team een manier ontwikkeld om elektrode-oppervlakken te ontwerpen die hen een veel nauwkeurigere controle geeft over de samenstelling van het elektrode-oppervlak. Hun elektroden bestaan uit lagen grafeen met organische, ringhoudende verbindingen aan het oppervlak. Aan het uiteinde van elk van deze organische moleculen bevindt zich een negatief geladen zuurstofion dat protonen uit de omringende oplossing kan accepteren, waardoor een elektron uit het circuit naar het grafietoppervlak stroomt. "We kunnen een elektrode maken die niet uit een grote diversiteit aan locaties bestaat, maar uit een uniforme reeks van een enkel type zeer goed gedefinieerde locaties bestaat die elk een proton met dezelfde affiniteit kunnen binden", zegt Surendranath. “Aangezien we deze zeer goed gedefinieerde locaties hebben, konden we hierdoor de kinetiek van deze processen echt ontrafelen.” Met behulp van dit systeem konden de onderzoekers de stroom van elektrische stroom naar de elektroden meten, waardoor ze de snelheid van protonenoverdracht naar het zuurstofion aan het oppervlak in evenwicht konden berekenen – de toestand waarin de snelheid van protonendonatie aan het oppervlak en protonenoverdracht terug naar de oplossing vanaf het oppervlak zijn gelijk. Ze ontdekten dat de pH van de omringende oplossing een significant effect heeft op deze snelheid: de hoogste waarden kwamen voor aan de uiterste uiteinden van de pH-schaal: pH 0, de meest zure, en pH 14, de meest basische. Om deze resultaten te verklaren, ontwikkelden onderzoekers een model gebaseerd op twee mogelijke reacties die aan de elektrode kunnen optreden. 3O+), die in sterk zure oplossingen in hoge concentraties voorkomen, leveren protonen aan de zuurstofionen aan het oppervlak, waardoor water ontstaat. In het tweede geval levert water protonen aan de zuurstofionen aan het oppervlak, waardoor hydroxide-ionen (OH-), die in hoge concentratie aanwezig zijn in sterk basische oplossingen. De snelheid bij pH 0 is echter ongeveer vier keer sneller dan die bij pH 14, deels omdat hydronium protonen sneller afgeeft dan water.Een reactie om te heroverwegen
De onderzoekers ontdekten tot hun verbazing ook dat de twee reacties gelijke snelheden hebben, niet bij een neutrale pH 7, waar de hydronium- en hydroxideconcentraties gelijk zijn, maar bij pH 10, waar de concentratie van hydroxide-ionen 1 miljoen keer zo hoog is als die van hydronium. Het model suggereert dat dit komt doordat de voorwaartse reactie waarbij protonendonatie uit hydronium of water betrokken is, meer bijdraagt aan de totale snelheid dan de achterwaartse reactie waarbij protonenverwijdering door water of hydroxide betrokken is. Bestaande modellen van hoe deze reacties plaatsvinden op elektrodeoppervlakken gaan ervan uit dat de voorwaartse en achterwaartse reacties in gelijke mate bijdragen aan de totale snelheid, dus de nieuwe bevindingen suggereren dat die modellen mogelijk moeten worden heroverwogen, zeggen de onderzoekers. "Dat is de standaardaanname, dat de voorwaartse en achterwaartse reacties in gelijke mate bijdragen aan de reactiesnelheid", zegt Surendranath. "Onze bevinding is echt eye-openend omdat het betekent dat de veronderstelling die mensen gebruiken om alles te analyseren, van brandstofcelkatalyse tot waterstofevolutie, iets is dat we opnieuw moeten bekijken." De onderzoekers gebruiken nu hun experimentele opstelling om te bestuderen hoe het toevoegen van verschillende soorten ionen aan de elektrolytoplossing rond de elektrode de snelheid van de proton-gekoppelde elektronenstroom kan versnellen of vertragen. “Met ons systeem weten we dat onze locaties constant zijn en elkaar niet beïnvloeden, zodat we kunnen uitlezen wat de verandering in de oplossing doet met de reactie aan de oppervlakte”, zegt Lewis.- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://www.nanowerk.com/news2/green/newsid=64425.php
- : heeft
- :is
- :niet
- :waar
- $UP
- 1
- 10
- 11
- 13
- 14
- 16
- 7
- 8
- a
- in staat
- Over
- ACCEPTEREN
- toevoegen
- toegevoegd
- toe te voegen
- bevorderen
- invloed hebben op
- die van invloed
- Alexander
- toegestaan
- ook
- onder
- an
- analyseren
- en
- Nog een
- komt naar voren
- toepassingen
- Het toepassen van
- nadering
- ZIJN
- reeks
- AS
- ervan uitgaan
- aanname
- At
- auteur
- auteurs
- terug
- gebaseerde
- basis-
- batterijen
- BE
- omdat
- geweest
- tussen
- binden
- verbindend
- maar
- by
- berekenen
- CAN
- carbon
- kooldioxide
- oorzaken
- cel
- Cellen
- Centreren
- verandering
- Wijzigingen
- opgeladen
- chemisch
- chemie
- chemici
- Gemeen
- samenstelling
- concentratie
- constante
- verband
- bijdragen
- draagt bij
- onder controle te houden
- Camper ombouw
- kon
- Koppel
- en je merk te creëren
- kritisch
- Actueel
- Datum
- transactie
- Standaard
- gedefinieerd
- leveren
- levert
- Design
- detail
- ontwikkelde
- systemen
- anders
- moeilijk
- ontdekt
- Verscheidenheid
- do
- Nee
- doen
- schenking
- beneden
- drives
- elk
- effect
- doeltreffend
- Elektrisch
- elektriciteit
- elektrolyt
- elektronen
- einde
- eindigt
- energie-niveau
- Engineering
- gelijk
- even
- Evenwicht
- Ether (ETH)
- alles
- Evolutie
- precies
- voorbeeld
- bestaand
- experimenteel
- Verklaren
- extreem
- sneller
- het vinden van
- bevindingen
- Voornaam*
- eerste keer
- stroom
- Voor
- formulier
- Voormalig
- Naar voren
- gevonden
- vier
- Achtergrond
- oppompen van
- Brandstof
- brandstofcellen
- brandstoffen
- GAS
- Algemeen
- gegenereerde
- het genereren van
- generatie
- geeft
- afstuderen
- Grafeen
- groot
- gebeuren
- benut
- Hebben
- Hart
- hulp
- Hoge
- hoogst
- Hoe
- Echter
- HTTPS
- waterstof
- beeld
- belangrijk
- in
- Inclusief
- in
- waarbij
- IT
- jpg
- karl
- sleutel
- Soort
- blijven
- leiden
- geleerd
- Lewis
- veel
- Mei..
- middel
- maatregel
- mechanismen
- Midden
- miljoen
- MIT
- MIT afgestudeerd
- model
- modellen
- molecuul
- meer
- efficiënter
- meest
- beweging
- beweging
- veel
- NATUUR
- Noodzaak
- negatief
- Neutraal
- New
- Noach
- nu
- waarnemen
- hindernis
- zich voordoen
- opgetreden
- of
- vaak
- on
- or
- organisch
- Overige
- onze
- uit
- over
- totaal
- Overwinnen
- Zuurstof
- Papier
- deel
- vooral
- passeren
- Mensen
- Plato
- Plato gegevensintelligentie
- PlatoData
- mogelijk
- potentieel
- mogelijk
- nauwkeurig
- Precies
- processen
- produceren
- Hoogleraar
- protonen
- tarief
- Tarieven
- reactie
- reacties
- Lees
- werkelijk
- reductie
- relevante
- verwijdering
- verwijderen
- verwijderd
- Hernieuwbare
- hernieuwbare energie
- onderzoek
- onderzoekers
- Resultaten
- onthult
- omkeren
- rechts
- Ryan
- s
- dezelfde
- ervaren
- zegt
- Scale
- Wetenschapper
- wetenschappers
- Tweede
- senior
- setup
- aanzienlijke
- single
- website
- Locaties
- traag
- So
- oplossing
- Oplossingen
- iets
- snelheid
- Land
- Stap voor
- Stappen
- stimuleert
- sterk
- structuur
- Student
- Studie
- Bestuderen
- dergelijk
- stel
- Stelt voor
- Oppervlak
- verrassing
- nabijgelegen
- system
- Nemen
- team
- Technologies
- neem contact
- dat
- De
- De Staat
- hun
- Ze
- Deze
- ze
- dit
- die
- niet de tijd of
- keer
- naar
- vandaag
- opsporen
- overdracht
- transfers
- twee
- type dan:
- types
- alomtegenwoordig
- begrip
- universiteit-
- ontwarren
- us
- gebruikt
- gebruik
- doorgaans
- zeer
- was
- Water
- Manier..
- we
- goed gedefinieerd
- waren
- Wat
- wanneer
- welke
- breed
- Met
- binnen
- zephyrnet