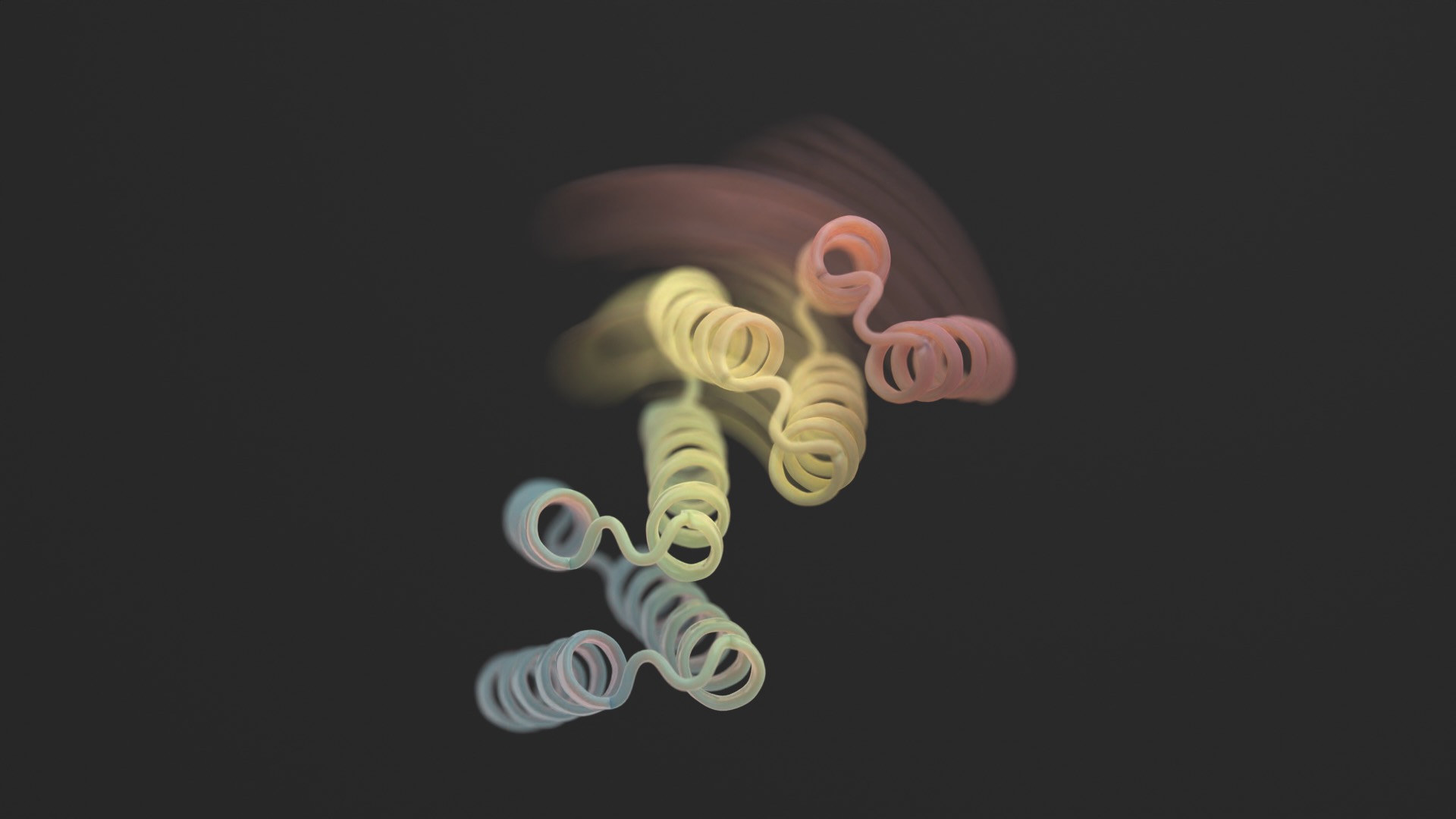
We beschouwen eiwitten vaak als onveranderlijke 3D-sculpturen.
Dat klopt niet helemaal. Veel eiwitten zijn transformatoren die hun vorm verdraaien en veranderen, afhankelijk van de biologische behoeften. Eén configuratie kan schadelijke signalen van een beroerte of hartaanval verspreiden. Een ander kan de resulterende moleculaire cascade blokkeren en de schade beperken.
In zekere zin gedragen eiwitten zich als biologische transistors: aan-uitschakelaars aan de basis van de moleculaire 'computer' van het lichaam, die bepalen hoe deze reageert op externe en interne krachten en feedback. Wetenschappers hebben deze vormveranderende eiwitten lang bestudeerd om te ontcijferen hoe ons lichaam functioneert.
Maar waarom alleen op de natuur vertrouwen? Kunnen we vanuit het niets biologische ‘transistors’ creëren, die onbekend zijn in het biologische universum?
Voer AI in. Meerdere deep learning-methoden kunnen eiwitstructuren al nauwkeurig voorspellen –een doorbraak die al een halve eeuw in de maak is. Latere studies met steeds krachtigere algoritmen hebben eiwitstructuren gehallucineerd die niet door de krachten van de evolutie worden beïnvloed.
Toch hebben deze door AI gegenereerde structuren een nadeel: hoewel ze zeer ingewikkeld zijn, zijn de meeste volledig statisch – in wezen een soort digitale eiwitsculptuur bevroren in de tijd.
Een nieuwe studie in Wetenschap deze maand doorbrak het model door flexibiliteit toe te voegen aan designereiwitten. De nieuwe structuren zijn geen slangenmensen zonder grenzen. De designereiwitten kunnen zich echter in twee verschillende vormen stabiliseren – denk aan een scharnier in een open of gesloten configuratie – afhankelijk van een extern biologisch ‘slot’. Elke toestand is analoog aan de “0” of “1” van een computer, die vervolgens de uitvoer van de cel bestuurt.
“Vroeger konden we alleen eiwitten maken die één stabiele configuratie hadden”, zegt studieauteur Dr. Florian Praetorius van de Universiteit van Washington. “Nu kunnen we eindelijk eiwitten maken die bewegen, wat een buitengewoon scala aan toepassingen zou moeten openen.”
Hoofdauteur Dr. David Baker heeft ideeën: "Van het vormen van nanostructuren die reageren op chemicaliën in het milieu tot toepassingen bij de toediening van medicijnen, we beginnen nog maar net hun potentieel te benutten."
Een eiwithuwelijk gemaakt in AI
Een kort stukje biologie 101.
Eiwitten bouwen en besturen ons lichaam. Deze macromoleculen beginnen hun reis vanuit DNA. Genetische informatie wordt vertaald in aminozuren, de bouwstenen van een eiwit: beeldkralen aan een touwtje. Elke draad wordt vervolgens in ingewikkelde 3D-vormen gevouwen, waarbij sommige delen aan andere blijven plakken. Sommige configuraties worden secundaire structuren genoemd en lijken op Twizzlers. Anderen weven tot tapijtachtige lakens. Deze vormen bouwen verder op elkaar voort en vormen zeer geavanceerde eiwitarchitecturen.
Door te begrijpen hoe eiwitten hun vorm krijgen, kunnen we mogelijk nieuwe vormen ontwikkelen, waardoor het biologische universum wordt uitgebreid en nieuwe wapens worden gecreëerd tegen virale infecties en andere ziekten.
In 2020 braken AlphaFold van DeepMind en RoseTTAFold van het laboratorium van David Baker het structurele biologie-internet door eiwitstructuren nauwkeurig te voorspellen op basis van alleen hun aminozuursequenties.
Sindsdien hebben de AI-modellen de vorm voorspeld van vrijwel elk eiwit dat de wetenschap kent (en onbekend is). Deze krachtige instrumenten geven het biologische onderzoek nu al een nieuwe vorm, waardoor wetenschappers snel potentiële doelwitten kunnen identificeren antibioticaresistentie bestrijden, bestudeer de “huisvesting” van ons DNA, nieuwe vaccins ontwikkelen of zelfs licht werpen op ziekten die de hersenen verwoesten Parkinson.
Toen kwam er een bom: generatieve AI-modellen, zoals DALL-E en ChatGPT, boden een verleidelijk vooruitzicht. Waarom niet, in plaats van simpelweg eiwitstructuren te voorspellen? laat AI dromen volledig nieuw eiwitstructuren in plaats daarvan? Van een eiwit dat hormonen bindt om de calciumspiegels te reguleren kunstmatige enzymen die bioluminescentie katalyseren, wekten de eerste resultaten enthousiasme op en leken de mogelijkheden voor door AI ontworpen eiwitten eindeloos.
Aan het roer van deze ontdekkingen staat het laboratorium van Baker. Kort na het uitbrengen van RoseTTAFold ontwikkelden ze het algoritme verder om functionele plaatsen op een eiwit vast te stellen – waar het interageert met andere eiwitten, medicijnen of antilichamen – waardoor de weg werd vrijgemaakt voor wetenschappers om verzinnen nieuwe medicijnen die ze zich nog niet hebben voorgesteld.
Toch ontbrak er één ding: flexibiliteit. Een groot aantal eiwitten 'coderen' van vorm om hun biologische boodschap te veranderen. Het resultaat kan letterlijk leven of dood zijn: een eiwit genaamd Bax bijvoorbeeld, verandert zijn vorm in een conformatie die celdood veroorzaakt. Amyloïde bèta, een eiwit dat betrokken is bij de ziekte van Alzheimer, neemt notoir een andere vorm aan omdat het hersencellen schaadt.
Een AI die vergelijkbare flip-flop-eiwitten hallucineert, zou ons dichter bij het begrip en de recapitulatie van deze biologische raadsels kunnen brengen, wat tot nieuwe medische oplossingen zou kunnen leiden.
Scharnier, lijn en zinklood
Het ontwerpen van één eiwit op atomair niveau – en hopen dat het in een levende cel werkt – is moeilijk. Het ontwerpen van één met twee configuraties is een nachtmerrie.
Als losse analogie kun je denken aan ijskristallen in een wolk die uiteindelijk sneeuwvlokken vormen, elk met een andere structuur. De taak van de AI is om eiwitten te maken die kunnen schakelen tussen twee verschillende “sneeuwvlokken” met behulp van hetzelfde aminozuur “ijskristallen”, waarbij elke toestand overeenkomt met een “aan” of “uit” schakelaar. Bovendien moet het eiwit goed spelen in levende cellen.
Het team begon met verschillende regels. Ten eerste zou elke structuur er tussen de twee toestanden enorm verschillend uit moeten zien, zoals een menselijk profiel dat staat of zit. Ze konden dit controleren door de afstanden tussen atomen te meten, legde het team uit. Ten tweede moet de verandering snel plaatsvinden. Dit betekent dat het eiwit zich niet volledig kan ontvouwen voordat het zichzelf weer in een andere vorm samenvoegt, wat tijd kost.
Dan zijn er enkele richtlijnen voor het beheer van een functioneel eiwit: het moet in beide toestanden goed omgaan met lichaamsvloeistoffen. Ten slotte moet het als schakelaar fungeren en van vorm veranderen afhankelijk van de in- en uitgangen.
Het is een uitdaging om aan al deze eigenschappen in één eiwitsysteem te voldoen, aldus het team.
Door een mix van AlphaFold, Rosetta en ProteinMPNN te gebruiken, ziet het uiteindelijke ontwerp eruit als een scharnier. Het heeft twee stijve delen die ten opzichte van elkaar kunnen bewegen, terwijl een ander stuk gevouwen blijft. Normaal gesproken is het eiwit gesloten. De trigger is een klein peptide (een korte keten van aminozuren) dat zich aan de scharnieren bindt en de vormverandering teweegbrengt. Deze zogenaamde ‘effectorpeptiden’ zijn zorgvuldig ontworpen met het oog op specificiteit, waardoor de kans kleiner wordt dat ze zich op delen buiten het doelgebied vastgrijpen.
Het team voegde eerst glow-in-the-dark-triggerpeptiden toe aan meerdere scharnierontwerpen. Uit verdere analyse bleek dat de trekker gemakkelijk op het scharnier greep. De configuratie van het eiwit veranderde. Ter controle werd de vorm eerder voorspeld met behulp van AI-analyse.
Aanvullende onderzoeken waarbij gebruik werd gemaakt van gekristalliseerde structuren van de eiwitontwerpen, met of zonder de effector, bevestigden de resultaten verder. Deze tests hebben ook ontwerpprincipes opgespoord die ervoor zorgden dat het scharnier werkte, en parameters die de ene toestand naar de andere doen overhellen.
De take-away? AI kan nu eiwitten ontwerpen met twee verschillende toestanden – in wezen biologische transistors bouwen voor synthetische biologie. Voorlopig gebruikt het systeem alleen op maat ontworpen effectorpeptiden in hun onderzoeken, wat het onderzoek en het klinische potentieel kan beperken. Maar volgens het team kan de strategie zich ook uitstrekken tot natuurlijke peptiden, zoals die eiwitten binden die betrokken zijn bij het reguleren van de bloedsuikerspiegel, het water in weefsels reguleren of de hersenactiviteit beïnvloeden.
"Net als transistors in elektronische circuits kunnen we de schakelaars koppelen aan externe uitgangen en ingangen om detectieapparaten te creëren en deze in grotere eiwitsystemen op te nemen", aldus het team.
Auteur van het onderzoek, dr. Philip Leung, voegt hieraan toe: “Dit zou een revolutie teweeg kunnen brengen in de biotechnologie, op dezelfde manier waarop transistors de elektronica transformeerden.”
Beeldcredits: Ian C Haydon/ UW Instituut voor Eiwitontwerp
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. Automotive / EV's, carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- ChartPrime. Verhoog uw handelsspel met ChartPrime. Toegang hier.
- BlockOffsets. Eigendom voor milieucompensatie moderniseren. Toegang hier.
- Bron: https://singularityhub.com/2023/08/22/ai-can-now-design-proteins-that-behave-like-biological-transistors/
- : heeft
- :is
- :niet
- $UP
- 2020
- 3d
- a
- AC
- Volgens
- nauwkeurig
- Handelen
- activiteit
- toegevoegd
- toe te voegen
- Daarnaast
- Voegt
- Na
- tegen
- AI
- AI-modellen
- algoritme
- algoritmen
- Alles
- alleen
- al
- ook
- Hoewel
- Alzheimer
- amyloid
- an
- analyse
- en
- Nog een
- toepassingen
- ZIJN
- AS
- At
- aanvallen
- auteur
- weg
- terug
- bakker
- gebaseerde
- BE
- vaardigheden
- begon
- beginnen
- beta
- tussen
- binden
- biologie
- biotechnologie
- Beetje
- Blok
- Blokken
- bloed
- lichamen
- zowel
- Hersenen
- Hersenactiviteit
- hersencellen
- doorbraak
- Kapot gegaan
- bouw
- Gebouw
- maar
- by
- Dit betekent dat we onszelf en onze geliefden praktisch vergiftigen.
- kwam
- CAN
- voorzichtig
- watervallen
- katalyseren
- cel
- Cellen
- Eeuw
- keten
- uitdagend
- kansen
- verandering
- veranderd
- veranderende
- ChatGPT
- controle
- chemicaliën
- Klinisch
- CLOSED
- dichterbij
- Cloud
- compleet
- Configuratie
- controles
- Overeenkomend
- kon
- Koppel
- en je merk te creëren
- Wij creëren
- Credits
- van dall
- te beschadigen
- David
- Dood
- Ontcijferen
- deep
- diepgaand leren
- DeepMind
- levering
- Afhankelijk
- Design
- ontwerpprincipes
- ontworpen
- leesmaatjes
- ontwerpen
- ontwerpen
- bepalen
- ontwikkelde
- systemen
- anders
- digitaal
- Ziekte
- ziekten
- dna
- beneden
- val
- dr
- droom
- drug
- Medicijnafgifte
- Drugs
- elk
- gemakkelijk
- rand
- effector
- beide
- elektronisch
- Elektronica
- Eindeloos
- ingenieur
- enthousiasme
- Milieu
- Zelfs
- uiteindelijk
- Alle
- Evolutie
- voorbeeld
- uit te breiden
- uitgelegd
- verlengen
- extern
- buitengewoon
- SNELLE
- feedback
- finale
- Tot slot
- Voornaam*
- Flexibiliteit
- Voor
- Krachten
- formulier
- gevonden
- oppompen van
- bevroren
- functie
- functioneel
- verder
- Krijgen
- generatief
- generatieve AI
- richtlijnen
- HAD
- Helft
- gebeuren
- Hard
- schaden
- Harms
- Hebben
- Hart
- Hartaanval
- het helpen van
- zeer
- Scharnier
- in de hoop
- Hoe
- Echter
- HTTPS
- menselijk
- ICE
- ideeën
- ingebeeld
- onveranderlijk
- in
- nemen
- in toenemende mate
- infecties
- beïnvloeden
- informatie
- eerste
- ingangen
- binnen
- verkrijgen in plaats daarvan
- Instituut
- wisselwerking
- intern
- Internet
- in
- betrokken zijn
- IT
- HAAR
- zelf
- Jobomschrijving:
- voor slechts
- laboratorium
- Groot
- groter
- leren
- niveaus
- Life
- licht
- als
- LIMIT
- grenzen
- Lijn
- leven
- lang
- Kijk
- ziet eruit als
- LOOKS
- het verlagen van
- gemaakt
- maken
- veel
- Mei..
- middel
- het meten van
- medisch
- Bericht
- methoden
- vermist
- mengen
- modellen
- moleculair
- Maand
- meest
- beweging
- meervoudig
- Naturel
- NATUUR
- behoeften
- New
- mooi
- NIH
- normaal
- nu
- aantal
- of
- aangeboden
- vaak
- on
- EEN
- degenen
- Slechts
- open
- or
- Overige
- Overig
- onze
- uitgang
- parameters
- onderdelen
- stuk
- Plato
- Plato gegevensintelligentie
- PlatoData
- Spelen
- potentieel
- mogelijk
- krachtige
- voorspellen
- voorspeld
- het voorspellen van
- die eerder
- principes
- Profiel
- vastgoed
- vooruitzicht
- Eiwit
- Eiwitten
- Quick
- snel
- reeks
- liever
- reageert
- Reguleren
- regelend
- relatief
- het vrijgeven van
- vertrouwen
- stoffelijk overschot
- onderzoek
- Reageren
- resultaat
- verkregen
- Resultaten
- revolutioneren
- rechts
- stijf
- wortel
- reglement
- lopen
- Zei
- dezelfde
- Wetenschap
- wetenschappers
- krassen
- Tweede
- secundair
- scheen
- verscheidene
- Vorm
- vormen
- werpen
- verschuiving
- Bermuda's
- binnenkort
- moet
- signalen
- gelijk
- eenvoudigweg
- Locaties
- Zittend
- Klein
- sneeuwvlokken
- Oplossingen
- sommige
- geraffineerd
- aangewakkerd
- specificiteit
- stabiliseren
- stabiel
- Start
- Land
- Staten
- plakken
- Strategie
- Draad
- structureel
- structuur
- bestudeerd
- studies
- Studie
- volgend
- Hierop volgend
- dergelijk
- suiker
- Stap over voor slechts
- synthetisch
- system
- Systems
- Nemen
- neemt
- Tik
- doelen
- team
- testen
- neem contact
- dat
- De
- hun
- Ze
- harte
- Er.
- Deze
- ze
- ding
- denken
- dit
- die
- niet de tijd of
- type
- weefsels
- naar
- samen
- tools
- getransformeerd
- transformers
- leiden
- twist
- twee
- begrip
- Universum
- universiteit-
- universiteit van Washington
- onbekend
- us
- toepassingen
- gebruik
- gevalideerd
- virale
- was
- Washington
- Water
- Manier..
- we
- Wapens
- Weave
- web
- waren
- welke
- en
- Waarom
- Met
- zonder
- Mijn werk
- Bedrijven
- nog
- zephyrnet