16 年 2024 月 XNUMX 日
(Nanowerkニュース) 重要な化学反応 (電極の表面と電解質の間での陽子の移動によって電流が流れる) は、燃料電池や水素ガスの生成に使用される電解槽など、多くのエネルギー技術において重要なステップです。 MITの化学者らは、これらの陽子結合電子移動が電極表面でどのように起こるかを初めて詳細に解明した。その結果は、研究者がより効率的な燃料電池、バッテリー、その他のエネルギー技術を設計するのに役立つ可能性があります。 「この論文における私たちの進歩は、これらの電子と陽子が表面部位でどのように結合するかの性質を研究し、理解することでした。これは、エネルギー変換デバイスや触媒反応の文脈において重要な触媒反応に関連しています」とヨゲシュ・スレンドラナート氏は述べています。マサチューセッツ工科大学の化学および化学工学の教授であり、この研究の主著者。その発見の中で、研究者らは、電極を囲む電解質溶液のpHの変化が電極内のプロトンの運動速度と電子の流れにどのような影響を与えるかを正確に追跡することができました。 MITの大学院生ノア・ルイスが論文の筆頭著者であり、この論文は本日掲載される。 自然化学 (「界面プロトン共役電子移動動力学の分子レベルの機構的枠組み」)。ライアン・ビズビー、元MIT博士研究員。カール・ウェステンドルフ、MIT 大学院生。エール大学の研究員アレクサンダー・ソウダコフ氏もこの論文の著者である。
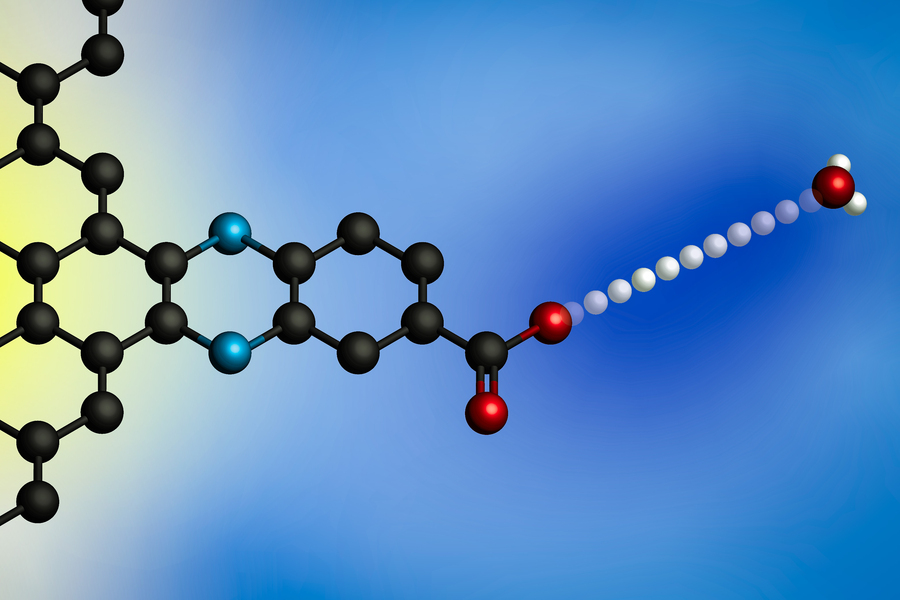 電位を加えると、プロトンがヒドロニウム イオン (右) から電極表面に移動します。 MIT の研究者は、分子的に定義されたプロトン結合部位を備えた電極を使用して、これらの界面プロトン共役電子移動反応の一般モデルを開発しました。 (画像:研究者提供)
電位を加えると、プロトンがヒドロニウム イオン (右) から電極表面に移動します。 MIT の研究者は、分子的に定義されたプロトン結合部位を備えた電極を使用して、これらの界面プロトン共役電子移動反応の一般モデルを開発しました。 (画像:研究者提供)
 電位を加えると、プロトンがヒドロニウム イオン (右) から電極表面に移動します。 MIT の研究者は、分子的に定義されたプロトン結合部位を備えた電極を使用して、これらの界面プロトン共役電子移動反応の一般モデルを開発しました。 (画像:研究者提供)
電位を加えると、プロトンがヒドロニウム イオン (右) から電極表面に移動します。 MIT の研究者は、分子的に定義されたプロトン結合部位を備えた電極を使用して、これらの界面プロトン共役電子移動反応の一般モデルを開発しました。 (画像:研究者提供)
陽子の通過
プロトン共役電子移動は、分子(多くの場合水や酸)がプロトンを別の分子または電極表面に移動させ、プロトン受容体が刺激されて電子を取り込むときに発生します。 この種の反応は、多くのエネルギー用途に利用されています。 「これらのプロトン共役電子移動反応は遍在しています。 これらは多くの場合、触媒機構の重要なステップであり、水素生成や燃料電池触媒などのエネルギー変換プロセスにとって特に重要です」とスレンドラナート氏は言う。 水素生成電解槽では、このアプローチを使用して水からプロトンを除去し、そのプロトンに電子を加えて水素ガスを形成します。 燃料電池では、水素ガスからプロトンと電子が除去され、酸素が加えられて水が形成されると、電気が生成されます。 プロトン結合電子移動は、二酸化炭素の還元 (電子とプロトンを加えることによる二酸化炭素の化学燃料への変換) など、他の多くの種類の化学反応で一般的です。 科学者は、陽子受容体が分子である場合にこれらの反応がどのように起こるかについて多くのことを学んできました。なぜなら、科学者は各分子の構造を正確に制御し、電子と陽子が分子間をどのように通過するかを観察できるからです。 ただし、プロトン結合電子移動が電極の表面で起こる場合、電極表面は通常非常に不均一であり、プロトンが結合する可能性のあるさまざまな部位が存在するため、そのプロセスを研究することははるかに困難です。 この障害を克服するために、MIT チームは、電極表面の組成をより正確に制御できる電極表面の設計方法を開発しました。 これらの電極は、表面に環を含む有機化合物が付着したグラフェンのシートで構成されています。 これらの有機分子のそれぞれの端には、周囲の溶液から陽子を受け入れることができる負に帯電した酸素イオンがあり、これにより電子が回路から黒鉛表面に流れ込みます。 「多種多様な部位から構成されるのではなく、それぞれが同じ親和性でプロトンを結合できる、非常に明確に定義された単一タイプの部位の均一な配列である電極を作成できます」とスレンドラナート氏は言う。 「私たちはこれらの非常に明確に定義されたサイトを持っているので、これによって私たちはこれらのプロセスの動態を実際に解明することができました。」このシステムを使用して、研究者らは電極への電流の流れを測定することができ、平衡状態における表面の酸素イオンへの陽子の移動速度、つまり表面への陽子の供与速度が変化する状態を計算することができました。表面から溶液に戻るプロトンの移動は等しい。 彼らは、周囲の溶液の pH がこの速度に大きな影響を与えることを発見しました。最も高い速度は、pH スケールの両端、つまり最も酸性の pH 0 と最も塩基性の pH 14 で発生しました。 これらの結果を説明するために、研究者は電極で起こり得る 2 つの考えられる反応に基づいたモデルを開発しました。 3O+)は、強酸性溶液中で高濃度に存在し、表面酸素イオンにプロトンを供給し、水を生成します。 2 番目では、水がプロトンを表面の酸素イオンに渡し、水酸化物イオン (OH) を生成します。–)、強塩基性溶液では高濃度になります。ただし、pH 0 での速度は、pH 14 での速度よりも約 XNUMX 倍速いです。その理由の XNUMX つは、ヒドロニウムが水よりも速い速度でプロトンを放出することです。考え直す反応
研究者らはまた、驚いたことに、ヒドロニウムと水酸化物の濃度が等しい中性pH 7ではなく、水酸化物イオンの濃度がヒドロニウムの10万倍であるpH 1ではXNUMXつの反応の速度が等しいことも発見した。このモデルは、ヒドロニウムまたは水からのプロトンの供与を伴う順反応が、水または水酸化物によるプロトンの除去を伴う逆反応よりも全体の速度に大きく寄与するためであることを示唆しています。これらの反応が電極表面でどのように起こるかについての既存のモデルは、順反応と逆反応が全体の反応速度に等しく寄与すると仮定しているため、今回の新たな発見は、これらのモデルを再検討する必要がある可能性があることを示唆している、と研究者らは述べている。 「これは、順反応と逆反応が反応速度に等しく寄与するというデフォルトの仮定です」とスレンドラナート氏は言う。 「私たちの発見は本当に目を見張るものです。なぜなら、人々が燃料電池の触媒作用から水素発生まであらゆるものを分析するために使用している仮定が、私たちが再考する必要があるかもしれないことを意味するからです。」研究者らは現在、実験装置を使用して、電極の周囲の電解質溶液にさまざまな種類のイオンを追加すると、プロトン結合電子の流れの速度がどのように加速または減速するかを研究している。 「私たちのシステムでは、サイトが一定で相互に影響を及ぼさないことがわかっているので、溶液の変化が表面の反応にどのような影響を与えているかを読み取ることができます」とルイス氏は言います。- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- PlatoData.Network 垂直生成 Ai。 自分自身に力を与えましょう。 こちらからアクセスしてください。
- プラトアイストリーム。 Web3 インテリジェンス。 知識増幅。 こちらからアクセスしてください。
- プラトンESG。 カーボン、 クリーンテック、 エネルギー、 環境、 太陽、 廃棄物管理。 こちらからアクセスしてください。
- プラトンヘルス。 バイオテクノロジーと臨床試験のインテリジェンス。 こちらからアクセスしてください。
- 情報源: https://www.nanowerk.com/news2/green/newsid=64425.php
- :持っている
- :は
- :not
- :どこ
- $UP
- 1
- 10
- 11
- 13
- 14
- 16
- 7
- 8
- a
- できる
- 私たちについて
- 同意
- 加えます
- 追加されました
- 追加
- 進める
- 影響を及ぼす
- 影響
- アレクサンダー
- 許可されて
- また
- 間で
- an
- 分析します
- および
- 別の
- 登場する
- 適用
- アプローチ
- です
- 配列
- AS
- 引き受けます
- 仮定
- At
- 著者
- 著者
- バック
- ベース
- 基本
- バッテリー
- BE
- なぜなら
- き
- の間に
- バインド
- 拘束
- 焙煎が極度に未発達や過発達のコーヒーにて、クロロゲン酸の味わいへの影響は強くなり、金属を思わせる味わいと乾いたマウスフィールを感じさせます。
- by
- 計算する
- 缶
- カーボン
- 二酸化炭素
- 原因
- セル
- 細胞
- センター
- 変化する
- 変更
- 荷担した
- 化学物質
- 化学
- 化学者
- コマンドと
- 構図
- 濃度
- 定数
- コンテキスト
- 貢献する
- 貢献する
- コントロール
- 変換
- 可能性
- カップル
- 作ります
- 重大な
- 電流プローブ
- 日付
- 取引
- デフォルト
- 定義済みの
- 配信する
- 提供します
- 設計
- 詳細
- 発展した
- Devices
- 異なります
- 難しい
- 発見
- 多様性
- do
- そうではありません
- すること
- 寄付
- ダウン
- ドライブ
- 各
- 効果
- 効率的な
- 電気
- 電気
- 電解質
- 電子
- end
- 終了
- エネルギー
- エンジニアリング
- 等しい
- 平等に
- 平衡
- エーテル(ETH)
- すべてのもの
- 進化
- 正確に
- 例
- 既存の
- 実験的
- 説明する
- 極端な
- 速いです
- 発見
- 調査結果
- 名
- 初回
- フロー
- フォーム
- 前者
- フォワード
- 発見
- 4
- フレームワーク
- から
- ガソリンタンク
- 燃料電池
- 燃料
- GAS
- 生成された
- 生成
- 世代
- 与える
- 卒業生
- グラフェン
- 素晴らしい
- 起こる
- 利用
- 持ってる
- ハート
- 助けます
- ハイ
- 最高
- 認定条件
- しかしながら
- HTTPS
- 水素化
- 画像
- 重要
- in
- 含めて
- に
- 関与
- IT
- JPG
- カール
- キー
- 種類
- 知っている
- つながる
- 学んだ
- ルイス
- 多くの
- 五月..
- 手段
- だけど
- メカニズム
- 真ん中
- 百万
- マサチューセッツ工科大学(MIT)
- MIT卒業
- モデル
- 分子
- 他には?
- もっと効率的
- 最も
- モーション
- 運動
- ずっと
- 自然
- 必要
- マイナスに
- 普通
- 新作
- ノア
- 今
- 観察する
- 障害
- 発生する
- 発生した
- of
- 頻繁に
- on
- or
- オーガニック
- その他
- 私たちの
- でる
- が
- 全体
- 克服する
- 酸素
- 紙素材
- 部
- 特に
- パス
- のワークプ
- プラトン
- プラトンデータインテリジェンス
- プラトデータ
- 可能
- 潜在的な
- :
- 正確な
- 正確に
- プロセス
- ラボレーション
- 作り出す
- 東京大学大学院海洋学研究室教授
- 陽子
- レート
- 価格表
- 反応
- 反応
- 読む
- 本当に
- 削減
- 関連した
- 除去
- 削除します
- 削除済み
- 再生可能な
- 再生可能エネルギー
- 研究
- 研究者
- 結果
- 明らかに
- 逆
- 右
- Ryan Tan
- s
- 同じ
- 言う
- 言う
- 規模
- 科学者
- 科学者たち
- 二番
- シニア
- 重要
- ウェブサイト
- サイト
- 遅く
- So
- 溶液
- ソリューション
- 何か
- スピード
- 都道府県
- 手順
- ステップ
- 刺激する
- 強く
- 構造
- 学生
- 勉強
- 勉強
- そのような
- 示唆する
- 提案する
- 表面
- 驚き
- 周囲の
- 取る
- チーム
- テクノロジー
- より
- それ
- ステート
- アプリ環境に合わせて
- それら
- ボーマン
- 彼ら
- この
- それらの
- 時間
- <font style="vertical-align: inherit;">回数</font>
- 〜へ
- 今日
- トレース
- 転送
- 転送
- 2
- type
- 遍在する
- 理解する
- 大学
- 解き明かす
- us
- 中古
- 通常
- 非常に
- ました
- 水
- 仕方..
- we
- 明確な
- した
- この試験は
- いつ
- which
- ワイド
- 以内
- ゼファーネット