東京、10年2023月3日 – (JCN Newswire) – 富士通株式会社と理化学研究所計算科学研究センターHPC・AI創薬基盤部門は本日、細胞の構造変化を予測できるAI創薬技術を開発したと発表しました。 2023年2023月には生成AIを活用し、電子顕微鏡画像からタンパク質を広範囲の10次元密度マップとして抽出する予定。さらに両社は、2023年XNUMX月に医療画像処理分野の最高峰の国際会議であるMICCAI XNUMXで本技術に関する論文発表を予定している。 XNUMX年XNUMX月XNUMX日(日本時間)。
また、今回の発表に合わせて、富士通はタンパク質の構造変化の予測技術を、AIイノベーションコンポーネントとして10年2023月XNUMX日に提供開始する予定です。 富士通 Kozuchi (コードネーム) – Fujitsu AI Platform、ユーザーが高度なテクノロジーをすぐにテストできる AI プラットフォームです。
富士通と理化学研究所は、2022年XNUMX月に開始した共同研究プロジェクトの一環として、電子顕微鏡で撮影した多数の投影画像から、標的タンパク質のさまざまな構造やその可能な比率を高精度に推定する生成AI技術を開発した。推定された割合から標的タンパク質の構造変化を予測する技術。 両社は、これらXNUMXつの技術をベースに、医薬品の開発期間と開発コストを大幅に削減する次世代IT創薬技術の開発を目指し、タンパク質の構造変化を広範囲に予測できるAI創薬技術を開発した。発見。
この技術により、実験データに基づいてタンパク質の立体構造や変化を従来のXNUMX倍以上の時間で正確に取得することが可能になります(1)により、細菌やウイルスなどの標的タンパク質に結合する薬剤の設計プロセスにおける革新が可能になります。
富士通と理化学研究所は今後、今回開発した生成AI技術を、標的タンパク質と抗体の複雑な関係を解析し、分子の全体的な構造変化を高精度に予測する次世代IT創薬技術の実現に向けたコア技術の一つとして活用していきます。正確さとスピード。
経歴
生物のライフサイクルや疾患メカニズムに密接に関与しているタンパク質は、本来非常に柔軟であり、その構造立体構造を変化させることによって生体内で他の分子と相互作用します。 例えば、表面タンパク質の構造変化によって感染を刺激する新型コロナウイルス感染症(COVID-19)のようなウイルスの感染を抑制する薬剤を開発するには、タンパク質のさまざまな構造状態と、それらが構造間でどのように変化するかを確認する必要がある。 しかし、従来の構造解析手法では高度な専門知識と試行錯誤が必要であり、正確な構造変化を把握するには多大な時間と費用がかかりました。 この課題を解決するために、富士通と理化学研究所は、生成AIを活用した以下のXNUMXつの新たな創薬技術を開発しました。
XNUMXつの創薬技術
富士通と理化学研究所は、富士通のディープラーニング技術の開発で培ったノウハウと、理化学研究所のスーパーコンピュータ「富岳」を活用した創薬分子シミュレーションの知見を応用し、XNUMXつの新たな創薬技術を開発しました。2)。 XNUMX つの技術を組み合わせることで、標的タンパク質の構造変化の予測時間が XNUMX 日から XNUMX 時間に短縮されました (3)により、製薬企業の創薬プロセスの迅速化と効率化に貢献します。 各技術の詳細は以下のとおりです。
1. タンパク質のさまざまな立体構造とその割合を高精度に推定する生成AI技術
広範囲にわたる標的タンパク質の構造変化を正確に予測するには、考えられる構造の形態とその正確な比率が必要です。 この研究では、富士通と理化学研究所は、多数の投影画像と特定の瞬間の対応する角度から各立体構造の 3D 密度マップを再構築しました。 同時に両者は、再構成された立体構造の頻度を手掛かりにその割合を推定した。
2. タンパク質の立体構造の低次元特徴に基づく立体構造変化予測技術
通常、標的タンパク質の構造は高次元のデータで表現されるため、その構造変化を直接予測することは困難です。 しかし、富士通と理化学研究所は、前項の生成AI技術により立体構造を再構成する過程で、立体構造の低次元の特徴を抽出しました。 富士通と理化学研究所は生成AI技術を用いて低次元データを解析し、3次元密度マップを復元することで構造変化を予測した。
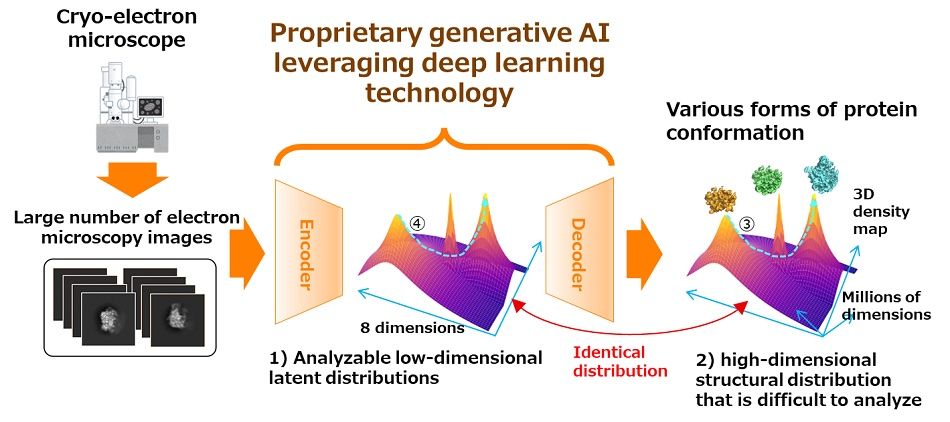
画像:新開発技術の概要 エンコーダとデコーダは、顕微鏡で十分に大量に撮影された画像を学習させます。 学習後は、解析が困難な構造分布 1) に相当する、潜在空間における解析可能な低次元分布 2) を得ることができます。 同時に、デコーダは低次元の特徴に対応するさまざまな 3D 密度マップを復元できます。将来の計画
富士通と理化学研究所は今後、今回開発したAI創薬技術を、標的タンパク質と抗体の複合体解析や分子の構造変化を高精度かつ高速に予測するコア技術の一つとして活用していきます。 理化学研究所は、医療分野におけるSociety5.0の実現に貢献するため、スーパーコンピュータ「富岳」上で創薬DXプラットフォームの構築を推進し、新技術の一つとして創薬プロセスの革新を目指しています。標的タンパク質の構造状態。 理研では、TRIP(4)研究分野全体で新しい知識分野を効果的に生み出す革新的な研究プラットフォームを作成することを目的としています。 なお、富士通は、タンパク質の構造変化予測技術を、「Fujitsu Kozuchi(開発コード名) – Fujitsu AI Platform」のAIイノベーションコアコンポーネントモジュールとして、10年2023月XNUMX日より提供開始する予定です。 下 富士通Uvance持続可能な世界の実現を目指し、富士通が推進する「 健康な暮らし、すべての人の人生経験を最大化します。 富士通は今後も、AIとHPCの強みを融合した技術開発により、医療分野における社会課題の解決に貢献していきます。
(1) 従来の手順:これは、論文 [キンマンら。 (2023年)]。 この手順では、ターゲットタンパク質の多数の投影画像によって学習された既存の生成 AI、cryoDRGN を使用してシーケンスが構築されます。
(2) スーパーコンピュータ「富岳」:「京」の後継として理化学研究所に設置されたコンピュータ。 スパコンランキングでは2020年2021月から4年4月まで9期連続2021部門でXNUMX位を獲得した。 XNUMX年XNUMX月XNUMX日より本格運用を開始しました。
(3) 標的タンパク質の構造変化の予測時間を XNUMX 日から XNUMX 時間に短縮します。よく使われる適用効果 リボソームデータ これら XNUMX つのテクノロジーに。 XNUMX 日のベンチマーク時間は、論文 [キンマンら。 (2023年)].
(4) 旅行 :理研プラットフォームの革新的研究イノベーションプラットフォーム
富士通について
富士通の目的は、イノベーションを通じて社会への信頼を築き、世界をより持続可能なものにすることです。 100 か国以上のお客様に選ばれるデジタル トランスフォーメーション パートナーとして、124,000 人の従業員が、人類が直面している最大の課題のいくつかを解決するために働いています。 当社の幅広いサービスとソリューションは、コンピューティング、ネットワーク、AI、データとセキュリティ、コンバージング テクノロジーの 6702 つの主要なテクノロジーを利用しており、これらを組み合わせて持続可能性の変革を実現しています。 富士通株式会社 (TSE:3.7) は、28 年 31 月 2023 日に終了した会計年度に XNUMX 兆円 (XNUMX 億米ドル) の連結収益を報告し、市場シェアで日本のトップのデジタル サービス企業であり続けています。 詳細をご覧ください: www.fujitsu.com.
理研計算科学センターについて
理研は、さまざまな科学分野における質の高い研究で知られる日本最大の総合研究機関です。 1917年に東京の民間研究財団として設立された理化学研究所は、その規模と範囲が急速に拡大し、現在では、理化学研究所計算科学センター(R-CCS)を含む全国の世界クラスの研究センターと研究所のネットワークを網羅しています。スーパーコンピュータ富岳。 R-CCSは、ハイパフォーマンスコンピューティングのリーダーシップセンターとして、「コンピューティング、コンピューティングによる、およびコンピューティングのための科学」を探求しています。 調査の結果(オープンソースソフトウェアなどのテクノロジー)は、そのコアコンピタンスです。 R-CCSは、コアコンピタンスを強化し、世界中の技術を促進するよう努めています。
プレスコンタクト
富士通株式会社広報・投資家向け広報部 お問い合わせ
理研計算科学推進室 E-mail: r-ccs-koho@ml.riken.jp
- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- PlatoData.Network 垂直生成 Ai。 自分自身に力を与えましょう。 こちらからアクセスしてください。
- プラトアイストリーム。 Web3 インテリジェンス。 知識増幅。 こちらからアクセスしてください。
- プラトンESG。 カーボン、 クリーンテック、 エネルギー、 環境、 太陽、 廃棄物管理。 こちらからアクセスしてください。
- プラトンヘルス。 バイオテクノロジーと臨床試験のインテリジェンス。 こちらからアクセスしてください。
- 情報源: https://www.jcnnewswire.com/pressrelease/86962/3/
- :持っている
- :は
- 000
- 1
- 10
- 100
- 2020
- 2021
- 2022
- 2023
- 31
- 3d
- 7
- 9
- a
- AC
- 精度
- 正確な
- 正確にデジタル化
- 買収
- 越えて
- 高度な
- 後
- AI
- AIプラットフォーム
- 目指す
- 目的としました
- 目指す
- 目指して
- AL
- ことができます
- また
- an
- 分析
- 分析します
- 分析
- 分析する
- および
- 発表の
- お知らせ
- 抗体
- 適用
- です
- AS
- At
- 利用できます
- 細菌
- ベース
- き
- ベンチマーク
- の間に
- 10億
- バインド
- 持って来る
- 建物
- by
- 缶
- カテゴリ
- センター
- センター
- 課題
- 変化する
- 変更
- 変化
- 選択
- 密接に
- コード
- 組み合わせ
- 組み合わせる
- 一般に
- 企業
- 会社
- 複雑な
- コンポーネント
- 包括的な
- 計算的
- コンピュータ
- コンピューティング
- 講演
- 共同
- 連続した
- かなりの
- 構築
- 建設
- 続ける
- 貢献する
- 貢献
- 従来の
- 収束する
- 融合テクノロジー
- 基本
- 対応する
- 費用
- 国
- コロナ
- 作成
- Customers
- データ
- 中
- 深いです
- 深い学習
- 配信する
- 厳しい
- 密度
- 記載された
- 設計
- 設計プロセス
- 細部
- 開発する
- 発展した
- 開発
- 開発
- 難しい
- デジタル
- デジタルサービス
- デジタルサービス会社
- 直接に
- しつけ
- 発見
- 病気
- ディストリビューション
- 異なる
- ディビジョン
- ドロー
- 薬
- 創薬
- 創薬
- 薬物
- DX
- メール
- E&T
- 各
- 効果
- 効果的に
- 効率
- 社員
- 可能
- 有効にする
- 包含する
- 終わった
- 高めます
- 十分な
- 同等の
- エラー
- 推定
- 推定
- 見積もり
- エーテル(ETH)
- 誰も
- 例
- 既存の
- 体験
- 実験的
- 専門知識
- 探査
- 探検する
- 表現
- 向い
- 特徴
- 特徴
- フィールド
- フィールズ
- もう完成させ、ワークスペースに掲示しましたか?
- 名
- 年度
- 五
- フレキシブル
- フォロー中
- 次
- フォーム
- フォワード
- Foundation
- 設立
- 周波数
- から
- 富士通
- フル
- さらに
- 未来
- 生成する
- 生々しい
- 生成AI
- 与えられた
- グローバル
- 最大
- 成長した
- 持ってる
- ハイ
- ハイパフォーマンス
- 高品質
- ホーム
- HOURS
- 認定条件
- しかしながら
- hpc
- HTML
- HTTPS
- 人類
- 画像
- 画像
- in
- 含めて
- 感染
- イニシアチブ
- 革新します
- 革新的手法
- 革新的な
- 機関
- 対話
- 世界全体
- 投資家
- IR部
- 関係する
- IT
- ITS
- 1月
- 日本
- JCNニュースワイヤー
- ジョイント
- JPG
- 六月
- キー
- 知識
- 大
- 最大の
- 打ち上げ
- リーダーシップ
- 学習
- less
- レベル
- 活用します
- 生活
- ライフサイクル
- 限定的
- 生活
- ロー
- make
- 地図
- ゲレンデマップ
- 3月
- 市場
- 市場占有率
- 最大化する
- 五月..
- メカニズム
- 医療の
- 薬
- メソッド
- 顕微鏡
- 顕微鏡検査
- モジュール
- 分子の
- 瞬間
- 他には?
- 名
- 自然
- 必要
- ネットワーク
- ネットワーク
- 新作
- 新技術
- 新しく
- ニュースワイヤー
- 次世代
- 11月
- November 2021
- 数
- 入手する
- 10月
- 10月
- of
- 提供すること
- Office
- on
- ONE
- 開いた
- オープンソース
- 操作
- その他
- 私たちの
- でる
- 成果
- アウトライン
- が
- 紙素材
- 部
- パーティー
- パートナー
- 薬剤
- 計画
- プラン
- プラットフォーム
- プラットフォーム
- プラトン
- プラトンデータインテリジェンス
- プラトデータ
- 可能
- 予測する
- 予測
- 予測
- 予測
- 予測
- 現在
- プライベート
- 問題
- 問題
- 手続き
- 手続き
- プロセス
- 処理
- プロジェクト
- 投影
- 推進する
- 推進
- プロモーション
- 割合
- タンパク質
- タンパク質
- 目的
- すぐに
- 範囲
- ランク
- 急速に
- 実現
- 実現する
- 実現
- 回復する
- 電話代などの費用を削減
- 軽減
- 指し
- 関係
- の関係
- 残っている
- 名高い
- 報告
- 必要とする
- 必要
- 研究
- 復元する
- 収入
- 理研
- ランニング
- s
- 同じ
- 科学
- 科学的な
- スコープ
- セキュリティ
- 送信
- シーケンス
- サービス
- サービス会社
- シェアする
- 著しく
- サイズ
- 社会
- 社会
- ソフトウェア
- ソリューション
- 解決する
- 解決
- 一部
- ソース
- スペース
- スピード
- start
- 売り出し
- 開始
- 米国
- 強み
- 努力する
- 構造の
- 構造
- 勉強
- そのような
- スーパーコンピュータ
- 表面
- 3つの柱
- 持続可能な
- 撮影
- ターゲット
- テクノロジー
- テクノロジー
- 10
- 条件
- test
- より
- それ
- 世界
- アプリ環境に合わせて
- それによって
- ボーマン
- 彼ら
- この
- それらの
- 介して
- 全体
- 時間
- <font style="vertical-align: inherit;">回数</font>
- 〜へ
- 今日
- 一緒に
- 東京
- top
- 訓練された
- トレーニング
- 変換
- 変革パートナー
- トライアル
- 試行錯誤
- 1兆
- 旅行
- 信頼
- 東証:6702
- 2
- 下
- つかいます
- 中古
- users
- 通常
- 活用
- さまざまな
- 非常に
- ウイルス
- 生体
- we
- WELL
- which
- ワイド
- 広い範囲
- 意志
- 仕事
- 世界
- ワールドクラス
- 年
- 円
- ゼファーネット