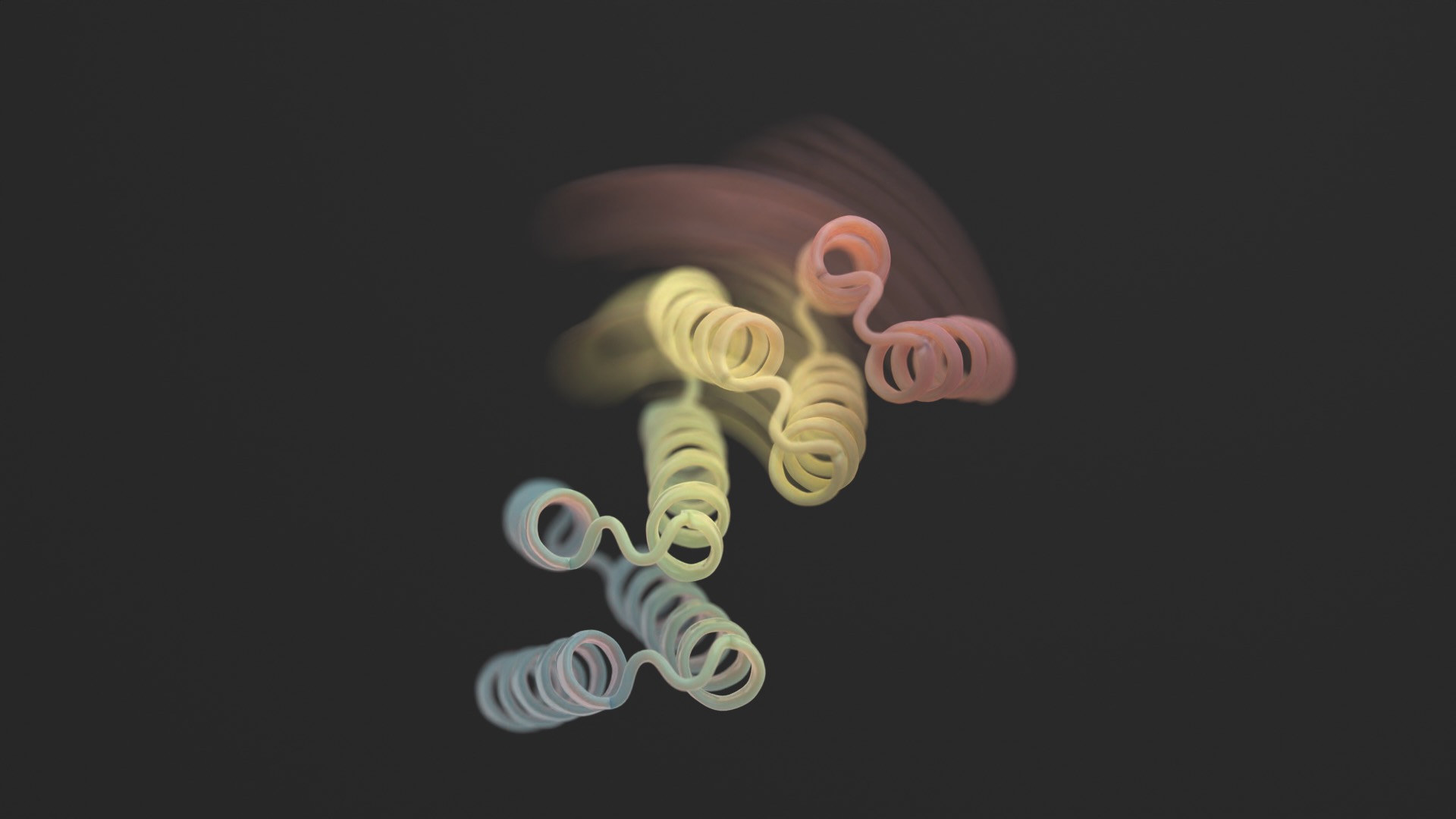
לעתים קרובות אנו חושבים על חלבונים כפסלים תלת מימדיים בלתי ניתנים לשינוי.
זה לא לגמרי נכון. חלבונים רבים הם שנאים שמתפתלים ומשנים את צורותיהם בהתאם לצרכים הביולוגיים. תצורה אחת עשויה להפיץ אותות מזיקים משבץ או התקף לב. אחר עלול לחסום את המפל המולקולרי שנוצר ולהגביל את הנזק.
במובן מסוים, חלבונים פועלים כמו טרנזיסטורים ביולוגיים - מתגי הדלקה-כיבוי בשורש ה"מחשב" המולקולרי של הגוף הקובעים כיצד הוא מגיב לכוחות ומשוב חיצוניים ופנימיים. מדענים חקרו זמן רב את החלבונים המשנים צורה כדי לפענח כיצד גופנו פועל.
אבל למה לסמוך על הטבע בלבד? האם נוכל ליצור "טרנזיסטורים" ביולוגיים, שאינם ידועים ליקום הביולוגי, מאפס?
הזן AI. שיטות למידה עמוקה מרובות כבר יכולות לחזות במדויק מבני חלבון -פריצת דרך חצי מאה בהתהוות. מחקרים שנערכו לאחר מכן באמצעות אלגוריתמים חזקים יותר ויותר, העלו מבנים חלבוניים הזויים שאינם קשורים על ידי כוחות האבולוציה.
עם זאת, למבנים הנוצרים בינה מלאכותית יש נפילה: למרות שהם מאוד מורכבים, רובם סטטיים לחלוטין - בעצם, מעין פסל חלבון דיגיטלי קפוא בזמן.
מחקר חדש in מדע החודש שבר את התבנית על ידי הוספת גמישות לחלבוני מעצבים. המבנים החדשים אינם מעוותים ללא גבולות. עם זאת, החלבונים המעצבים יכולים להתייצב לשתי צורות שונות - חשבו על ציר בתצורה פתוחה או סגורה - בהתאם ל"נעול" ביולוגי חיצוני. כל מצב מקביל ל-"0" או "1" של מחשב, אשר שולט לאחר מכן על הפלט של התא.
"לפני כן, יכולנו ליצור רק חלבונים בעלי תצורה יציבה אחת", אמר מחבר המחקר ד"ר פלוריאן פראטוריוס מאוניברסיטת וושינגטון. "עכשיו, סוף סוף נוכל ליצור חלבונים שזזים, מה שאמור לפתוח מגוון יוצא דופן של יישומים."
למחבר הראשי ד"ר דיוויד בייקר יש רעיונות: "מיצירת ננו-מבנים המגיבים לכימיקלים בסביבה ועד ליישומים במתן תרופות, אנחנו רק מתחילים לנצל את הפוטנציאל שלהם".
נישואי חלבון תוצרת AI
קצת ביולוגיה 101.
חלבונים בונים ומפעילים את גופנו. המקרומולקולות הללו מתחילות את מסעם מה-DNA. מידע גנטי מתורגם לחומצות אמינו, אבני הבניין של חלבון - חרוזי תמונה על חוט. כל מחרוזת מקופלת לאחר מכן לצורות תלת ממדיות מורכבות, כאשר חלקים מסוימים נדבקים לאחרים. נקראים מבנים משניים, חלק מהתצורות נראות כמו Twizzlers. אחרים אורגים לסדינים דמויי שטיח. צורות אלה מתבססות זו על זו, ויוצרות ארכיטקטורות חלבון מתוחכמות ביותר.
על ידי הבנת האופן שבו חלבונים מקבלים את צורותיהם, נוכל להנדס חלבונים חדשים מאפס, להרחיב את היקום הביולוגי וליצור כלי נשק חדשים נגד זיהומים ויראליים ומחלות אחרות.
עוד בשנת 2020, AlphaFold של DeepMind ו-RoseTTAFold של מעבדת דיוויד בייקר שברו את האינטרנט הביולוגי המבני על ידי חיזוי מדויק של מבני חלבון על סמך רצפי חומצות האמינו שלהם בלבד.
מאז, דגמי הבינה המלאכותית חזו את צורתו של כמעט כל חלבון המוכר - ולא ידוע - למדע. הכלים העוצמתיים האלה כבר מעצבים מחדש את המחקר הביולוגי, ועוזרים למדענים לאתר במהירות יעדים פוטנציאליים להילחם בעמידות לאנטיביוטיקה, למד את "שיכון" של ה-DNA שלנו, לפתח חיסונים חדשים או אפילו לשפוך אור על מחלות שפוגעות במוח, כמו מחלת פרקינסון.
ואז הגיעה פצצה: דגמי AI גנרטיביים, כמו DALL-E ו-ChatGPT, הציעו פוטנציאל מפתה. במקום פשוט לחזות מבני חלבון, למה לא יש לחלום בינה מלאכותית רומן לחלוטין מבני חלבון במקום? מחלבון הקושר הורמונים כדי לווסת את רמות הסידן ל אנזימים מלאכותיים שמזרזים ביולוגיות, תוצאות ראשוניות עוררו התלהבות והפוטנציאל לחלבונים מעוצבים ב-AI נראה אינסופי.
בראש התגליות הללו עומדת המעבדה של בייקר. זמן קצר לאחר שחרורו של RoseTTAFold, הם עוד פיתחו את האלגוריתם למסמר אתרים פונקציונליים על חלבון - היכן שהוא מקיים אינטראקציה עם חלבונים, תרופות או נוגדנים אחרים - סלל את הדרך למדענים לחלום תרופות חדשות שעדיין לא דמיינו.
אבל דבר אחד היה חסר: גמישות. מספר רב של חלבונים "משתנים" בצורתם כדי לשנות את המסר הביולוגי שלהם. התוצאה יכולה להיות ממש חיים או מוות: חלבון בשם Bax, למשל, משנה את צורתו לתוך מבנה שגורם למוות של תאים. עמילואיד בטא, חלבון המעורב במחלת האלצהיימר, נוטה לשמצה צורה שונה מכיוון שהוא פוגע בתאי המוח.
בינה מלאכותית שמזה חלבוני כפכפים דומים עשויה לקדם אותנו קרוב יותר להבנה ולחידוש החידות הביולוגיות הללו - מה שמוביל לפתרונות רפואיים חדשים.
ציר, קו וסינקר
לעצב חלבון אחד ברמה האטומית - ולקוות שהוא עובד בתא חי - קשה. עיצוב אחד עם שתי תצורות הוא סיוט.
כאנלוגיה רופפת, חשבו על גבישי קרח בענן שבסופו של דבר נוצרים לפתיתי שלג, כל אחד שונה במבנה. תפקידו של הבינה המלאכותית הוא לייצר חלבונים שיכולים לעבור בין שני "פתיתי שלג" שונים באמצעות אותם חומצת אמינו "גבישי קרח", כאשר כל מצב מתאים למתג "הפעלה" או "כיבוי". בנוסף, החלבון צריך לשחק יפה בתוך תאים חיים.
הצוות התחיל עם כמה כללים. ראשית, כל מבנה צריך להיראות שונה בתכלית בין שני המצבים - כמו פרופיל אנושי בעמידה או בישיבה. הם יכולים לבדוק זאת על ידי מדידת מרחקים בין אטומים, הסביר הצוות. שנית, השינוי צריך לקרות מהר. המשמעות היא שהחלבון לא יכול להתפרק לחלוטין לפני שהוא מחבר את עצמו בחזרה לצורה אחרת, מה שלוקח זמן.
אז יש כמה הנחיות לשמירה על הקרקע לחלבון פונקציונלי: הוא צריך לשחק יפה עם נוזלי הגוף בשתי המדינות. לבסוף, הוא צריך לפעול כמתג, לשנות את צורתו בהתאם לכניסות וליציאות.
המפגש עם כל "התכונות הללו במערכת חלבון אחת היא מאתגרת", אמר הצוות.
באמצעות שילוב של AlphaFold, Rosetta ו-proteinMPNN, העיצוב הסופי נראה כמו ציר. יש לו שני חלקים נוקשים שיכולים לנוע זה ביחס לזה, בעוד שחלק אחר נשאר מקופל. בדרך כלל החלבון סגור. הטריגר הוא פפטיד קטן - שרשרת קצרה של חומצות אמינו - הנקשר לצירים וגורם לשינוי צורתו. מה שמכונה "פפטידים אפקטורים" אלה תוכננו בקפידה עבור ספציפיות, והורידו את הסיכויים שלהם לתפוס חלקים מחוץ למטרה.
הצוות הוסיף לראשונה פפטידי טריגר זוהר בחושך למספר עיצובי צירים. ניתוח שלאחר מכן מצא שהדק תפס בקלות את הציר. תצורת החלבון השתנתה. כבדיקת שפיות, הצורה הייתה כזו שנחזה בעבר באמצעות ניתוח AI.
מחקרים נוספים באמצעות מבנים מגובשים של עיצובי החלבון, עם או בלי האפקטור, אימתו את התוצאות. מבחנים אלה גם צדו עקרונות עיצוב שגרמו לציר לעבוד, ופרמטרים שמטים מצב אחד לשני.
הטייק אווי? AI יכול כעת לעצב חלבונים עם שני מצבים שונים - בעצם בניית טרנזיסטורים ביולוגיים לביולוגיה סינתטית. לעת עתה, המערכת משתמשת רק בפפטידים אפקטורים מעוצבים במחקרים שלהם, מה שעשוי להגביל את הפוטנציאל המחקרי והקליני. אך לדברי הצוות, האסטרטגיה יכולה להתרחב גם לפפטידים טבעיים, כגון אלו הקושרים חלבונים המעורבים בוויסות הסוכר בדם, מווסתים מים ברקמות או משפיעים על פעילות המוח.
"כמו טרנזיסטורים במעגלים אלקטרוניים, אנחנו יכולים לחבר את המתגים ליציאות וכניסות חיצוניות כדי ליצור מכשירי חישה ולשלב אותם במערכות חלבון גדולות יותר", אמר הצוות.
מחבר המחקר, ד"ר פיליפ ליונג, מוסיף: "זה יכול לחולל מהפכה בביוטכנולוגיה באותו האופן שבו טרנזיסטורים שינו את האלקטרוניקה".
קרדיט תמונה: Ian C Haydon/ UW Institute for Protein Design
- הפצת תוכן ויחסי ציבור מופעל על ידי SEO. קבל הגברה היום.
- PlatoData.Network Vertical Generative Ai. העצים את עצמך. גישה כאן.
- PlatoAiStream. Web3 Intelligence. הידע מוגבר. גישה כאן.
- PlatoESG. רכב / רכבים חשמליים, פחמן, קלינטק, אנרגיה, סביבה, שמש, ניהול פסולת. גישה כאן.
- PlatoHealth. מודיעין ביוטכנולוגיה וניסויים קליניים. גישה כאן.
- ChartPrime. הרם את משחק המסחר שלך עם ChartPrime. גישה כאן.
- BlockOffsets. מודרניזציה של בעלות על קיזוז סביבתי. גישה כאן.
- מקור: https://singularityhub.com/2023/08/22/ai-can-now-design-proteins-that-behave-like-biological-transistors/
- :יש ל
- :הוא
- :לֹא
- $ למעלה
- 2020
- 3d
- a
- AC
- פי
- במדויק
- לפעול
- פעילות
- הוסיף
- מוסיף
- בנוסף
- מוסיף
- לאחר
- נגד
- AI
- דגמי AI
- אַלגוֹרִיתְם
- אלגוריתמים
- תעשיות
- לבד
- כְּבָר
- גם
- למרות
- אלצהיימר
- עמילואיד
- an
- אנליזה
- ו
- אחר
- יישומים
- ARE
- AS
- At
- לתקוף
- מחבר
- רָחוֹק
- בחזרה
- אופה
- מבוסס
- BE
- לפני
- החל
- להתחיל
- בטא
- בֵּין
- לאגד
- ביולוגיה
- ביוטכנולוגיה
- קצת
- לחסום
- אבני
- דם
- גופים
- שניהם
- מוֹחַ
- פעילות מוחית
- תאי מוח
- פריצת דרך
- חסר פרוטה
- לִבנוֹת
- בִּניָן
- אבל
- by
- נקרא
- הגיע
- CAN
- בזהירות
- מפלה
- לזרז
- תא
- תאים
- מאה
- שרשרת
- אתגר
- סיכויים
- שינוי
- השתנה
- משתנה
- ChatGPT
- לבדוק
- כימיקלים
- קליני
- סגור
- קרוב יותר
- ענן
- לחלוטין
- תְצוּרָה
- בקרות
- תוֹאֵם
- יכול
- זוג
- לִיצוֹר
- יוצרים
- אשראי
- של דאל
- ניזק
- דוד
- מוות
- לפענח
- עמוק
- למידה עמוקה
- Deepmind
- מסירה
- תלוי
- עיצוב
- עקרונות עיצוב
- מעוצב
- מְעַצֵב
- תכנון
- עיצובים
- קביעה
- מפותח
- התקנים
- אחר
- דיגיטלי
- מַחֲלָה
- מחלות
- ה-DNA
- מטה
- נפילה
- dr
- חלום
- תרופה
- משלוח סמים
- סמים
- כל אחד
- בקלות
- אדג '
- אפקטור
- או
- אֶלֶקטרוֹנִי
- מכשירי חשמל
- אין סופי
- מהנדס
- התלהבות
- סביבה
- אֲפִילוּ
- בסופו של דבר
- כל
- אבולוציה
- דוגמה
- הרחבת
- מוסבר
- להאריך
- חיצוני
- יוצא דופן
- מהר
- מָשׁוֹב
- סופי
- בסופו של דבר
- ראשון
- גמישות
- בעד
- כוחות
- טופס
- מצא
- החל מ-
- קפוא
- פונקציה
- פונקציונלי
- נוסף
- לְהַשִׂיג
- גנרטטיבית
- AI Generative
- הנחיות
- היה
- חצי
- לקרות
- קשה
- לפגוע
- ניזקים
- יש
- לֵב
- התקף לב
- עזרה
- מאוד
- צִיר
- מקווה
- איך
- אולם
- HTTPS
- בן אנוש
- קרח
- רעיונות
- דמיינו
- בלתי ניתן לשינוי
- in
- בע"מ
- יותר ויותר
- זיהומים
- להשפיע
- מידע
- בתחילה
- תשומות
- בתוך
- במקום
- מכון
- אינטראקטיבי
- פנימי
- אינטרנט
- אל תוך
- מעורב
- IT
- שֶׁלָה
- עצמו
- עבודה
- מסע
- רק
- מעבדה
- גָדוֹל
- גדול יותר
- למידה
- רמות
- החיים
- אוֹר
- כמו
- להגביל
- גבולות
- קו
- חי
- ארוך
- נראה
- נראה כמו
- נראה
- הורדה
- עשוי
- לעשות
- רב
- מאי..
- אומר
- מדידת
- רפואי
- הודעה
- שיטות
- חסר
- לערבב
- מודלים
- מולקולרי
- חוֹדֶשׁ
- רוב
- המהלך
- מספר
- טבעי
- טבע
- צרכי
- חדש
- נחמד
- NIH
- בדרך כלל
- עַכשָׁיו
- מספר
- of
- מוצע
- לעתים קרובות
- on
- ONE
- יחידות
- רק
- לפתוח
- or
- אחר
- אחרים
- שלנו
- תפוקה
- פרמטרים
- חלקים
- לְחַבֵּר
- אפלטון
- מודיעין אפלטון
- אפלטון נתונים
- לְשַׂחֵק
- פוטנציאל
- פוטנציאל
- חזק
- לחזות
- חזה
- ניבוי
- קוֹדֶם
- עקרונות
- פּרוֹפִיל
- נכסים
- נוף
- חֶלְבּוֹן
- חלבונים
- מָהִיר
- מהירות
- רכס
- במקום
- מגיב
- להסדיר
- המסדיר
- קרוב משפחה
- שחרור
- לסמוך
- שְׂרִידִים
- מחקר
- להגיב
- תוצאה
- וכתוצאה מכך
- תוצאות
- לְחוֹלֵל מַהְפֵּכָה
- תקין
- נוקשה
- שורש
- כללי
- הפעלה
- אמר
- אותו
- מדע
- מדענים
- לגרד
- שְׁנִיָה
- משני
- נראה
- כמה
- צוּרָה
- צורות
- לִשְׁפּוֹך
- משמרת
- קצר
- בקצרה
- צריך
- אותות
- דומה
- בפשטות
- אתרים
- ישיבה
- קטן
- פתיתי שלג
- פתרונות
- כמה
- מתוחכם
- נצצו
- ספֵּצִיפִיוּת
- לייצב
- יציב
- החל
- מדינה
- הברית
- דִבּוּק
- אִסטרָטֶגִיָה
- מחרוזת
- מִבנִי
- מִבְנֶה
- מְחוֹשָׁב
- מחקרים
- לימוד
- לאחר מכן
- כתוצאה מכך
- כזה
- סוכר
- מתג
- סינטטי
- מערכת
- מערכות
- לקחת
- לוקח
- ברז
- מטרות
- נבחרת
- בדיקות
- מֵאֲשֶׁר
- זֶה
- השמיים
- שֶׁלָהֶם
- אותם
- אז
- שם.
- אלה
- הֵם
- דבר
- לחשוב
- זֶה
- אלה
- זמן
- טיפ
- רקמות
- ל
- יַחַד
- כלים
- טרנספורמציה
- רוֹבּוֹטרִיקִים
- להפעיל
- לפתול
- שתיים
- הבנה
- עולם
- אוניברסיטה
- אוניברסיטת וושינגטון
- לא ידוע
- us
- שימושים
- באמצעות
- תוקף
- נגיפי
- היה
- וושינגטון
- מים
- דֶרֶך..
- we
- נשק
- מארג
- אינטרנט
- היו
- אשר
- בזמן
- למה
- עם
- לְלֹא
- תיק עבודות
- עובד
- עוד
- זפירנט