La NMPA a publié le document finalisé « Directive on Medical Device Real-world Study Design and Statistical Analysis » le 15 janvier 2024. La version préliminaire a été publiée le 28 septembre 2023.
Importance de la ligne directrice
La directive aidera les fabricants étrangers à explorer davantage le programme pilote de données du monde réel de Hainan.
La zone pilote de Hainan Boao autorise l'utilisation en Chine de dispositifs médicaux, de DIV et de médicaments non approuvés à l'étranger, avec un statut d'urgence clinique. Lors de la commercialisation et de la vente de leurs produits, les fabricants peuvent collecter les RWD via RWS à Hainan en tant que preuve clinique locale en Chine pour étayer leur approbation nationale d'enregistrement auprès de la NMPA. Le programme spécial pourrait accélérer leur accès au marché chinois à quatre mois.
Le gouvernement de Hainan a publié le «Règlement sur l'administration de médicaments et de dispositifs médicaux importés à usage urgent dans la zone pilote de tourisme médical international de Boao Lecheng du port de libre-échange de Hainan" le 28 mars 2023. Le document indique qu'il n'exige PAS d'essais de type locaux ni de charge de preuve importante comme approbation nationale.
Points saillants de la ligne directrice
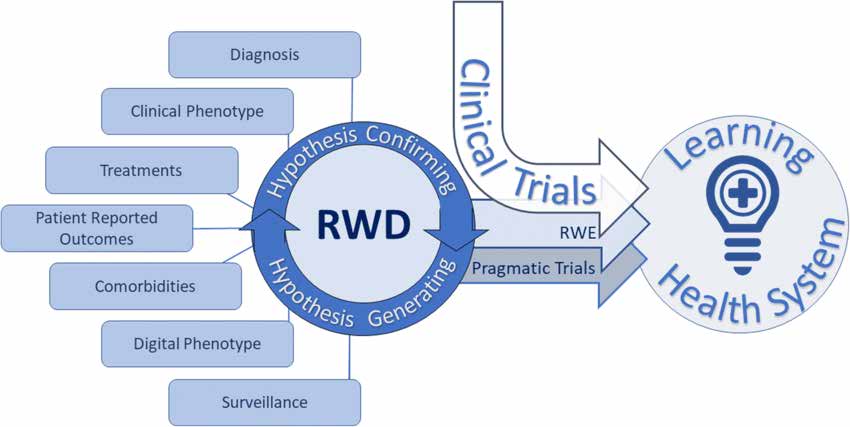
Le document sur la conception des études et l’analyse statistique décrit différents types de recherche dans le monde réel comme suit :
Les essais contrôlés randomisés pragmatiques (pRCT) sont conçus pour évaluer les résultats du traitement dans des contextes de soins de santé réels. Ils emploient des groupes de randomisation et de contrôle pour évaluer l'efficacité de l'intervention. Les pRCT fournissent des preuves concrètes de haute qualité et conviennent à diverses populations de patients et scénarios cliniques.
La recherche observationnelle dans le monde réel comprend divers modèles d'étude :
- Modèles d'étude descriptive décrire les caractéristiques ou l’état de santé du patient sans en déduire de causalité.
- Conceptions de cohortes suivez les résultats dans différents groupes de patients en fonction de l'utilisation de l'appareil, avec des options prospectives et rétrospectives.
- Conceptions cas-témoins et dérivées comparer les patients avec et sans utilisation d'appareil et inclure des études cas-témoins et de cohortes imbriquées.
- Données du monde réel comme contrôles externes impliquent d’utiliser des données du monde réel comme groupe témoin, même si des lignes directrices détaillées font défaut.
Le document présente les considérations à prendre en compte pour la conception de protocoles de recherche réels :
- Contexte et objectifs: Définir le contexte de la recherche, les objectifs et les problèmes de sécurité et d'efficacité sur la base des données existantes.
- Évaluation de la faisabilité: Évaluer la faisabilité de mener des recherches dans le monde réel, en tenant compte de la disponibilité des données, de leur qualité et des variables confondantes.
- Sélectionnez un modèle de recherche approprié: Choisissez la conception en fonction d'objectifs, qu'ils soient expérimentaux ou observationnels.
- Organigramme de l'étude: Créez un organigramme détaillant le processus d'étude, y compris la sélection des patients, les interventions et les examens.
- Définir la population étudiée: Définir clairement les critères d'inclusion et d'exclusion pour la population étudiée.
- Exposition de l'appareil: Évaluez la manière dont les patients sont exposés au dispositif, en tenant compte des biais potentiels.
- Groupe de contrôle: Déterminez les groupes témoins appropriés pour les études observationnelles afin d’équilibrer les variables confondantes.
- Mesures de résultats: Définir les mesures des résultats, y compris leur objectif, leur définition et leurs méthodes de mesure.
- Collecte des Données: Développer des formulaires et des dictionnaires de collecte de données, spécifiant les sources de données, les informations de qualité et les méthodes de couplage.
- Ajustement pour variable confondantes : Identifiez les variables confusionnelles et incluez/excluez-les avec les raisons.
- Temps de suivi: Définir des délais de suivi ou d'observation des patients pour répondre adéquatement aux questions de recherche.
- Taille de l'échantillon et calcul de la puissance: Calculez la taille de l’échantillon et la puissance statistique, en tenant compte de divers facteurs.
Il souligne également l’importance du contrôle qualité :
- Qualité des données: Évaluez la qualité des données en termes de représentativité, d’exhaustivité, d’exactitude, etc.
- Risque de biais: Décrire les mesures visant à contrôler les risques de biais à différentes étapes, y compris la sélection, l'information et les biais confusionnels.
- Évaluation du biais : Reconnaître les différents types de biais et évaluer leur direction et leur ampleur.
- Examen éthique: Veiller à ce que les examens éthiques et le consentement éclairé soient conformes à la réglementation.
Comparaison de deux versions
Par rapport à la version préliminaire, le document final mentionne la « Détermination des variables confondantes qui nécessitent une modification » dans la section Analyse statistique.
Dans les modèles de recherche non randomisés du monde réel, l’identification des variables confondantes est cruciale pour contrôler les biais. Trois critères sont utilisés pour les identifier : une variable a une relation causale avec le résultat, est associée à la variable de regroupement (exposition) et n'est pas une variable intermédiaire dans le chemin causal. Une approche recommandée implique un processus de sélection de variables rationnel basé sur les connaissances professionnelles et l'expérience clinique, avec la collaboration d'experts cliniques et statistiques. Pour les variables incertaines, une analyse de sensibilité est suggérée, en fournissant les raisons et les données à l'appui de l'inclusion/exclusion. Une approche conservatrice de sélection de variables est conseillée, en évitant les variables non liées et en tenant compte de problèmes tels que la multicolinéarité et les effets d'interaction, visualisés via des graphiques acycliques dirigés (DAG).
Pour une copie anglaise de la ligne directrice, veuillez envoyer un e-mail info@ChinaMedDvice.com. Nous facturons des frais nominaux pour la traduction.
Voir le dernières nouvelles sur le programme Hainan Real World Data.
Voir le ligne directrice de communication travailler avec les autorités de régulation.
Affichez notre webinaire enregistré sur les politiques de Hainan.
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- PlatoData.Network Ai générative verticale. Autonomisez-vous. Accéder ici.
- PlatoAiStream. Intelligence Web3. Connaissance Amplifiée. Accéder ici.
- PlatonESG. Carbone, Technologie propre, Énergie, Environnement, Solaire, La gestion des déchets. Accéder ici.
- PlatoHealth. Veille biotechnologique et essais cliniques. Accéder ici.
- La source: https://chinameddevice.com/real-world-study-nmpa/
- :possède
- :est
- :ne pas
- 15%
- 2023
- 2024
- 28
- a
- accès
- précision
- acyclique
- adéquatement
- administration
- informé
- permet
- aussi
- an
- selon une analyse de l’Université de Princeton
- ainsi que
- répondre
- une approche
- approprié
- approbation
- SONT
- AS
- Evaluer
- associé
- At
- Pouvoirs publics
- disponibilité
- en évitant
- fond
- Balance
- basé
- BE
- biais
- biais
- fardeau
- calculer
- CAN
- caractéristiques
- charge
- Chine
- Selectionnez
- clairement
- Infos sur les
- collaboration
- recueillir
- collection
- COM
- se conformer
- conditions
- conduite
- consentement
- conservateur
- considérations
- considérant
- des bactéries
- contrôlée
- contrôle
- contrôles
- engendrent
- critères
- crucial
- données
- qualité des données
- Vous permet de définir
- définition
- Dérivé
- décrire
- décrit
- Conception
- un
- conception
- Avec nos Bagues Halo
- détaillé
- Detailing
- Déterminer
- développer
- dispositif
- Compatibles
- différent
- dirigé
- direction
- plusieurs
- document
- avant-projet
- Médicaments
- efficacité
- les effets
- souligne
- Anglais
- assurer
- éthique
- évaluer
- preuve
- existant
- d'experience
- expérimental
- de santé
- explorez
- exposé
- Exposition
- externe
- faciliter
- facteurs
- faisabilité
- Frais
- finale
- Finalisé
- Abonnement
- Pour
- document
- Gratuit
- plus
- Gouvernement
- graphiques
- Réservation de groupe
- Groupes
- lignes directrices
- Santé
- la médecine
- de haute qualité
- Comment
- HTTPS
- identifier
- identifier
- importance
- in
- comprendre
- inclut
- Y compris
- inclusion
- d'information
- Actualités
- l'interaction
- Intermédiaire
- International
- intervention
- interventions
- implique
- vous aider à faire face aux problèmes qui vous perturbent
- IT
- Janvier
- jpg
- spécialisées
- manque
- leader
- comme
- locales
- Fabricants
- Mars
- Marché
- mesures
- les mesures
- médical
- dispositif médical
- dispositifs médicaux
- mentions
- méthodes
- pourrait
- mois
- PLUS
- Nationales
- Besoin
- objectifs
- observation
- observationnel
- of
- on
- Options
- or
- nos
- Résultat
- les résultats
- grandes lignes
- à l'étranger
- chemin
- patientforward
- patients
- pilote
- Platon
- Intelligence des données Platon
- PlatonDonnées
- veuillez cliquer
- politiques
- population
- populations
- défaillances
- power
- processus
- Produits
- professionels
- Programme
- preuve
- éventuel
- protocoles
- fournir
- aportando
- publié
- but
- qualité
- fréquemment posées
- Randomisé
- Rationnel
- réal
- monde réel
- Les raisons
- recommandé
- Inscription
- règlements
- régulateurs
- relation amoureuse
- libéré
- exigent
- un article
- Avis
- risques
- Sécurité
- dit
- scénarios
- Section
- sélection
- Disponible
- Sensibilité
- Septembre
- Paramétres
- significative
- Taille
- Sources
- spécial
- étapes
- statistique
- Statut
- études
- Étude
- convient
- Support
- Appuyer
- conditions
- Essais
- qui
- La
- leur
- Les
- l'ont
- bien que?
- trois
- Avec
- fois
- à
- Tourisme
- suivre
- commerce
- Traduction
- traitement
- essais cliniques
- deux
- type
- types
- Incertain
- urgence
- urgent
- utilisé
- d'utiliser
- en utilisant
- variable
- divers
- version
- était
- we
- que
- tout en
- sera
- comprenant
- sans
- de travail
- world
- zéphyrnet