Le ministère américain de la Santé et des Services sociaux (HHS) a accordé 49.5 millions de dollars à MaximBio, basée dans le Maryland, pour renforcer ses capacités de fabrication de tests de diagnostic.
Le financement a été accordé par l’Administration américaine pour la préparation et la réponse stratégiques (ASPR) et fait partie d’une initiative plus large de l’administration Biden-Harris.
L’initiative Biden-Harris comprenait le versement d’une subvention de 600 millions de dollars à 12 fabricants de tests Covid-19 basés aux États-Unis. En outre, le HHS a rouvert COVIDTests.gov pour fournir gratuitement des tests Covid-19 aux ménages à travers les États-Unis.
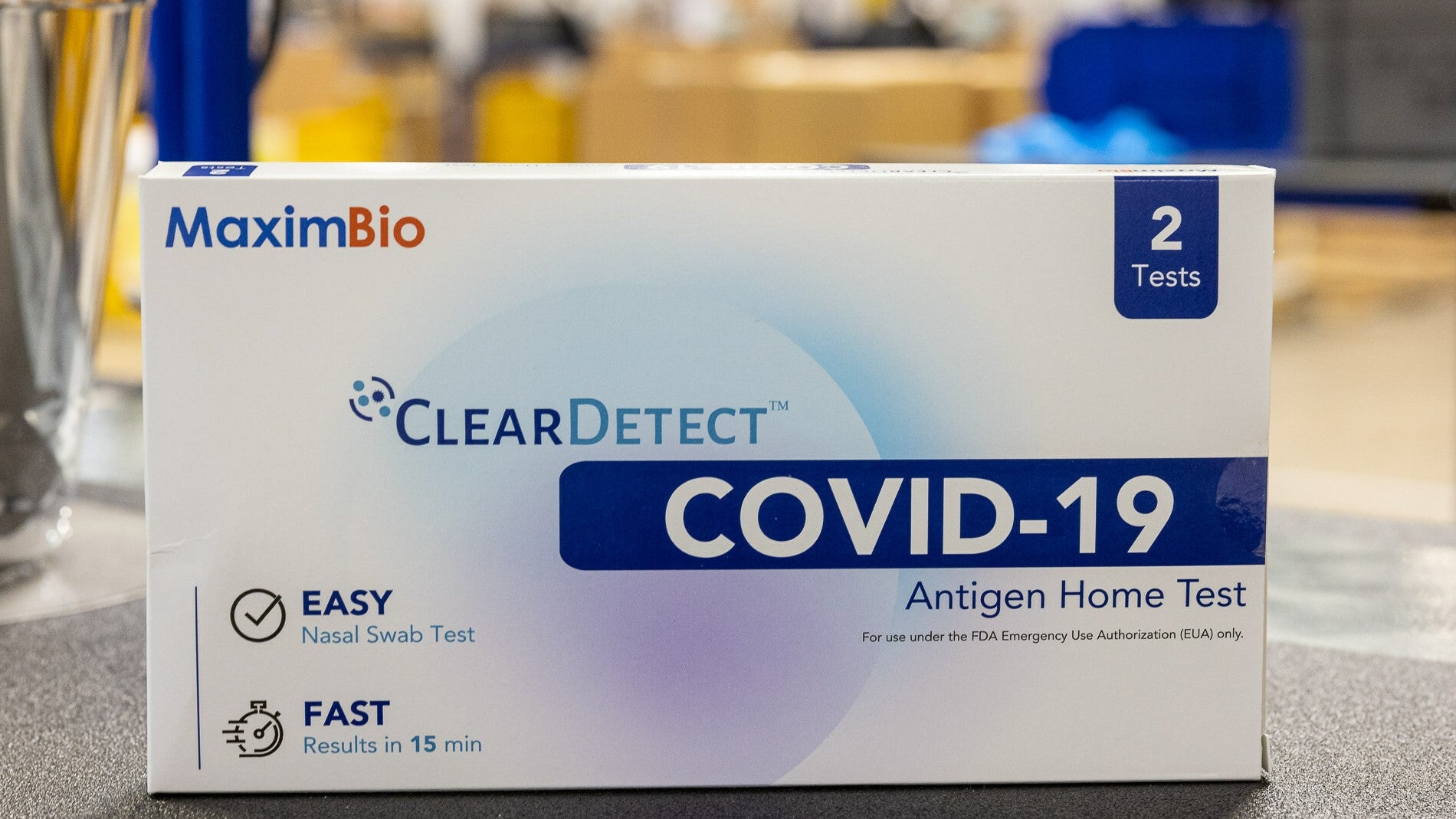
Le test à domicile d'antigène ClearDetect Covid-19 de MaximBio a été développé grâce à des subventions du Département américain de la Défense (DoD) et des National Institutes of Health (NIH) dans le cadre de l'initiative Rapid Acceleration of Diagnostics (RADx). Le test détecte les antigènes spécifiques du Covid-19 dans l’écouvillon nasal.
Test ClearDetect de MaximBio a été autorisé pour une utilisation diagnostique in vitro par l'autorisation d'utilisation d'urgence de la Food and Drug Administration (FDA) des États-Unis en 2022. En septembre 2023, MaximBio a mis à jour les tests ClearDetect pour augmenter la date d'expiration de la durée de conservation du test à 24 mois, lorsqu'il est conservé à 4°C. C-30°C.
Il y a eu un regain d’intérêt pour le Covid-19 diagnostics et traitements à la lumière des nouvelles sous-variantes d’Omicron. Le marché du diagnostic in vitro du Covid-19 devrait représenter environ 3 milliards de dollars en 2030, selon Le modèle de marché de GlobalData.
Accédez aux profils d’entreprises les plus complets
sur le marché, propulsé par GlobalData. Économisez des heures de recherche. Bénéficiez d’un avantage concurrentiel.

Profil de l'entreprise – gratuit
échantillon
Votre e-mail de téléchargement arrivera sous peu
Nous sommes confiants quant au
expérience unique et authentique
qualité de nos profils d’entreprise. Cependant, nous voulons que vous profitiez au maximum
avantageux
décision pour votre entreprise, nous proposons donc un échantillon gratuit que vous pouvez télécharger par
en soumettant le formulaire ci-dessous
Par GlobalData
En novembre 2023, les laboratoires ACON basés aux États-Unis a reçu une autorisation de commercialisation 510(k) de la FDA pour son test à domicile d'antigène Flowflex Covid-19. Le test antigénique rapide en vente libre permet de détecter la nouvelle variante du Covid-19.
Juin dernier, Indice de santé aussi reçu autorisation de novo de la FDA pour son test Covid-19 à domicile, le test moléculaire Cue Covid-19. Le test d’amplification moléculaire des acides nucléiques peut détecter le virus SARS-CoV-2 et peut être utilisé aussi bien au point de service qu’à domicile.
Parmi les autres bénéficiaires de la subvention américaine de 600 millions de dollars du HHS, citons iHealth Lab, basé en Californie, qui a reçu 167 millions de dollars pour son test rapide d'antigène iHealth Covid-19. Access Bio, basé au New Jersey, et CorDx, basé en Californie, ont reçu respectivement 88.7 millions de dollars et 86.4 millions de dollars pour leurs tests immunologiques à flux latéral, le test CorDx Covid-19 Ag et Test à domicile d'antigène CareStart Covid-19.
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- PlatoData.Network Ai générative verticale. Autonomisez-vous. Accéder ici.
- PlatoAiStream. Intelligence Web3. Connaissance Amplifiée. Accéder ici.
- PlatonESG. Carbone, Technologie propre, Énergie, Environnement, Solaire, La gestion des déchets. Accéder ici.
- PlatoHealth. Veille biotechnologique et essais cliniques. Accéder ici.
- La source: https://www.medicaldevice-network.com/news/maximbio-wins-49-5m-us-health-award-to-manufacture-covid-19-tests/
- :possède
- :est
- $UP
- 11
- 12
- 2022
- 2023
- 2030
- 24
- 7
- 8
- 9
- a
- A Propos
- accélération
- accès
- à travers
- administration
- AG
- aussi
- Amplification
- an
- et les
- d'environ
- SONT
- article
- AS
- At
- autorisation
- prix
- attribué
- bannière
- BE
- était
- ci-dessous
- avantageux
- tous les deux
- plus large
- la performance des entreprises
- by
- CAN
- capacités
- Société
- compétitif
- complet
- confiance
- COVID-19
- crédit
- Tous les jours
- Nouvelles quotidiennes
- Date
- décision
- Défense
- livrer
- Département
- département de la Défense
- détecter
- diagnostique
- diagnostic
- DoD
- download
- drogue
- Edge
- urgence climatique.
- fin
- expiration
- fda
- flux
- nourriture
- Pour
- formulaire
- fortifier
- gratuitement ici
- De
- financement
- Gain
- GlobalData
- subvention
- Santé
- Accueil
- HEURES
- ménages
- Cependant
- HTTPS
- humain
- ICON
- image
- in
- inclus
- Améliore
- industrie
- Aperçus de l'industrie
- initiative
- idées.
- intérêt
- SES
- jpg
- juin
- laboratoire
- laboratoires
- conduisant
- lumière
- a prendre une
- Fabricants
- fabrication
- Marché
- Stratégie
- moléculaire
- mois
- (en fait, presque toutes)
- nasale
- Nationales
- National Institutes of Health
- Nouveauté
- nouvelles
- Newsletter
- NIH
- Novembre
- Nouveau
- of
- code
- on
- nos
- Notre Entreprise
- sur le comptoir
- partie
- /
- Platon
- Intelligence des données Platon
- PlatonDonnées
- alimenté
- Profil
- Profils
- qualité
- Nos tests de diagnostic produisent des résultats rapides et précis sans nécessiter d'équipement de laboratoire complexe et coûteux,
- reçu
- destinataires
- un article
- respectivement
- réponse
- SRAS-CoV-2
- Épargnez
- Septembre
- Services
- Paramétres
- So
- Commencer
- stockée
- Stratégique
- SVG
- tester
- tests
- qui
- Le
- leur
- this
- Avec
- à
- traitement
- expérience unique et authentique
- a actualisé
- us
- US Department of Defense
- Nourriture américaine
- utilisé
- d'utiliser
- en utilisant
- Variante
- virus
- souhaitez
- était
- we
- quand
- qui
- sera
- Gagne
- comprenant
- vaut
- you
- Votre
- zéphyrnet